
- •2 Кислотно-основные методы
- •2.1 Краткие теоретические основы метода
- •2.1.1 Кислотно-основное взаимодействие
- •Классификация кислот и оснований в зависимости от величины их рКа
- •Величины рКа оснований в различных растворителях
- •2.1.2 Титрованные растворы
- •Титранты кислотно-основного метода
- •2.1.3 Установление конца титрования с помощью визуальных индикаторов
- •Интервал перехода окраски и показателя титрования кислотно-основных индикаторов
- •Данные для эмпирического выбора индикатора при кислотно-основном титровании
- •Интервалы рН и изменение цвета индикаторов (гф XI, вып.2, стр. 102)
- •2.1.4 Определение ингредиентов многокомпонентных лекарственных форм
- •2.1.5 Варианты и способы кислотно-основного титрования
- •2.2 Ацидиметрия
- •2.2.1 Вариант нейтрализации
- •2.2.2 Вариант вытеснения
- •2.2.3 Вариант гидролитического разложения
- •2.3.2 Вариант вытеснения
- •2.3.3 Вариант гидролитического разложения
- •2.3.4 Косвенное титрование
- •Соле- и комплексообразование
- •Конденсация
- •2.4 Титрование в неводных растворителях
- •Примеры дифференцирующего действия растворителя
- •Пример нивелирующего действия растворителя
- •2.4.1 Титрование в среде протогенных растворителей. Ацидиметрия
- •Определение кофеина
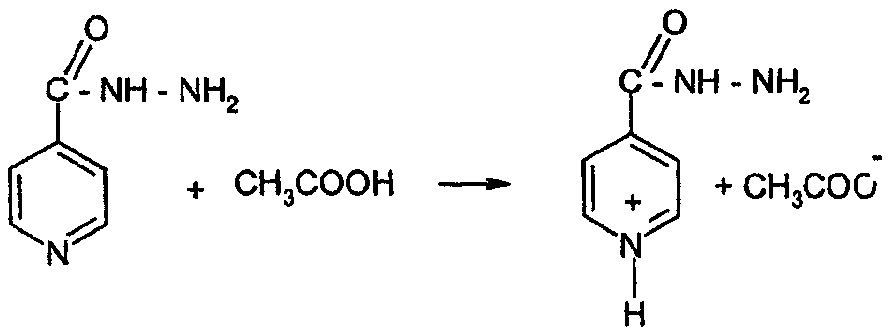
- •Определение изониазида
- •Определение дибазола
- •Определение атропина сульфата
- •2.4.2 Титрование в среде протофильных растворителей. Алкалиметрия
- •Определение теобромина
- •Определение фталазола
Определение кофеина
1. Диссоциация растворителя
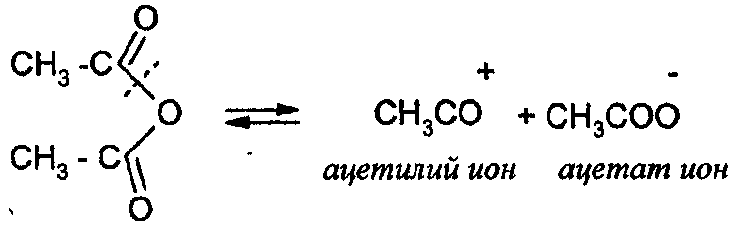
2. Ионизация основания

Перенос протона
HClO4 + CH3COOH → ClO4- + CH3COOH2+
Солеобразование
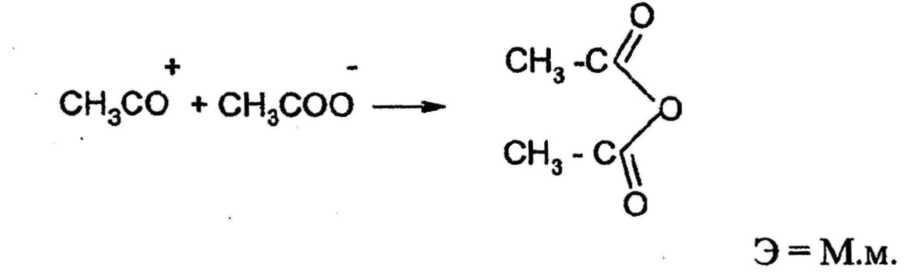
5. Регенерация растворителя
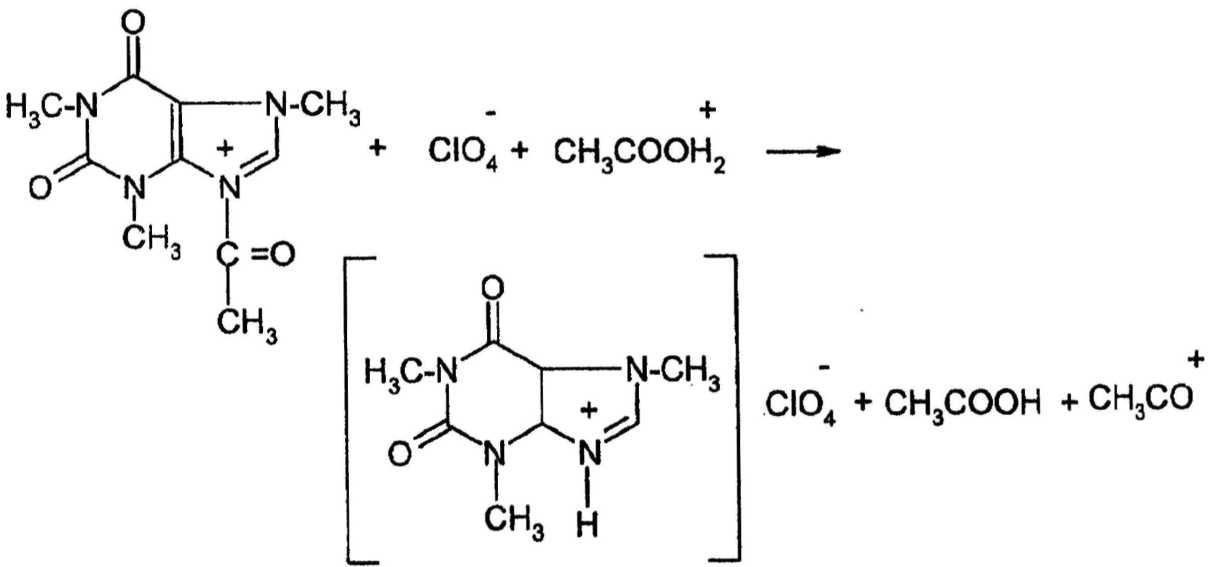
Определение изониазида
1. Протонирование изониазида
2. Ацетилирование изониазида по остатку гидразина
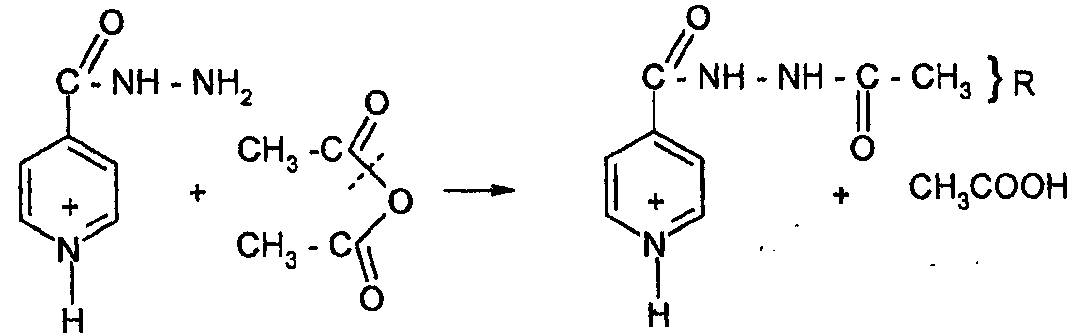
3. Перенос протона
HClO4+ CH3COOH→ClO4-+CH3COOH2+
4. Солеобразование
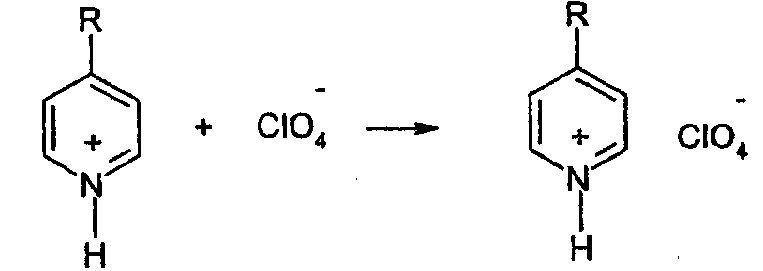
5. Регенерация растворителя
CH3COO-+CH3COOH2+→ 2CH3COOH
Э = М.м.
Определение солей.В неводных средах могут быть оттитрованы соли органических азотсодержащих оснований, образованные минеральными или органическими кислотами, а также соли неорганической, природы образованные сильными основаниями и слабыми кислотами.
При определении солей органических азотсодержащих оснований, образованных галогенводородными кислотами (HCl,HBr,HI), необходимо принять дополнительные меры для их связывания в малоионизируемые соединения. Это объесняется тем, что галогенводородные кислоты в достаточной степени ионизируют в неводной среде и вновь могут вступать в реакцию солеобразования с определяемым веществом. В таком случае результаты будут занижены.
Связывание галогенводородных кислот в малоионизируемые соединения может осуществляться добавлением ртути (II) ацетата или уксусного ангидрида.
На практике чаще всего ртути ацетат используют в том случае, если анализируемое вещество растворяют в безводной CH3COOH. Например, в случае солей хинина (гидрохлорида, дигидрохлорида):
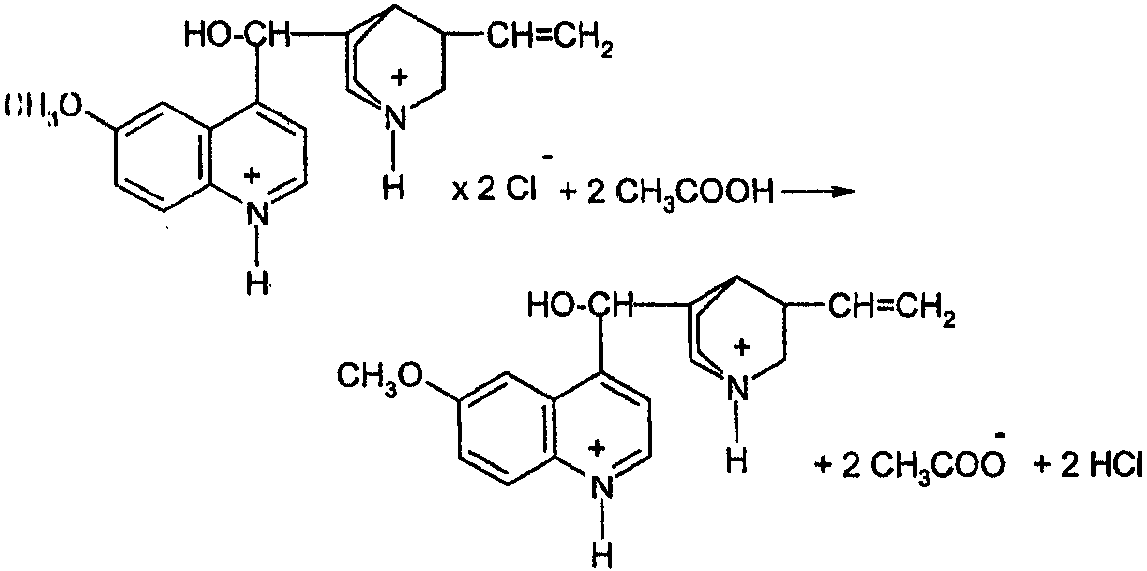
2HClO4 + 2CH3COOH → 2ClO4- + 2CH3COOH2+

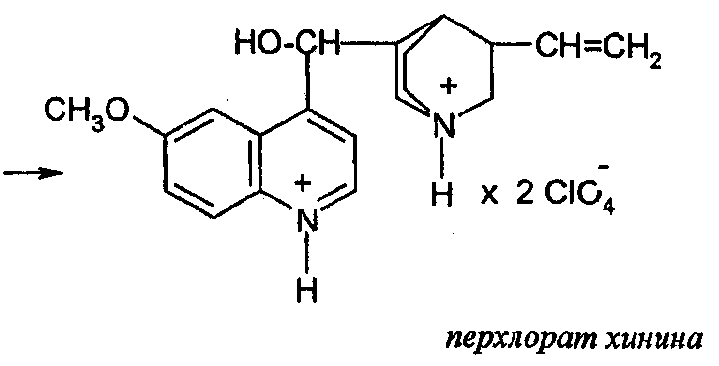
2 HCl + Hg(CH3COO)2 → HgCl2 + CH3COOH
2CH3COO- + 2CH3COOH2+ → 4 CH3COOH
Суммарно:
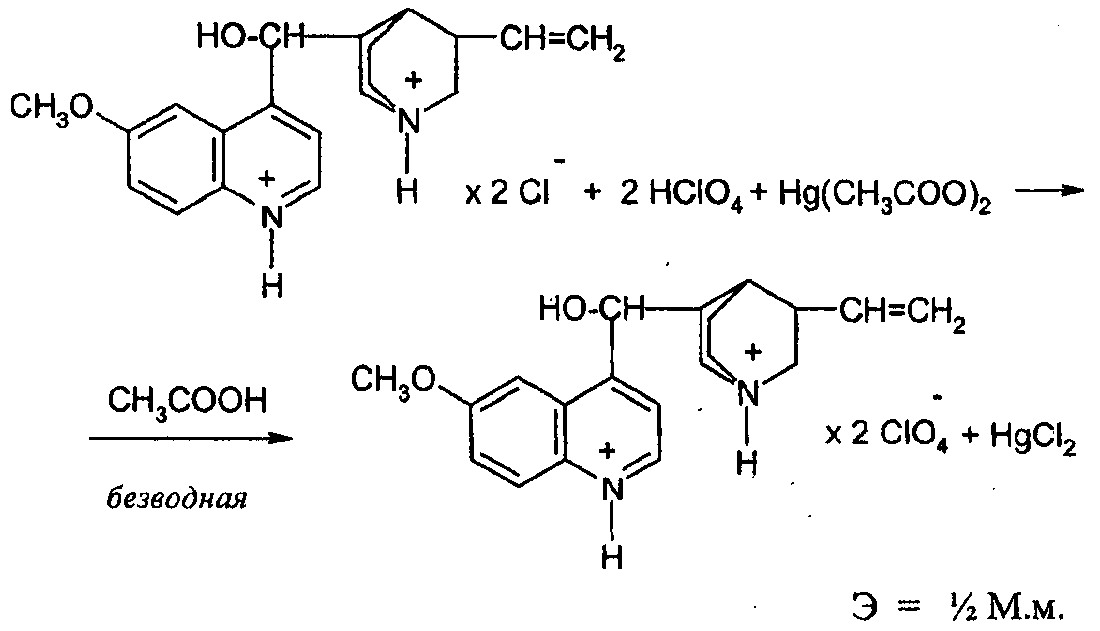
Если анализируемую соль растворяют в уксусном ангидриде, то добавление ртути ацетата не требуется, т.к. растворитель, реагируя с анионом галогенводородной кислоты, образует галогенангидрид. Например, это имеет место при титровании дибазола, эфедрина.
Определение дибазола
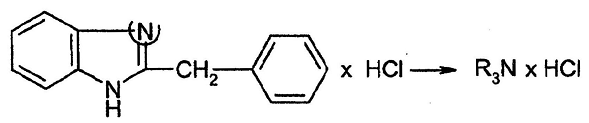
R3N
× HCl
![]() R3N+H
+ Cl-
R3N+H
+ Cl-
 (CH3CO)2O
CH3C+
= O + CH3COO-
(CH3CO)2O
CH3C+
= O + CH3COO-

HClO4 + CH3COOH → ClO4- + CH3COOH2+
Cl- + CH3C+ = O → CH3COCl
R3N+H + ClO4- → R3N+H × ClO4-
CH3COO- + CH3COOH2+ → 2CH3COOH

Суммарно:
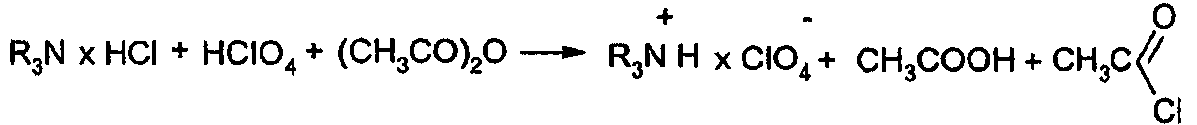
Молярная масса эквивалента при определении оснований или их солей зависит от количества в их молекуле атомов азота основного характера. Например, в случае дибазола, димедрола, папаверина гидрохлорида она равна М.м.; солей хинина, пахикарпина гидройодида - ½ М.м.
