
- •2 Кислотно-основные методы
- •2.1 Краткие теоретические основы метода
- •2.1.1 Кислотно-основное взаимодействие
- •Классификация кислот и оснований в зависимости от величины их рКа
- •Величины рКа оснований в различных растворителях
- •2.1.2 Титрованные растворы
- •Титранты кислотно-основного метода
- •2.1.3 Установление конца титрования с помощью визуальных индикаторов
- •Интервал перехода окраски и показателя титрования кислотно-основных индикаторов
- •Данные для эмпирического выбора индикатора при кислотно-основном титровании
- •Интервалы рН и изменение цвета индикаторов (гф XI, вып.2, стр. 102)
- •2.1.4 Определение ингредиентов многокомпонентных лекарственных форм
- •2.1.5 Варианты и способы кислотно-основного титрования
- •2.2 Ацидиметрия
- •2.2.1 Вариант нейтрализации
- •2.2.2 Вариант вытеснения
- •2.2.3 Вариант гидролитического разложения
- •2.3.2 Вариант вытеснения
- •2.3.3 Вариант гидролитического разложения
- •2.3.4 Косвенное титрование
- •Соле- и комплексообразование
- •Конденсация
- •2.4 Титрование в неводных растворителях
- •Примеры дифференцирующего действия растворителя
- •Пример нивелирующего действия растворителя
- •2.4.1 Титрование в среде протогенных растворителей. Ацидиметрия
- •Определение кофеина
- •Определение изониазида
- •Определение дибазола
- •Определение атропина сульфата
- •2.4.2 Титрование в среде протофильных растворителей. Алкалиметрия
- •Определение теобромина
- •Определение фталазола
Примеры дифференцирующего действия растворителя
-
Кислота
К ионизациивCH3COOHбезводной
Хлорная HClO4
1,6 × 10-4
 понижение
понижениедиссоциации и,
соответственно
силы кислоты
Хлористоводородная
6 × 10-7
Серная
1,4 × 10-7
Азотная
4,2 × 10-8
Из таблицы следует, что хлорная кислота в безводной CH3COOHпочти в 1000 раз сильнее чемH2SO4иHCl, и почти в 10 тыс. раз сильнее по сравнению сHNO3.
Это обстоятельство имеет большое практическое значение для кислотно-основного титрования в среде протогенного растворителя.
Уксусная кислота оказывает дифференцирующее действие и на основания, т.к. в ней основные свойства сильных оснований понижаются, а слабых – повышаются. А в муравьиной кислоте все основания становятся одинаково сильными (нивелирующее действие). Это свойство определяется величиной диэлектрической проницаемости растворителя (ДП). У уксусной кислоты ДП = 6,13; у муравьиной – 57, т.е. растворители с высокой диэлектрической проницаемостью оказывают нивелирующее действие, а с малым ее значением дифференцирующее (табл.10).
Таблица 10
Пример нивелирующего действия растворителя
-
Основание
Значение рКА
в воде
в муравьиной кислоте
Диэтиламин
10,90
5,19
Кодеин
8,00
5,11
Морфин
7,80
5,08
Кофеин
0,60
5,17
Указанные закономерности используют при кислотно-основном титровании лекарственных веществ, обладающих слабыми основными или слабыми кислотными свойствами.
2.4.1 Титрование в среде протогенных растворителей. Ацидиметрия
По этому методу определяют лекарственные соединения, обладающие основными свойствами. К ним относятся азотсодержащие органические соединения, их соли, а также некоторые неорганические вещества. Это лекарственные соединения производные фенилалкиламинов (адреналин, норадреналин), тропана (атропина сульфат, скополамина гидробромид), хинолина (соли хинина), хинуклидина (оксилидин, фенкарол), бензилизохинолина (папаверина гидрохлорид), фенантренизохинолина (морфина гидрохлорид), фенотиазина (аминазин). Азот основного характера может находиться в алифатической цепи (адреналин, норадреналин, димедрол, аминазин) или в составе гетероцикла (папаверина гидрохлорид, оксилидин, производные тропана, бензодиазепина и др.).
При ацидиметрическом титровании используют растворители кислотного типа, которые способствуют ионизации слабого основания. К ним относятся уксусная и муравьиная кислоты, уксусный ангидрид и их смеси с другими растворителями (протогенные растворители). Использование смеси растворителей позволяет улучшить условия титрования.
Титрантом является раствор хлорной кислоты (HClO4) в безводной уксусной кислоте.
Индикаторы – кристаллический фиолетовый, тропеолин 00, метиловый фиолетовый, нейтральный красный, но наиболее часто используется первый. Его также готовят путем растворения в безводной уксусной кислоте.
Возможна фиксация эквивалентной точки потенциометрически.
Определение оснований.Метод основан на солеобразовании определяемого слабого основания с титрантом в среде протогенного растворителя, усиливающего основные свойства анализируемого вещества.
В основе определения лежат следующие процессы (стадии):
I. Растворение определяемого вещества и его ионизация (протонирование)
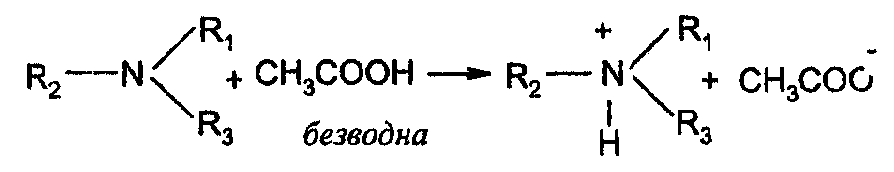
II. Перенос протона (в растворе титранта)
HClO4+CH3COOH→CH3COOH2++ClO4-
титрант растворитель ион ацелония перхлорат-ион
III. Солеобразование (кислотно-основное взаимодействие, нейтрализация)

IV. Регенерация растворителя
CH3COO-+CH3COOH2+→ 2CH3COOH
С уммарно:
уммарно:

По этой схеме определяют, например, резерпин, аминокислоты в смеси с уксусным ангидридом и другие лекарственные вещества, имеющие в своем составе основный атом азота (но не являющиеся солями).
Например, согласно ФС, проводят количественное определение некоторых аминокислот: аминалон, кислоты аминокапроновой (содержат алифатическую аминогруппу, обладающую основными свойствами)
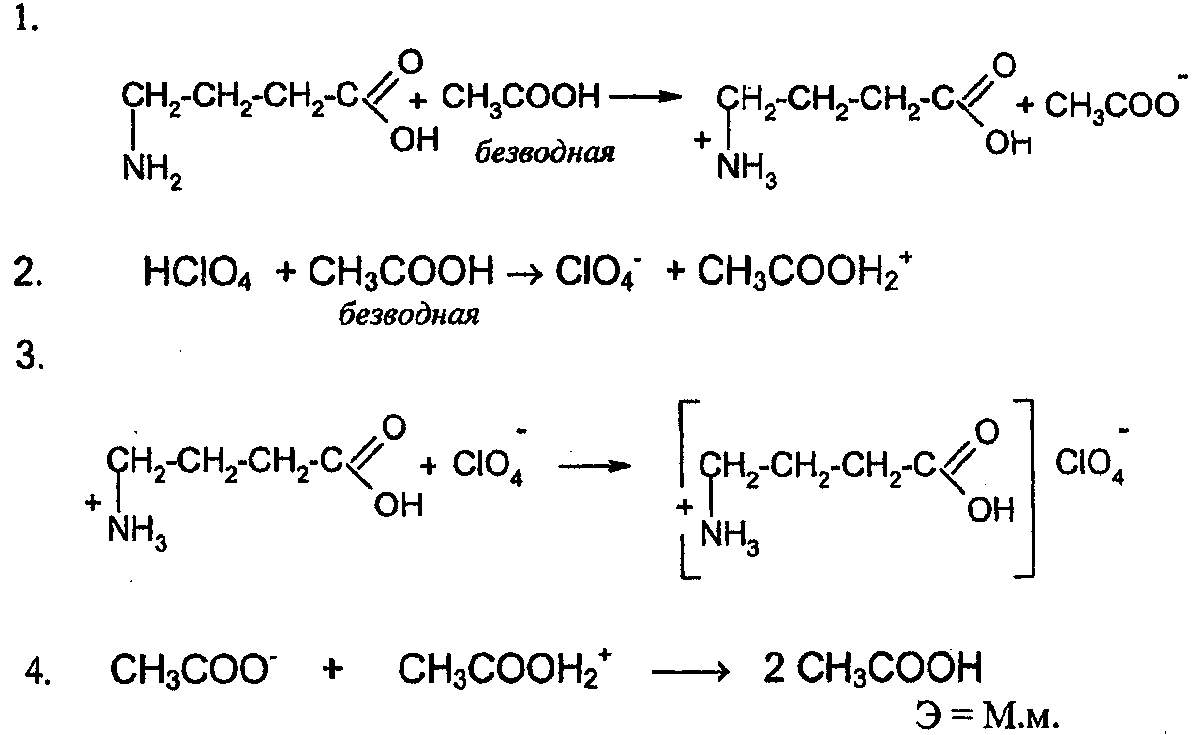
Условия титрования значительно улучшаются при добавлении уксусного ангидрида, увеличивающего кислотность и диэлектрическую проницаемость среды, а также апротонных растворителей: бензола, дихлорэтана, хлороформа.
