- •Ароматические кислоты и их соли производные салициловой кислоты
- •Химические свойства
- •Кислота бензойная Натрия бензоат
- •Получение
- •Описанне
- •Растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Салициловая кислота и ее производные
- •Кислота салициловая Натрия салицилат
- •Получение
- •Описанне
- •Растворимость
- •Подлинность
- •6. Реакции электрофильного замещения (на фенольный гидроксил).
- •Чистота
- •Количественное определение
- •1.Методы кuслотно-основного титрования.
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Примененне
- •Сложные эфиры салициловой кислоты
- •Получение
- •Описание
- •Растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Примененне
Кислота салициловая Натрия салицилат
|
Структура. Химическое название |
МНН, латинское название. Формы выпуска. Фармакологическое действие |
|
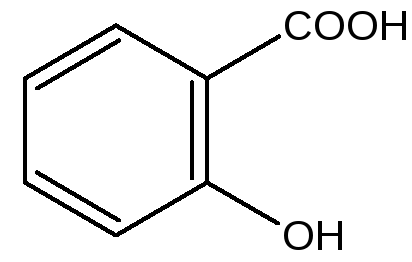
Кислота салициловая 2-оксибензойная кислота |
Acidum salicylicum Субстанция Антисептическое, кератолитическое средство |
|
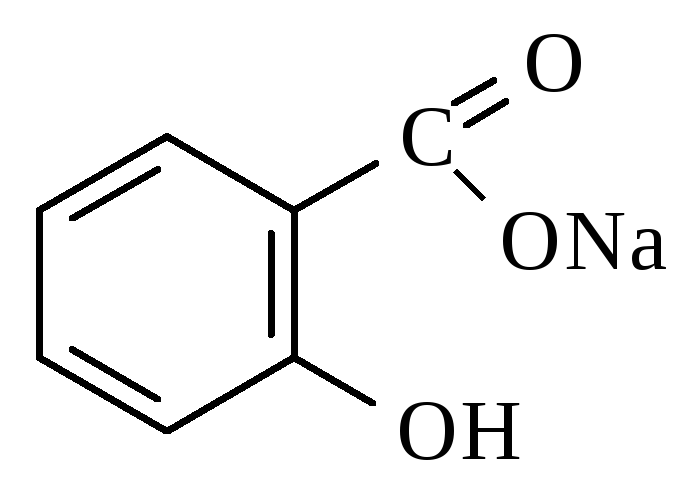
Натрия салицилат |
Natrii salicyas
Субстанция, таблетки 0,25; 0,5 1 0% раствор для инъекций. Противоревматическое,противовоспалительное, болеутоляющее, жаропонижающее средство |
Получение
Салициловую кислоту карбоксилированием фенолята натрия по реакции Кольбе-Шмидта:
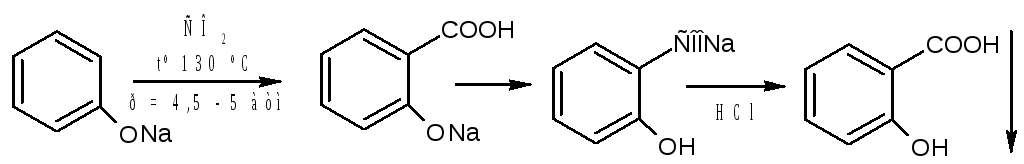
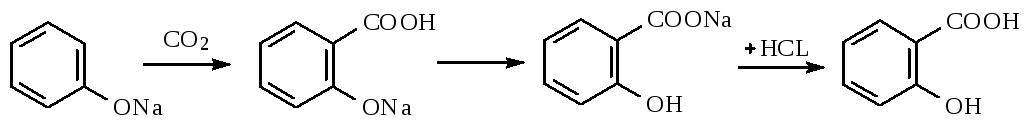
Механизм реакции Кольбе-Шмидта заключается в электрофильной атаке диоксидом углерода бензольного ядра. Фенольный гидроксил ориентирует заместитель в орто- и пара- положение. Но присутствие катиона натрия Na+ позволяет получать преимущественно орто- оксибензойную (салициловую) кислоту, с ионом К+получается смесь о- и п- оксибензойных кислот. Внутримолекулярная перегруппировка основана на том, что СООН – вытесняет фенолы из их солей, как более сильная кислота. Образовавшийся салицилат натрия подкисляют НCl и выделившуюся салициловую кислоту перекристаллизовывают.
Как побочный продукт может образовываться оксидифенил – примесь способа получения
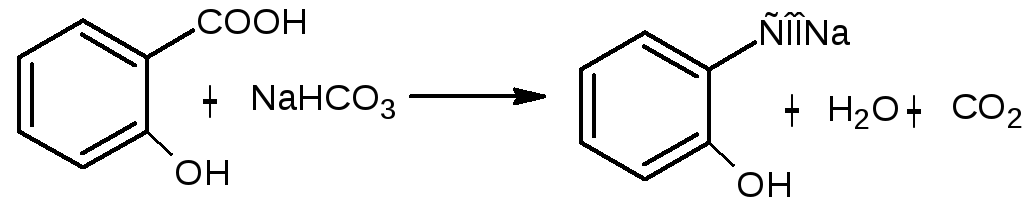
Натрия салицилат получают, нейтрализуя салициловую кислоту натрия гидрокарбонатом:
Описанне
Кислота салициловая – белые мелкие игольчатые кристаллы или легкий кристаллический порошок без запаха. При осторожном нагревании возгоняется, летуч с водяным паром.
Натрия салицилат – белый кристаллический или аморфный порошок без запаха.
Растворимость
Кислота мало растворима в воде, растворима в кипящей воде, легко растворяется в этаноле, эфире.
Натриевая соль очень легко растворима в воде, растворима в спирте, не растворима в эфире.
Подлинность
1. ИК-спектр поглощения натрия салицилата в области 4000-400 см-1 . (спреcсованный в таблетках с калия бромидом) должен полностью совпадать с прилагаемым к ФС рисункам спектра.
2. УФ-спектр раствора кислоты салициловой в растворе кислоты серной имеет два максимума поглощения при 235±2 и 300±2 нм.
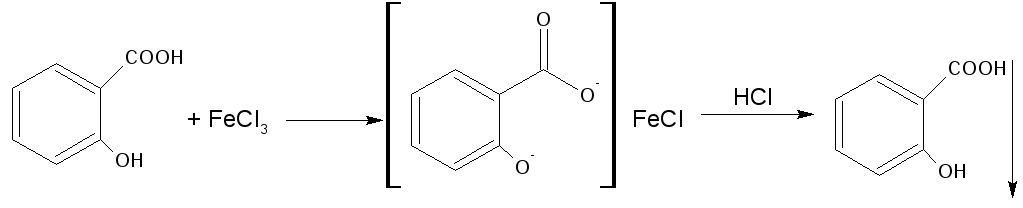
3.Реакция солеобразования с хлоридом железа (III) на салицилат-ион. (общая ФС реакция)
Эффект реакции - образование сине-фиолетового(салициловая кислота) или красно-фиолетового (салицилат натрия) окрашивания. Окрашивание исчезает при добавлении минеральной кислоты и выпадает осадок кислоты. При добавлении СН3СООН окраска сохраняется.
Реакция обусловлена кислотными свойствами карбоксильной группы и фенольного гидроксила. Состав и цвет комплекса зависят от соотношения реактива и препарата, и от рН среды:
А) при рН=2,0-3,0 образуется моносалицилат, окрашенный в сине-фиолетовый цвет. Этот комплекс разрушается при рН=1,0 и ниже (минеральная кислота) и выпадает осадок белого цвета.
ГФ кислоты салициловой
Сине -фиолетовое окраш. белый
или

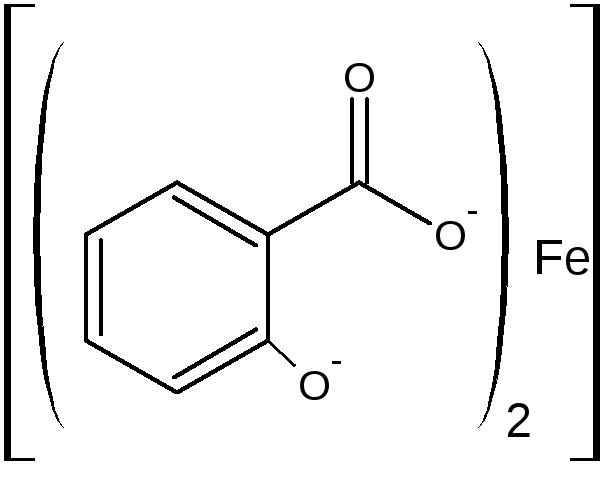
Б) при рН=3,0-8,0 образуется дисалицилат красно-фиолетового цвета. Реакция идет между натрия салицилатом и FeCl3, т.е. кислоту предварительно переводят в натриевую соль.
-
 или
или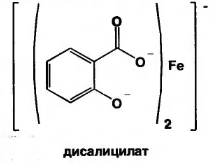
красно-фиолетовый
В) при рН=8,0-10,0 (одна капля раствора аммиака) образуется трисалицилат желтого цвета.
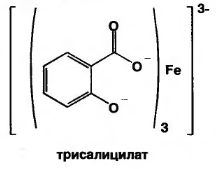 или
или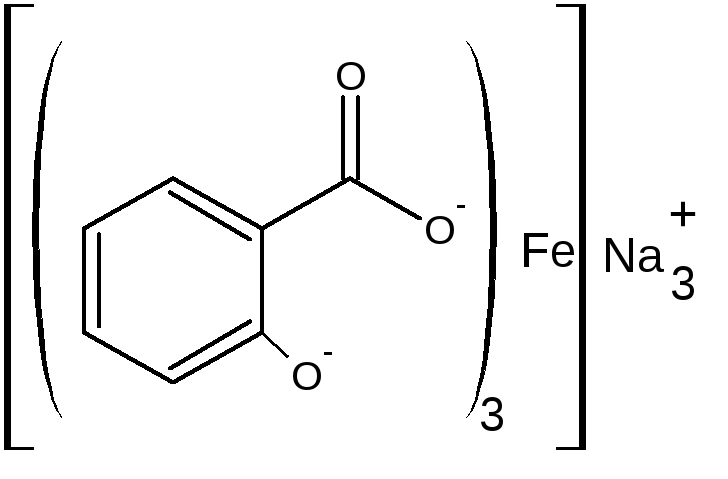
желтый
Значение реакции:
Фармакопейная реакция подлинности на препараты группы
Реакцией открывают примесь салициловой кислоты в препаратах, являющихся производными салициловой кислоты.
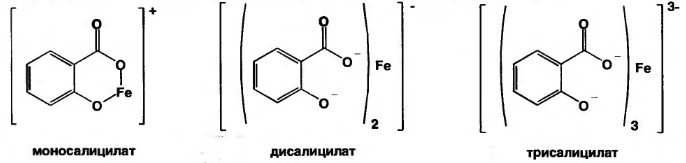
синий красный желтый
Не фармакопейные реакции солеобразования:
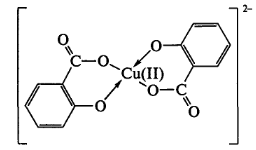
Салицилат – ион образует комплексную соль с CuSО4.Раствор окрашивается в зеленый цвет и при добавлении хлороформа окраска водного слоя сохраняется. У бензоат-иона слой хлороформа окрашивается в голубой цвет, водный – обесцвечивается (экстракция неполярного соединения). Салицилатный комплекс несет отрицательный заряд, поэтому в хлороформ не экстрагируется (реакция отличия)
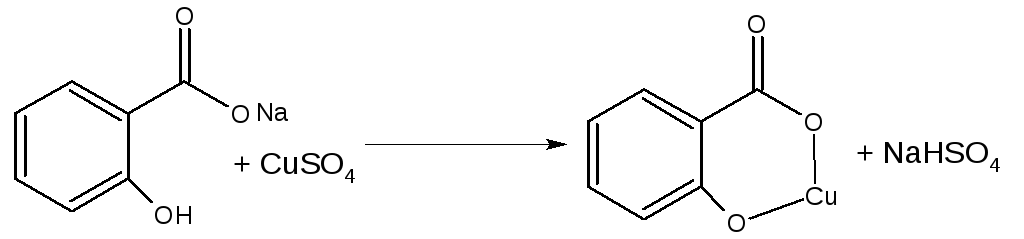
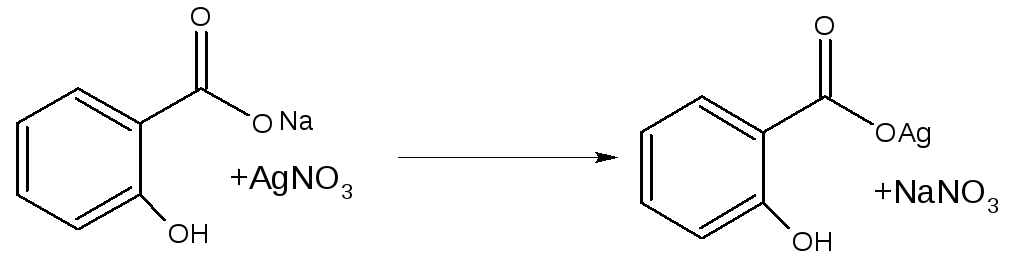
В нейтральной среде с АgNO3 образуется белый осадок серебряной соли.
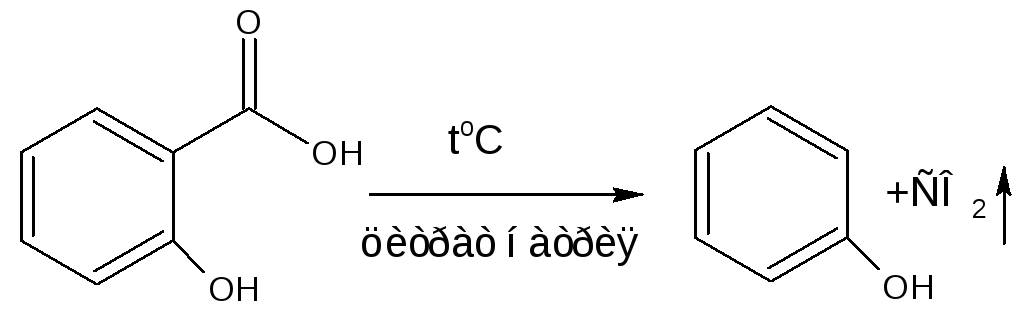
4. Реакции декарбоксилирования (на карбоксильную группу)
А) ФС кислоты салициловой. При нагревании с натрия цитратом появляется запах фенола.
Б) ФС кислоты салициловой. При нагревании с концентрированной серной кислотой идет декарбоксилирование и реакция этерификации с образованием фенилового эфира салициловой кислоты, выделяющийся оксид углерода (IV) определяется по помутнению известковой воды (кальция гидроксид).
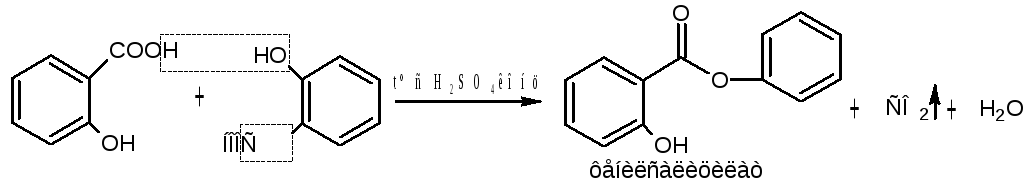
СО2 + Са (ОН)2 → СаСО3 ↓ + Н2О
5.ФС на натрия салицилат.
1) При действии разв. HNО3 на натриевую соль, выделяется салициловая кислота, у которой, определяют температуру плавления (156-161°С).
C6H5- COONa + HNО3 → C6H5- СООН ↓+ NaCl
Т°пл (156-161°С)
2) Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет (катион натрия).
Неофицинальные реакции