
Fizika_i_khimia_beta-prevrascheny
.pdfкоторый обеспечивает электронейтральность системы в целом, не может рассматриваться в качестве противоиона, поскольку удаляется на расстояние, при котором его кулоновское взаимодействие с карбениевым ионом пренебрежимо мало.) В-третьих, строение таких ионов определяется структурой исходных молекул и положением в них атомов трития, в результате чего возникающие ионы имеют строго определенный состав, строение и первоначальную локализацию заряда. Таким образом, ядерно-химический метод позволяет получать реакционно-способные частицы и изучать их реакции в средах любого состава в любом агрегатном состоянии вещества.
Однако указанными достоинствами значение ядерно-химическо- го метода генерирования молекулярных ионов не ограничивается. Одной из интересных проблем современной химии является вопрос о возможности существования, свойствах, реакционной способности и роли в различных химических процессах кремниевых, германиевых и других аналогов карбениевых ионов. Несмотря на то, что соединения углерода и кремния часто являются изоэлектронными аналогами, между ними существуют отличия, обусловленные неодинаковыми размером, электроотрицательностью и наличием у атомов кремния вакантных d-орбиталей. Поэтому ядерно-химиче- ский синтез кремнийсодержащих молекулярных ионов (по номенклатуре ИЮПАК они называются силилиевые ионы) не представлялся априори очевидным процессом. Однако к настоящему времени уже разработаны методы проведения ядерно-химического синтеза силилиевых ионов и получен ряд их алифатических и ароматических производных. Например, получение диэтилкатиона на основе кремния кратко можно записать следующим образом:
(C |
H |
) Si3H |
→- |
[(C |
H |
) |
Si3H]+ +He. |
2 |
5 |
2 |
2 β |
2 |
5 |
2 |
|
В настоящее время начаты исследования по германиевым аналогам карбениевых и силилиевых катионов. (Они получили название
гермилиевые катионы).
Уместно поставить вопрос: какова роль радиохимии в исследовании этого класса соединений? Из изложенного выше ясно, что источником органических катионов служат тритированные углеводороды. В частном случае это могут быть углеводороды, содержащие в своем составе один атом трития. Но тогда проследить за поведением катионов практически невозможно, поскольку концентрация их низка и тем более низка концентрация получающихся продуктов их
91
взаимодействия с вводимыми в систему реагентами (субстратами). Например, при активности источника карбениевых ионов 4 · 107 Бк за 10–30 суток возникают 1013 ионов, что соответствует образованию 10–10 молей продуктов их реакций. Единственным способом определения столь малых количеств веществ является радиохимический метод, который основан на использовании углеводородов, содержащих в своем составе по меньшей мере два атома трития. Распад одного из них приводит к образованию катиона, при этом другой атом, оставаясь в составе молекулы образовавшегося продукта, позволяет следить за поведением этого продукта в ходе аналитических процедур и проводить детектирование по радиоактивности. Важно отметить, что вероятность распада двух атомов трития в одной молекуле пренебрежимо мала, поскольку определяется квадратом величины постоянной скорости распада трития.
Вполне понятно, что введение атомов трития возможно не только в соединения элементов IV группы, но и во многие органические и неорганические производные элементов других групп таблицы Менделеева, содержащих атомы водорода, например в молекулы HCl, HBr и т. д. Молекулярные ионы, образующиеся при распаде трития в составе азотсодержащих соединений, носят название нитрениевых катионов. Например, распад трития в составе дважды тритированного по аминогруппе анилина приводит к образованию фе- нил-нитрениевого катиона:
C |
H |
N3H |
2 |
→ |
[C |
H |
N3H]+ +He. |
– |
|||||||
6 |
5 |
|
β |
6 |
5 |
|
Поскольку возможны различные заместители водородных атомов в аммиаке, то, используя ядерно-химический метод, можно изучить взаимодействие нитрениевых ионов с широким кругом органических и неорганических веществ.
В связи с бета-распадом трития необходимо кратко коснуться негативных радиоэкологических последствий присутствия трития в окружающей среде. Это связано с тем, что тритий может эффективно включаться в состав компонентов живой клетки и вызывать генетические изменения в молекулах ДНК. Один из путей попадания трития в ДНК связан с образованием так называемых оксениевых ионов при распаде трития в составе воды:
HO3H →− HO+ +He.
β
Далее оксениевые ионы взаимодействуют с нуклеофильными участками жизненно важных биологических структур (нуклеиновых
92
оснований), что может вызвать явления мутагенеза и канцерогенеза. Концентрация трития в окружающей среде растет, поскольку он образуется при эксплуатации ядерных энергетических установок, испытании термоядерного оружия, разработке основ термоядерной энергетики, а также широко используется в ряде специальных производств. Поэтому радиоэкологическая опасность, связанная с тритием, постепенно возрастает.
3.4.CОХРАНЕНИЕ ПЕРВИЧНЫХ МОЛЕКУЛЯРНЫХ ОБРАЗОВАНИЙ И ЯДЕРНО-ХИМИЧЕСКИЙ СИНТЕЗ
Из материала предыдущего раздела становится ясно, что образование гелия из атома трития вызывает разрушение первичных молекулярных ионов и появление промежуточных реакционно-способ- ных частиц, позволяющих осуществить синтез различных классов химических соединений. Однако универсальность ядерно-химиче- ского метода синтеза заключается в том, что и в случае сохранения какой-то доли первичных образований (ионов или нейтральных молекул) бета-распад позволяет выполнить синтез многих (а часто — весьма экзотических) химических соединений. Рассмотрим некоторые примеры использования данного варианта ядерно-химического синтеза для тех случаев, когда энергии электронного или вибраци- онно-ротационного возбуждения недостаточно для разрушения первичных молекулярных образований, возникающих при бета-распаде материнских атомов.
3.4.1.Получение элементов в необычных состояниях окисления
Материал этого подраздела удобно иллюстрировать соответствующими проблемами химии галогенов, а конкретно — проблемой семивалентного брома. Электронная конфигурация валентных электронов атомов галогенов имеет вид: s2p5. Это значит, что максимальная электроположительная валентность галогена должна быть +7. Действительно, соединения семивалентного хлора или йода хорошо известны: перхлораты и периодаты. Однако влияние d-сжатия в четвертом периоде Периодической Системы не позволяло традиционным способом получить аналогичные соединения брома. Безуспешные попытки добиться этого продолжались почти полтора столетия. Удалось осуществить это только в 1968 г. в Аргонской национальной лаборатории (США) методом ядерно-химического синтеза. Ос-
93
новой его явилось β-превращение нуклида 83Se (Т1/2 = 25 мин) в нуклид 83Br (Т1/2 = 2.3 час). Радиоактивный селен был введен в состав
соли селеновой кислоты. Из шестивалентного селена образовывался семивалентный бром в соответствии со следующей реакцией:
83SeO2–4 →β– 83BrO–4 .
Идентификация пербромат-иона осуществлялась соосаждением его с перхлоратом рубидия. При этом 14 % радиоактивности увлекалось в осадок, указывая на образование BrO–4 . Стабилизация атома брома в состоянии максимального окисления определяется тем обстоятельством, что примерно в 15 % случаев бета-распада сохраняется наследуемая от селена тетраэдрическая конфигурация кислородных атомов у атома брома, соответствующая sp3-гибридизации электронных орбиталей.
Аналогичным образом, в результате бета-распада, были получены в необычных химических формах (или валентных состояниях) технеций, осмий и ряд других элементов.
3.4.2. Получение соединений благородных газов
Долгое время благородные газы считались элементами не просто благородными, но и абсолютно инертными, то есть не способными образовывать устойчивые химические соединения. Такое убеждение господствовало до 60-х годов ХХ столетия, пока в Аргонской национальной лаборатории и в университете Британской Колумбии (США) не были успешно выполнены синтезы фторидов ксенона: XeF2, XeF4, XeF6. (Правда, начало получения соединений ксенона было положено синтезом гексафторплатината ксенона — XePtF6
в 1962 г.)
Надо отметить, что синтезы фторидов ксенона проводились прямым взаимодействием элементов — Xe и F — либо при нагревании смеси, либо в электрическом разряде или в поле ионизирующей радиации и т. п. Но получить кислородные соединения ксенона таким же путем, то есть прямым взаимодействием ксенона и кислорода, не удавалось. Поэтому исследователи обратились к возможностям ядерно-химического метода синтеза оксидов ксенона при бета-рас- паде материнского нуклида. Естественно, что образование соединений благородных газов в результате негатронного распада можно ожидать лишь при соответствующих превращениях ядер атомов галогенов. Если же иметь в виду получение соединений ксенона, то
94

для этого следует использовать соответствующие радиоактивные изотопы йода. Имеется несколько подходящих для этой цели цепочек превращений изотопов йода в радиоактивные изотопы ксенона, в частности:
131 I →β– 131m Xe →IT 131Xe;
133 I →β– 133 Xe →β– 133Cs.
Периоды полураспада нуклидов 131I и 131mXe соответственно составляют 8.1 суток и 12 суток. Соответствующие величины для 133I и 133Хе равны 20.5 часов и 5.3 суток. В качестве исходных соединений были опробованы различные кислородные соединения йода. Оксид ксенона вида ХеО3 был синтезирован при β–-распаде изотопов йода в составе иодатов и периодатов при накоплении ксенона, как в водных растворах, так и в кристаллах. Эти процессы можно отразить следующими уравнениями:
(IO3)– →β– XeO3;
(IO4)– →β– XeO4 → XeO3 + 12 O2 .
Образование триоксида ксенона во втором процессе идет через промежуточную стадию разложения тетраоксида ксенона, неустойчивого в водных растворах. Разумеется, не все 100 % образовавшегося ксенона оказывается в связанном состоянии, некоторая часть первичных молекулярных образований распадается в результате процессов возбуждения в электронных оболочках дочерних атомов. Если же β–-распад происходит в составе йодит иона, то в соответствии с реакцией
I– →β– Xe0.
образуется только элементарный ксенон.
Следует отметить тонкую зависимость выхода связанного ксенона из кристаллических периодатов от вида катиона. Действительно, выход ХеО3 при накоплении в кристаллах различных периодатов, содержащих 131I, составляет следующие величины: NaIO4 — 66 %, KIO4 и RbIO4 — 56 %, CsIO4 — 52 %. Наиболее высокий выход триоксида ксенона наблюдается в том случае, если в качестве противоиона в соединении семивалентного йода присутствует водород или литий. Описанную зависимость можно объяснить следующим образом.
95
Все орбитали атома ксенона заполнены электронами, поэтому химическая связь в триоксиде ксенона носит преимущественно электростатический характер. Образованию связанного ксенона благоприятствует отток электронной плотности с центрального атома. Чем меньше электронной плотности сосредоточено на атоме йода (и, следовательно, на атоме дочернего ксенона), тем более вероятно сохранение химической связи между ксеноном и кислородными лигандами. А это в свою очередь определяется тем, каков потенциал ионизации катиона. Поскольку потенциалы ионизации уменьшаются от водорода к цезию, выход ХеО3 в этой же последовательности падает.
Аналогичным путем, т. е. в результате β–-распада ядер атомов иода в форме соответствующих галогенидов, были синтезированы и выделены многие хлориды и фториды ксенона.
3.4.3. Синтез полонийорганических соединений
Химии полония — немногим более 100 лет. Тем не менее, элемент № 84 изучен достаточно полно, и значительная роль в этих исследованиях принадлежит ядерно-химическим методам синтеза и анализа соединений полония. Поскольку стабильных изотопов полоний не имеет, то чтобы исключить влияние радиолиза и радиаци- онно-химических эффектов, исследователи вынуждены работать с невесомыми количествами и предельно разбавленными растворами полония. Но в этих условиях наблюдаются потери нуклида из-за сорбционных процессов, контроль химического поведения полония затрудняют процессы коллоидообразования, возможно изменение редокс потенциалов элемента и т. д. Для стабилизации системы используют изоморфизм полония с теллуром: вводят полоний в соответствующие структуры соединений теллура и выполняют совместный синтез соединений обоих элементов. Но при этом возникают новые трудности: хроматографическое разделение (а другие методы в массовых экспериментах практически неприемлемы) однотипных соединений близких по свойствам элементов оказывается либо неразрешимой, либо очень трудоемкой задачей.
Удачным решением этой проблемы стал синтез соединений полония в результате β–-распада ядер висмута в составе соответствую-
щих органических производных. При этом используют изотоп висмута 210Bi:
210 Bi(T1/2 =5 сут) →β– 210Po(T1/2 =138 сут) →α 206Pb.
96
Конфигурация валентных электронов атома полония 6s26p4, что предполагает три устойчивых валентных состояния полония: Po(II), Po(IV) и Po(VI). Однако из-за лантаноидного f-сжатия в шестом периоде пара s-электронов полония весьма инертна, в следствии чего полоний в органических производных имеет максимальную валентность 4+. (Для получения соединений шестивалентного полония необходимо воздействие сильных окислителей.)
В общем виде процесс превращения висмуторганических соединений в полонийорганические можно представить следующими схемами:
R3Bi →β– [R3Po]+; [R3Po]+ + X− =R3PoX,
где Х — галоид, а R — органический радикал.
Теоретические оценки показывают, что первичный молекулярный ион [R3Po]+ сохраняется при β–-распаде примерно в 40 % случаев. Но интересно, что и в случае его разрушения в результате электронного или ротационно-вибрационного возбуждения полонийорганическое соединение сохраняется:
[R3Po]+ → [R2Po]+R+.
При этом процессе отщепляется органический радикал, а валентность полония понижается до двух.
Отщепление радикала R+ происходит также в случае β–-распада пятивалентного висмута. При этом с высоким выходом образуется органическое производное четырехвалентного полония:
R3BiX2 →β− R2PoX2 +R+.
То же соединение полония получается при β–-распаде висмута в составе его анионной формы:
[R2BiX2]− →β− R2PoX2.
Если в качестве R используются фенильные, толильные, ксилильные радикалы, то выход соединения R2PoX2 сильно зависит от природы иона галоида: F–, Cl–, Br–. Максимальный выход R2PoX2 (> 90 % ) наблюдается в случае фторпроизводных, минимальный — для производных брома.
97

Методом β–-распада было получено несколько десятков новых элементорганических соединений и в значительной мере были заложены основы химии полонийорганических соединений.
3.5. ХИМИЧЕСКИЕ ПОСЛЕДСТВИЯ ЗАХВАТА ЭЛЕКТРОНА
Химические последствия захвата электрона существенно отличаются от последствий β±-распада. Различия хорошо заметны при анализе зарядовых спектров (рис. 39, а, б). Смесь ионов, образовавшихся после захвата электрона, в значительной степени обогащена многозарядными ионами. Среди продуктов K-захвата присутствуют катионы с зарядами +6, +8 и т. д. Происхождение высокоокисленных ионов связано с протеканием Оже-процесса, который всегда сопровождает захват электрона.
Следует иметь в виду, что K-захват, аналогично β±-распаду, сопровождается эффектом стряхивания, но вероятность этого процес-
са очень мала. Например, вероятность стряхивания электронов после K-захвата в ядре 131Cs равна всего 2.5 · 10–3 %.
Итак, химические процессы, сопровождающие захват электрона, всецело обусловлены достаточно резким39 изменением окислитель- но-восстановительного состояния бета-излучателя.
Рассмотрим механизм химических превращений, обусловленных захватом электрона.
В случае, когда высокозарядный катион, образовавшийся в результате Оже-процесса, оказывается включенным в состав молекулы, он стремится частично компенсировать свой заряд путем смещения электронной плотности от других атомов, т. е. инициирует
внутримолекулярный перенос электронов. Следует отметить, что перераспределение электронной плотности внутри молекулы происходит намного быстрее, чем диссоциация молекулы. В итоге, в составе молекулы оказывается набор положительно заряженных ионов, расположенных на очень малом расстоянии — расстоянии исходных длин связей. Под действием сил Кулоновского отталкивания такая система буквально взрывается (рис. 41) и фрагменты разлетаются с энергиями, достигающими нескольких кэВ. (Для сравнения, два единичных заряда, например, электроны, находящиеся на расстоянии 0.1 нм, отталкиваются друг от друга с энергией 14 эВ).
39 Продолжительность развития каскада вакансий ~10–14 с.
98
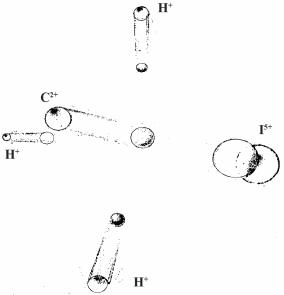
Рис. 41. Схематическое изображение «Кулоновского взрыва» ионов, образующихся в результате развития каскада вакансий на L-оболочке 125I, входящего в состав молекулы СН3I
Вероятность «кулоновского взрыва» зависит от нескольких факторов. Прежде всего, это агрегатное состояние вещества. Если вещество, содержащее в своем составе бета-излучатели, представляет собой газ при очень низком давлении, исключающем возможность столкновения молекул, то вероятность взрыва достаточно велика. Если же исходная молекула находится в конденсированных средах (жидкости или в твердом теле), то вероятность «взрыва» резко уменьшается, так как многозарядный катион будет «питаться» электронами от окружающих молекул и атомов.
Другим фактором, влияющим на судьбу молекулы с многозарядным ионом, является способность окружающей среды проводить электрический ток. Если окружающая среда является хорошим проводником, то многозарядный ион не сможет просуществовать достаточно долго ( 10–13 с), чтобы в нем успели произойти дальнейшие процессы перераспределения заряда. В среде изолятора или слабого проводника продолжительность существования конгломерата многозарядных центров возрастает (> 10–13 с), благодаря чему процессы перераспределения заряда продолжаются. Результатом перераспре-
99

деления является формирование двух основных центров кулоновского отталкивания: атома, испытавшего Оже-процесс, и остальной части молекулы. В случае развития событий по этому сценарию, процесс нейтрализации заряда молекулярного остатка путем захвата электронов от соседних молекул, может привести к возбуждению остатка до нескольких десятков или сотен эВ с последующим разрушением фрагмента.
Проиллюстрируем вышесказанное экспериментальными фактами на примере системы
125 Xe →K -захват, 100%, T1/2 =18 час 125I.
Энергия отдачи 125I, равная 4.4 эВ, очень низка для разрыва химических связей, поэтому все химические эффекты обусловлены только Оже-процессом, протекающим в электронной оболочке 125I. Если ввести атом 125Xe в состав молекулы 125XeF4, то иод-125, образующийся в результате K-захвата, обнаруживается в окисленном состоянии в виде фторидов 125IF5 и 125IF7. Повышение степени окисления иода наблюдается при гидролизе молекулы 125XeF2: 95 % 125I превращается в анион 125 IO–4 и 5 % в анион 125 IO3– .
100
