
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине» Для УМКД «Нанотехнологии в экологии»
1.Введение. 1.1.Нанобиотехнология.
Нанобиотехнология - (синоним бионанотехнология) - раздел в нанотехнологиях,
занимающийся изучением и воздействием объектов нанометровых размеров на биологические объекты и их использованием для развития наномедицины, занимающаяся созданием нанолекарств, диагностических систем на основе наночастиц, разработкой медицинских нанороботов и созданием медицинских наноматериалов.
Наномедицина — слежение, исправление, конструирование и контроль над биологическими системами человека на молекулярном уровне, используя разработанные наноустройства и наноструктуры (определение предложено Робертом Фрейтасом).
Под нанобиотехнологиями следует понимать:
1.Прямое или опосредованное манипулирование, осуществляемое на атомномолекулярном уровне с целью изменения или управления свойствами биологических объектов вне зависимости от их размера и свойств;
2.Исследование или использование объектов, представляющих собой невалентно связанные атомные, атомно-молекулярные или молекулярные кластеры, включающие вещества биологической природы или воздействующие на биосистемы при условии способности резко изменять свои биологические, физические или химические свойства. Важным является масштаб критического размера (~1-100 нм) или состоящие из счетного числа (от десятков до тысяч) частиц.
Из числа аналитических материалов, создаваемых различными группами экспертов, наибольшего внимания заслуживают Программа развития нанотехнологий, составленная корпорацией RAND (Research And Development, США) и Программа Европейской комиссии (Nanoroadmap Medical and Health, 2006 г.), созданная в рамках подготовки и реализации Седьмой рамочной программы Европейского Союза по научно-исследовательскому и технологическому развитию. Документы анализируют состояние дел в сфере нанобиотехнологий на сегодняшний день и предлагают прогноз развития различных областей нанобиотехнологий на обозримую перспективу (20152020 г.). Американские эксперты выделяют следующий ряд приложений нанотехнологии в биомедицине, состоящий из одиннадцати тем:
•инженерия живых тканей и регенеративная медицина;
•биологические наноструктуры;
•инкапсуляция лекарств и адресная доставка лекарств;
•молекулярная визуализация;
•биофотоника;
•биосовместимые имплантанты;
•биоаналитические мембраны;
•молекулярные биосенсоры;
•биочипы и лаборатории на чипе (lab-on-a-chip);
•функциональные молекулы: переключатели, насосы, транспортные средства.
1
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
Эксперты Европейской комиссии составили перечень наиболее важных, по их мнению, разделов нанобиотехнологий:
•доставка лекарств;
•молекулярная визуализация;
•косметика;
•создание новых лекарственных средств;
•методы диагностики;
•хирургия, в т.ч. трансплантация тканей и органов;
•тканевая инженерия;
•пищевые технологии;
•геномика и протеомика;
•прочие технологии, в т.ч. молекулярные биосенсоры.
Эти списки достаточно близки и можно выделить несколько магистральных направлений развития нанобиотехнологий: адресная доставка лекарственных соединений; молекулярная визуализация; биочипы/лаборатории на чипе; молекулярные биосенсоры.
Адресная доставка лекарственных соединений. Для улучшения качества и эффективности лечения и диагностики широкого спектра аболеваний требуются избирательные и эффективные лекарства и диагностические агенты. Наночастицы, применяемые в качестве лекарств или их носителей, будут играть важную роль в лекарственной терапии благодаря своим уникальным биологическим, химическим и физическим свойствам, обусловленным их размерами. Сейчас для использования в медицине используются наночастицы: из неорганических (золото, силикаты и т.д) и полимерных (полисахариды, полилактиды, полиакрилаты) материалов; полимерные терапевтические средства (полимерные мицеллы и т.д); липосомы. По мнению экспертов, необходимо дальнейшее исследование новых классов наночастиц, так как известные сейчас наночастицы не могут обеспечить весь спектр нужных терапевтических функций. Наночастицы предполагается использовать при инкапсулировании в них лекарств и других частиц. Поверхность наночастиц может быть модицифицирована покрытиями, слоями или связками для создания определенных характеристик (таких как, биосовместимость, направляемость, способность распознавания формы и участие в биологическом взаимодействии). Преимуществами наночастиц являются: обеспечение лучшего взаимодействия с биологическими структурами; защита лекарств от разрушения при транспортировке к месту назначения; возможность активного или пассивного накапливания в органе – мишени; способность высвобождать переносимые лекарства контролируемо как по дозе, так и по времени; возможность использования в качестве контрастных агентов при диагностике.
Молекулярной визуализацией называется неповреждающее визуальное представление, характеризация и количественный анализ биологических процессов в живых организмах на клеточном и субклеточном уровнях. При молекулярной визуализации молекулярные зонды, имеющие нацеливаемый узел (специальные молекулы – рецепторы или лиганды), используются в качестве источников контраста визуального образа. Если молекулярный маркер чувствителен к некоторому заболеванию, контрастирующая среда накапливается в пораженных тканях.
Биофотоника использует световые пучки и другие формы энергии и может быть определена как наука о генерации и использовании света для визуализации,
2
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
детектирования и манипулирования биологическими материалами. Одним из примеров является фотодинамическая терапия (Photo Dynamic Therapy, PDT), в которой специальные препараты (фотосенсибилизаторы) и оптическое излучение определенного спектра используются для удаления патологически измененных клеток. Световое излучение, необходимое для активации большинства современных фотосенсибилизаторов, не может проникнуть в ткани достаточно глубоко для того, чтобы реализовать весь потенциал этой технологии, поэтому ведутся поиски сенсибилизаторов, которые активируются оптическим излучением в спектральном диапазоне окна прозрачности тканей организма. Молекулярная визуализация и биофотоника позволяют производить распределение и регистрацию молекулярных зондов как во времени, так и в пространстве, и, соответственно, обеспечить более содержательное неповреждающее исследование биологических процессов внутри живого организма.
Биочипы. Одно из направлений развития биочиповых технологий состоит в разработке процессов компактного воспроизводимого нанесения различных биологических материалов на участки подложки для последующего автоматизированного и высокопроизводительного анализа. До настоящего времени эта технология была эффективной для фундаментальных исследований биохимических процессов. Сейчас биочипы применяются для скрининга лекарственных препаратов. К другому направлению биочиповых технологий можно отнести устройства «лаборатории на чипе» (lab-on-a-chip), обладающие функциональными микро- и наноэлементами, встроенными процессорами способными проводить различные манипуляции, реакции с исследуемой пробой, разделение и детектирование объектов на единой платформе. По мнению экспертов в ближайшее десятилетие станут широко распространенными три основных приложения: автоматизированные портативные приборы «лаборатория на чипе», имплантируемые биосенсоры и недорогие полногеномные аналитические матрицы.
Молекулярные биосенсоры. Биосенсоры – высокоинтегрированные устройства,
включающие биологический чувствительный элемент (рецептор или систему распознавания), первичный преобразователь сигнала и его усилитель. Главная особенность биосенсора, отличающая его от других биоаналитических систем - интеграция биохимического распознающего элемента и преобразователя. Различают два основных типа сенсоров: аффинные и каталитические. Аффинные сенсоры основаны на явлении высокоизбирательного связывания биологических молекул, которое приводит к изменению физических свойств (коэффициента экстинкции, толщины слоя, поверхностного натяжения, показателя преломления) и может регистрироваться соответствующими методами. Каталитические биосенсоры основаны на молекулярном распознавании молекул биокатализаторами и их последующем преобразовании в продукты биохимической реакции, которые регистрируются ферментативным электродом. Биосенсоры должны иметь ряд особенностей, таких как высокая селективность, устойчивость к большому числу внешних воздействий, минимальная предварительная обработка зонда. При инвазивном использовании зонд должен иметь малые размеры, быть биосовместимым, стерилизуемым и не обладать токсичными или антигенными свойствами. Биосенсоры рассматриваются и как желательный метод контроля течения и эффективного лечения ряда хронических заболеваний. Облегчение ощущений пациента, улучшение функциональности и уменьшение стоимости приборов – критические требования к таким биосенсорам.
3
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
Фундаментальные исследования, которые ведут академические институты, позволили Комиссии РАН по нанотехнологиям сформировать следующие пять основных стратегических направлений развития нанобиотехнологии.
1.Нанодиагностика и нанодетекция. В рамках этого направления разрабатываются наноструктурные системы детекции биоорганических субстанций, бактерий, вирусов для использования в молекулярной биологии, медицине, экологии, криминалистике. Создаются нанобиосенсоры для генодиагностики, наркодиагностики, мониторинга лекарств, нанокомплексы, пригодные для внутривенного введения, состоящие из биосенсоров с наночастицами, которые регистрируются физическими приборами, расположенными вне тела (ядерно-магнитный резонанс, ультразвуковые и др.).
2.Нанолекарства. Создание лекарств для клеток-мишеней и клеточных наноструктур, включая генотерапию, новые противоопухолевые, кардиотропные и психотропные средства, новые антибиотики, иммуномодуляторы, аллерготропины и наноантитела для лечения иммунодефицитов, аллергии, опухолей и аутоиммунных заболеваний.
3.Нановакцины. Создание иммуногенов, мини-антител, наноантител.
4.Нанотрансгенез, или трансгенное наноконструирование. Трансгенез растений позволяет создавать новые эффективные гормоны и вакцины, трансгенез животных - новые породы, новые биологические материалы.
5.Нанобионика. Создание нанокомпонентов для новых кровезаменителей, наногубок и нанотрубок для депонирования в тканях биоактивных субстанций, безаллергенных биоматериалов, энерготрасформирующих наносистем и нанороботов, создание модельных живых клеток и искусственных вирусов.
1.2.Тенденции развития аналитических приборов и систем для биологических
имедицинских исследований.
Аналитическое приборостроение является одной из динамично развивающихся в мире отраслей. В значительной степени этот факт обусловлен тем, что большой объем продукции этой отрасли используется в химических, биологических и медицинских исследованиях.
Постоянной тенденцией в совершенствовании аналитических приборов является автоматизация. Анализ состоит из ряда стадий, включающих отбор и подготовку пробы; отделение определяемого компонента или маскирование мешающих определению; транспортировку пробы; специфическое взаимодействие с аналитом или физическое воздействие на анализируемый компонент; детектирование и измерение аналитического сигнала и обработку полученных результатов. Выполнение этих стадий сопряжено со значительными затратами людских ресурсов и времени, требует организации и взаимной увязки всех стадий анализа. Автоматизация позволяет уменьшить время анализа, улучшить его правильность и воспроизводимость за счет исключения из аналитического цикла операций, выполняемых человеком. Разработчики аппаратуры стремятся интегрировать все стадии в единую автоматизированную и компактную систему, которая может состоять из нескольких модулей. Такие системы получили название системы полного анализа (СПА, англоязычная аббревиатура TAS – Total Analysis System).
4
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
Появлению СПА предшествовало развитие гибридных методов анализа и приборов. Гибридные методы сочетают в себе методы разделения и определения. Под термином "гибридные методы" понимают сочетание двух (и более) аналитических методов для получения нового средства анализа, более эффективного и более быстродействующего. Кроме того, такое сочетание позволяет осуществлять анализ компонентов пробы в режиме реального времени (on-line). Примерами таких методов могут быть: методы хроматографии и капиллярного электрофореза; объединение в одном устройстве операций пробоподготовки и определения (проточно-инжекционный анализ и близкие к нему методы); соединение в одном приборе различающихся методов определения (сложные многофункциональные приборы-комбайны с различными спектральными каналами регистрации).
Наиболее сложным при создании СПА является интегрирование в систему устройств для отбора и подготовки пробы. На сегодняшний день существуют два подхода к решению этой проблемы. Первый из них базируется на использовании гибких роботизированных систем, которые механически копируют действия операторааналитика. Основным недостатком роботизированных систем пробоподготовки является усложнение конструкции приборов, приводящее к увеличению стоимости аппаратуры. Другой подход основан на методах с использованием проточных систем, в частности: проточно-инжекционного анализа и его аналогах, хроматографии и электрокинетических методах. Следует выделить работы по сочетанию проточных систем с времяпролетной масс-спектрометрией и спектрометрией ионной подвижности.
Развитием СПА явилась их миниатюризация. В 1989 г Андреасом Манцем и сотр. была предложена концепция создания новых приборов - "микроаналитических систем" (МАС, англоязычная аббревиатура μ-TAS – micro-Total Analysis System). Суть концепции сводилась к интеграции всех стадий аналитического цикла на микрочипе с разветвленной системой каналов, в которых должна осуществляться предварительная подготовка пробы, разделение и последующее детектирование.
Первые разработки подобных приборов с применением микротехнологий появились в 1990-х годов. Ранее, в семидесятые годы, были предприняты первые попытки соединить планарные технологии микроэлектроники с методами аналитической химии (миниатюрный газовый хроматограф Стефана Терри представлял собой устройство, сформированное на поверхности кремниевой пластины диаметром 5 см и состоящее из инжекционного клапана, капиллярной колонки длиной 1.5 м и сечением (200х30) мкм2). Создание аналитических миниприборов во многом обусловлено и необходимостью получения результатов анализа на месте отбора проб в реальном масштабе времени для последующего их использования при принятии оперативных решений. Кроме того, такие приборы имеют преимущества в обычных лабораториях за счет меньшего веса, габаритов, расхода электроэнергии и реактивов по сравнению с их традиционными аналогами.
Массовое внедрение микро- и нанотехнологий в аналитическое приборостроение осуществляется благодаря масштабным государственным и частным капиталовложениям (в основном фармакологических и медицинских концернов, военных ведомств и т.д.). Поскольку составляющей частью аналитических приборов являются электронные компоненты, элементы механики, оптики, программноматематическое обеспечение и т.п., то миниатюризация аналитических приборов является отражением общей тенденции развития электронных и информационных технологий.
Наряду с уменьшением размеров аналитических приборов и устройств, следует отметить появление новых методов, работающих в масштабе малой размерности. К
5
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
ним относятся: микрожидкостная экстракция (МЖЭ), твердофазная микроэкстракция (ТФМЭ), микро вариант высокоэффективной жидкостной хроматографии (микро-ВЭЖХ), мембранные методы и некоторые другие.
По мере развития аналитических приборов усложняются алгоритмы обработки результатов измерений, предъявляются повышенные требования к программноматематическому обеспечению, возникают необходимость оперативного принятия решений. В некоторых приборах оценка результатов анализа осуществляется на основании экспертных оценок, производится классификация результатов и т.д. Все это выявляет новую тенденцию развития приборостроения – интеллектуализацию.
До появления концепций СПА и МАС миниатюризация ряда аналитических приборов шла по пути создания сенсорных систем. Широкое распространение такой подход получил в области электрохимических методов анализа, где были созданы первые химические сенсоры. Химический сенсор – портативное устройство, позволяющее с высокой селективностью определять один из компонентов сложной смеси. В идеале, сенсор не требует предварительной подготовки пробы, а его отклик на концентрацию аналита не зависит от остальных макро- и микрокомпонентов. Химический сенсор состоит из чувствительного элемента – рецептора и преобразователя отклика рецептора в электрический сигнал (трансдьюсера). Принцип работы устройства предполагает его размещение непосредственно в анализируемой пробе. Поскольку концепция применения сенсорных систем не предусматривает стадию пробоподготовки в ходе проведения анализа, создание высокоселективного чувствительного элемента сенсора применительно к широкому кругу анализируемых объектов представляет собой сложную и не всегда решаемую задачу.
В настоящее время появились англоязычные термины, отражающие процесс распространения миниатюризации оборудования и приборов в другие области науки. Можно говорить о формировании новой концепции осуществления на подложке площадью в несколько квадратных сантиметров полного цикла операций, связанных с реализацией, например, многостадийного химического и биологического анализов или органического/неорганического синтеза. Устройства, позволяющие осуществить подобные операции, получили названия микрофлюидные системы (МФС,
англоязычная аббревиатура MFS – Micro Fluidic Systems) и лаборатория на чипе (LOC - Lab-on-a-Chip). Разработка интегрированных микрочиповых платформ с микроэкстракторами, микрореакторами, микронасосами, микросмесителями, микроклапанами, микротеплообменниками, микродатчиками, а в настоящее время и с наноразмерными функциональными элементами, открывает перспективы для таких областей как комбинаторная и синтетическая химия, геномика и протеомика, высокопроизводительный скрининг (High Throughput Screening Systems), используемый при создании новых лекарственных препаратов и многих других.
1.3. Микро- и нанотехнологии при получении информации о биологических объектах на качественно новом уровне. Биологические материалы и биологические пробы. Особенности изучения биологических объектов. Специфика приготовления и хранения проб.
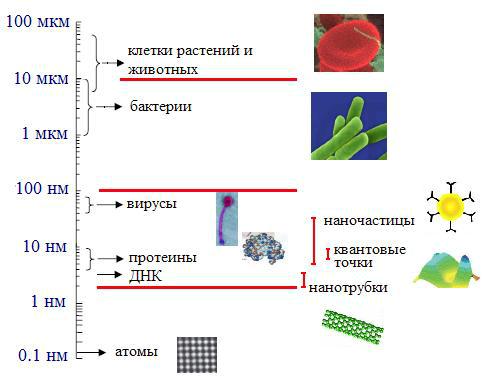
Многие биологические материалы классифицируются как микро- и наночастицы. Бактерии, интервал размеров которых находится между 1 и 10 мкм, эритроциты человека (~8 мкм) - принадлежат миру мезоскопических масштабов, в то время как вирусы с размерами от 10 до 200 нм, белки с размерами 4-50 нм - находятся в диапазоне наночастиц (рис. 1.3.1). Строительные блоки белков — 20 аминокислот,
6
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
имеют размеры около одного нм каждая, что находится вблизи нижней границы наноструктур. В природе встречается более 100 аминокислот, только 20 из них используются организмами при синтезе белков. При формировании молекулы белка эти двадцать аминокислот последовательно соединяются друг с другом прочными пептидными химическими связями и образуют длинные полипептидные цепи, содержащие сотни, а в некоторых случаях — тысячи аминокислот. В результате изгибов и сворачивания полипептидные наноцепи упаковываются в сравнительно небольшой объем, соответствующий полипептидной наночастице с типичным диаметром в диапазоне 4 - 5 0 нм. Таким образом, белок — это наночастица, которая представляет собой упакованную определенным образом полипептидную наноцепь. Генетический материал - дезоксирибонуклеиновая кислота (ДНК) имеет структуру упакованной наноцепи. Ее строительные блоки — 4 нуклеотида, которые связываются в длинные двойные спиральные наноцепи. В случае ДНК человека последовательность содержит около 140 B10б нуклеотидов. Молекула ДНК — двойная наноцепь, где две нуклеотидные наноцепи закручены друг вокруг друга с периодом 3,4 нм и диаметром 2 нм. Упаковываясь в хромосому около 6 мкм длиной и 1,4 мкм шириной ДНК вынуждена многокатно скручиваться и складываться. Сама по себе хромосома не настолько мала, чтобы считаться наночастицей, поскольку ее размеры лежат в мезоскопическом диапазоне.
Такой биологический объект как человеческое сухожилие, имеет достаточно сложное строение. Назначение сухожилия — прикрепление мускула к кости. С точки зрения биологии, основная строительная единица сухожилия — совокупность аминокислот (0,6 нм), образующих желатиноподобный белок, называемый коллагеном (1 нм), который свивается в тройную спираль (2 нм). Затем следует тройная последовательность волокнистых или фибриллярных наноструктур: микрофибриллы (3,5 нм), субфибриллы (10—20 нм), и собственно фибриллы (50—500 нм). Следующими структурными уровнями являются группа волокон, называемых связкой (50-300 мкм) и сантиметровые сухожилия. Размер связки считается мезоскопическим, а сухожилия — макроскопическим.
Молекулярно-биологические объекты могут избирательно взаимодействовать друг с другом: например, белки обладают способностью связываться с другими определенными белками и органическими молекулами. В-основном механизм избирательного взаимодействия биомолекул расшифрован, что позволяет создавать новые материалы, вводя в структуру материалов вещества и нанообъекты, например, металлические наночастицы.
7
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
Рисунок 1.3.1. Сравнительная шкала размеров некоторых биологических объектов и искусственных наноструктур.
К настоящему времени ученым удалось понять строение ряда молекулярных машин, среди которых рибосома — трехмерное образование, включающее комплекс белков и рибонуклеиновых кислот, производящая белковые «изделия» по программам, записанным в генах человека. Бионанотехнологии применяются для создания подобных молекулярных машин, различных устройств и сенсоров.
Одной из важнейших задач бионанотехнологии, имеющей огромное прикладное значении, является создание средств доставки терапевтических препаратов в определенные виды клеток. Особое внимание уделяется развитию средств диагностики
– здесь, безусловно, следует отметить современные биочиповые технологии, без которых уже немыслимы генетические исследования.
Современное развитие нанотехнологий позволяет получать функциональные элементы и системы, размеры которых лежат в нанометровой области длин. Это дает принципиальную возможность осуществлять воздействие на отдельные молекулы и частицы и позволяет определять характеристики индивидуальных молекул. Так создание устройств на основе нанопористых структур и полупроводниковых материалов, способных контролировать положение молекулы ДНК в нанопоре с точностью до одного нуклеотида, является революционным событием в современной технологии секвенирования, приводящим к значительному сокращению объема исходного вещества – ДНК, времени и стоимости каждого анализа. Другим ярким примером является применение бионаносенсоров на основе нанотранзисторов с нанотрубками, реагирующих на присутствие отдельных молекул в исследуемой среде, что может быть успешно использовано для изучения различных биологических процессов, протекающих в живой клетке, взаимодействий антитело-антиген и т.д.
8
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
Технологии получения нанонитей из проводящих материалов и их использование для конструирования сенсорных элементов позволяют создавать устройства, регистрирующие не только электрические характеристики молекулы, но и ее оптические свойства. Подобные примеры иллюстрируют новые возможности микро- и нанотехнологий, а именно – возможность изучения отдельных молекул вместо ансамблей частиц.
Изучению веществ, вовлеченных в биологические процессы, — биологических материалов уделяется особое внимание. Вещества, содержащиеся в них, либо непосредственно связаны с функционированием организмов (являются продуктами их жизнедеятельности), либо являются внешними по отношению к организму, но способствующими поддержанию в нем физиологических процессов. Таковыми могут быть:
•часть исследуемого объекта, например организма, при изучении свойств веществ из его внутренней среды (ВС);
•часть среды обитания организма, например пробы воздуха или воды из окружающей среды (ОС), в которой находится организм в процессе жизнедеятельности;
•продукты питания, потребляемые организмом с целью пополнения запасов энергии и веществ, необходимых для осуществления его жизненно важных функций;
•активные минеральные и растительные вещества, например лекарства и пищевые добавки, оказывающие значимое влияние на процессы жизнедеятельности в организме, усиливая или угнетая последние.
Также в качестве объектов лабораторного исследования могут быть выбраны материалы биотехнологических производств (искусственный белок, дрожжевая масса и т. п.), фармацевтических производств (лекарственные препараты, пищевые добавки) и т.д. Вследствие огромного разнообразия конкретных задач лабораторного анализа аналитические лаборатории медико-биологического направления различаются по характеру исследуемых объектов, видам проводимых исследований, реализуемым методикам, показателям выполнения анализов, техническим приемам и средствам, производительности работ, по организационной структуре и внешним связям.
Понятие биологической пробы для микробиологов и аналитиков имеет разное значение. Если для микробиологов биологическая проба (синоним – биопроба) это метод диагностики инфекционных болезней, основанный на заражении лабораторных животных исследуемым материалом с целью обнаружения и идентификации возбудителей или их токсинов или метод контроля биологических препаратов (вакцин, сывороток), основанный на их введении лабораторным животным с целью оценки токсичности, пирогенности и иммунологической активности, то для аналитиков биологическая проба (БП) исследуемой среды – это некоторое количество биологического материала, взятого из любой исследуемой среды (ИС), будь то внутренняя среда организма человека или некий внешний источник вещества из окружающей среды. В общем случае этот биологический материал можно определить как биосубстрат, понимая, что ИС может содержать биосубстраты разного вида.
Несмотря на исключительное разнообразие физических и химических свойств жидких сред, а соответственно, и требований, предъявляемых к аналитической аппаратуре, жидкостный объект наиболее удобен при лабораторных исследованиях, хотя иногда жидкофазная биопроба преобразуется в твердую или газообразную форму (например, газовая хроматография, спектральный анализ, некоторые варианты микроскопии и т.
9
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
п.). Чрезвычайно важным при аналитическом исследовании является представительность пробы – т.е. она должна достаточно точно и полно отражать физико-химический состав исследуемого объекта.
Требования, которые предъявляются к методам аналитических исследований биологических проб, главным образом определяются биологической природой и свойствами объекта исследования. Основными особенностями биологических проб являются:
—низкий энергетический уровень внутренних взаимодействий, определяющих устойчивость структурных комплексов на субклеточном, молекулярном и субмолекулярном уровнях, нестабильность и травмируемость биологических материалов при внешних воздействиях;
—гетерогенность и многокомпонентность биологических проб;
—сохранение биологической специфичности в узком диапазоне значений температур, рН, ионной силы и других показателей;
—низкие концентрации активных компонентов при больших количествах примесей;
—минимальные изменения физико-химических свойств биопробы, приводящие к существенному влиянию на процессы жизнедеятельности организма;
—ограниченный исходный объем проб.
Эти особенности определяют основные требования при проведении исследований биоматериалов, а именно: применение неразрушающих методов обработки БП; поиск и выбор параметров, наиболее адекватно и полно характеризующих БП; учет факторов искажающих результаты анализа.
Общими требованиями при проведении аналитических исследований биологического материала являются:
•соблюдение оптимальных сроков для взятия биологического материала на исследование: материал должен быть взят в нужном месте и в нужное время;
•биологический материал для исследования должен быть взят в необходимом и достаточном объеме с обеспечением условий, исключающих его контаминацию;
•отобранный биологический материал должен быть промаркирован и сопровожден детальным описанием;
•контейнеры для транспортировки и хранения материала должны обеспечивать герметичность, стерильность, целостность, сохранность образцов;
•материал контейнеров не должен вступать в реакции с компонентами пробы, обладать низкой адсорбционной способностью и т.д.
Допустимый промежуток времени между отбором биопробы и ее анализом зависит от состава биосубстрата, природы определяемых компонентов и условий хранения. Если невозможно сразу после отбора провести анализ, то биопробу консервируют и помещают на хранение. В процессе отбора и хранения биопроб возможно изменение их состава из-за загрязнения компонентами, поступающими из материала пробоотборников, различных приспособлений, емкостей для хранения, воздуха лабораторных помещений и т. д. Ввиду этого биопробы хранят в посуде из особых сортов стекла или полиэтилена, а материал посуды определяется типом анализируемого компонента. Некоторые компоненты биологических материалов устойчивы в течение длительного времени и не требуют особых условий консервации: в этом случае используются быстрое охлаждение, изменение рН среды, в которой будет находиться биопроба, добавление стабилизирующих веществ. Иногда для сохранения
10
