
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
транспортные протеины, такие как гемоглобин, переносят кислород из легких к другим частям тела; структурные протеины, такие как колаген и эластин, обеспечивают фиброзную основу соединительных тканей в животных; гормональные протеины, такие как инсулин, помогают регулировать концентрацию сахара в крови; рецепторные протеины встраиваются в мембраны нервных клеток и детектируют химические сигналы, передаваемые другими нервными клетками и т.д. Протеины производятся рибонуклеиновой кислотой (РНК), которая определяется ДНК в генах. Каждый протеин - это цепочка аминокислот выстраиваемых бесчисленным количеством способов. Порядок или последовательность. аминокислот играет огромную роль а определении функции конкретного белка в организме. Другим определяющим фактором является структура протеина. Порядок, в котором выстраиваются аминокислоты, диктуется определенными фрагментами ДНК, называемыми нуклеотидами. Каждый нуклеотид содержит сахарную группу, фосфатную группу и одно из четырех соединений, называемых базовыми (аденин, тимин, цитозин и гуанин). Прядь спирали ДНК в действительности состоит из цепочки нуклеотидов. Три нуклеотида в ряд образуют кодон и порядок базовых веществ в кодоне диктует какая из 20 аминокислот будет производиться. Таким образом, цепочка ДНК производит многочисленные аминокислоты, которые, затем связываются друг с другом для формирования протеинов. Приоритетным направлением в биомедицине является создание наноустройств для клинической протеомики. Основной целью клинической протеомики является обнаружение, идентификация белков и их комплексов, анализ белок-белкового взаимодействия для создания новых систем диагностики заболеваний и их лечения. Основная проблема протеомики заключается в низком концентрационном пределе обнаружения и идентификации белков в биологическом материале существующими традиционными методами – на уровне не ниже 10-12 М. Так, например, концентрационная чувствительность протеомных методов, основанных на комбинации диэлектрофореза или хроматографии с масс-спектрометрией – 10-9 М, иммуноферментных методов анализа – порядка 10-12-10-14 М. Необходимость повышения концентрационной чувствительности на несколько порядков связана с тем, что подавляющее количество типов функциональных белков, которые могут быть и маркерами заболеваний, присутствуют в плазме крови, согласно оценкам, в концентрациях гораздо более низких, вплоть до нескольких молекул. Применение нанотехнологий позволяет существенно повысить концентрационную чувствительность, а также быстродействие аналитических систем измерения при снижении их стоимости.
6.4. Микро- и нанофлюидные чипы.
Топология (архитектура) и конструкция микро/нанофлюидных чипов определяется методом и стадиями анализа, которые требуется реализовать на чипе. При анализе компонентов жидкой пробы должны быть реализованы следующие операции: загрузка и дозирование пробы, манипуляции с пробой (очистка, обработка или преконцентрирование пробы), транспортировка пробы в реакционную зону, химические или иные реакции, разделение полученного продукта на компоненты, термическое или иное физическое воздействие на пробу (реагенты), детектирование компонентов, сбор полученных фракций. Движение потоков жидкости может осуществляться под действием центробежных сил (например в CD - чипе); электрических полей (электрокинетический способ); давления или разряжения; ультразвуковых полей; капиллярных сил и т.д
81
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
6.4.1.Функциональные элементы микро- и нанофлюидных чипов: интерфейсы ввода пробы, транспортные каналы, устройства дозирования, микрокамеры и микросмесители, клапаны, микронасосы, наноструктуры.
Вмикрофлюидном чипе (МФЧ) наиболее эффективными и широко распространенными способами управления микропотоками вещества являются
электрокинетический и гидравлический при этом наиболее технологичным и автоматизируемым считается электрокинетический. Варьируя величины управляющих потенциалов, можно обеспечить реализацию режимов: загрузки пробы, дозирования и смешивания ее с реагентами, а также сепарации полученного продукта.
При вводе пробы и буфера используются различные гидравлические интерфейсы, соединяющие чип с внешними системами, таковыми могут являться разнообразные капилляры (с внутренним диаметром от 5 до 500 мкм), микрорезервуары (сосуды) самого чипа, куда помещается проба и раствор буфера. Размеры транспортных каналов МФЧ должны определенным образом соотносится с размером гидравлических интерфейсов, так, чтобы не вызывать резких перепадов давления в каналах. В общем случае для микроканала сечением S количество введенной пробы Q (при вводе электрокинетическим способом) зависит от величины приложенного напряжения U, времени t, в течение которого было подано напряжение, и подвижности компонентов
пробы μ:
Q = μ S U t c, где c – концентрация пробы в растворе, L – длина канала.
L
Количество введенного вещества определяется суммарными электрофоретической и электроосмотической подвижностями μ. Существенное влияние на количество вводимой пробы оказывает электроосмотический поток. При определенных условиях возможна ситуация, когда ЭОП полностью определяет перенос ионов раствора пробы. При гидродинамическом способе ввода за счет разности давлений в канале круглого сечения или капилляре, объем вводимой пробы Vc:
V |
c |
= |
|
4 |
|
P π d t |
, где P - разность давлений, d - диаметр канала, t - время |
128 |
|
η L |
|||||
|
|
|
|
||||
инжекции, η - вязкость.
Электрокинетический ввод пробы имеет недостатки. Например, при таком вводе образца осуществляется частичная сепарация компонентов пробы. Кроме того, электрокинетический способ ввода пробы вследствие невысокой скорости движения потока занимает много времени. Поэтому, обязательным условием при реализации электрокинетического метода ввода пробы является минимальная длина подводящих каналов. В некоторых случаях оправданным является сочетание гидравлического способа ввода и дозирования пробы с электрофоретическим методом разделения. Дозирование пробы обычно включает процессы транспортировки и загрузки пробы на участке канала определенных размеров, что позволяет воспроизводить с высокой точностью дозируемый объем.
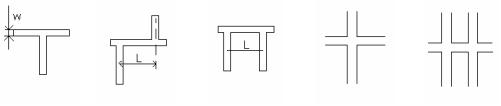
Топология дозаторов МФЧ при электрокинетическом (в некоторых случаях – при гидравлическом) управление микропотоками вещества не отличается разнообразием, наиболее часто используются варианты дозирования по схемам, приведенным в Таблице 6.4.1. При инжекции по схемам «Т» и «простой крест» удается достигнуть предельно малых объемов вводимой пробы – до нескольких пл, при инжекции по схемам «двойного Т», «П» и «двойного креста» объем пробы может составлять сотни и тысячи пл. Варианты дозирования по схемам «простой крест» и «двойной крест» поясняются рис. 6.4.1.
82
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
Несмотря на ряд имеющихся недостатков, электрокинетический ввод пробы широко используется как в приборах на основе микрофлюидных чипов. Возможно такая ситуация сложилась благодаря разработанной процедуре сжатия пробки пробы, позволяющей концентрировать пробу в десятки и сотни раз. Это дало возможность значительно снизить порог обнаружения ряда веществ.
|
|
|
|
Таблица 6.4.1 |
|
|
Топология инжекторов и схемы контроля потоков |
|
|||
|
|
|
|
|
|
Схемы |
|
|
|
|
|
контроля |
|
|
|
|
|
|
|
|
|
|
|
Тип |
Т |
Двойной Т |
П |
Крест |
Двойной |
инжектора |
|
|
|
|
крест |
Схема |
2 стадии |
2 стадии |
2 стадии |
2 стадии |
2 стадии |
инжекции |
|
|
3+ стадии |
3+ стадии |
|
Максимальная |
высокая |
высокая |
высокая |
средняя |
средняя |
концентрация |
|
|
|
|
|
С max |
|
|
|
|
|
Равномерность |
низкая |
высокая |
средняя |
Средняя- |
высокая |
«пробки» |
|
|
|
высокая |
|
Примечание |
Использует |
Часто |
Используется |
Очень часто |
Распространен |
|
ся редко |
используется |
редко |
используется |
|
|
|
|
|
|
|
Одно из следствий миниатюризации – малые объемы вводимого образца. Это может быть как существенным преимуществом, например, в случае клинического мониторинга, так и создавать определенные проблемы, например, приводить к недостаточной чувствительности детектирования. Минимальный объем образца, необходимый для того, чтобы можно было провести детектирование, определяется следующим выражением:
V |
sample |
= |
1 |
, где h – эффективность используемого сенсора (0 ≤ h ≤1); NA - число |
|
hNAc |
|||||
|
|
|
Авогадро; c - концентрация анализируемого вещества. Иными словами, необходимый объем образца определяется эффективностью сенсора и концентрацией детектируемого вещества.
Манц (Manz A.) и его группа проанализировали возможности использования очень малых объемов образца и пришли к выводу, что использование микроаналитической техники возможно при решении многих задач диагностики, так как ряд диагностически значимых соединений присутствуют в пробах в концентрациях от 108 до 1021 ед/мл и, исходя из формулы, могут детектироваться при объеме образца в пределах 10-12...10-6 л. Однако большинство диагностически значимых веществ присутствуют в пробе в более низких концентрациях (от нескольких единиц до 107 ед/мл) и их детектирование выходит за пределы области теоретически достижимой чувствительности. Эта проблема решается использованием концентраторов.
83

А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
Существует множество методов преконцентрирования (предварительного концентрирования) образца с применением стэкинга, которые, так или иначе, сводятся к изменению движения потока аналита (или скорости движения) вдоль канала перемещения. Стэкинг всегда происходит на границе, где есть изменение в скорости движения, вызванное различными факторами. Он может быть классифицирован по механизмам: электрокинетического фокусирования и абсорбции. В первом случае протекают электрофоретические процессы, которые управляются путем изменения приложенной напряженности электрического поля или вязкости между зонами, что оказывает воздействие на местную проводимость и концентрацию разноименно заряженных частиц, и, соответственно – на изменение скорости. Стэкинг образца может быть проведен при использовании его абсорбционных свойств – как правило, с применением хроматографических методов или использованием физико-химических реакций для изменения подвижности аналита. Концентрирование пробы также может осуществляться с использованием различных фильтрующих элементов (фильтров), внешних полей и других технических приемов.
Смешивание – один из основных процессов, требуемый для многих биологических применений. В микромасштабе, ламинарное движение потоков, характеризующееся низкими числами Рейнольдса (< 10), даже в случае соприкосновения их друг с другом, препятствует смешиванию.
Рисунок 6.4.1. Дозирование по схеме а) «простой крест» и б) «двойной крест» (Z- образная схема дозирования).
Однако при длительном распространении потока осуществляется диффузия и наблюдается медленное перемешивание слоев. В микрофлюидных устройствах есть два пути эффективного смешивания жидких потоков: пассивные и активные. Пассивные смесители используют геометрию канала, чтобы изменить траекторию движения последних, обеспечив максимальную область их перемещения и соприкосновения. Примерами пассивных смесителей являются смесители распределения, статический смеситель, смеситель T-типа, вихревой смеситель, хаотический смеситель. Поток может делиться на несколько частей, чтобы увеличить эффект молекулярного распространения. Используется эффект Coanda, при котором создается конструкция наподобие крыла для расслаивания потока жидкости, а затем для объединения полученных слоев (рис. 6.4.2). Тем самым стимулируется активное перемешивание потоков.
84

А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
Активные миксеры используют внешние источники, чтобы увеличить область взаимодействия между жидкими потоками. Выбор типа смесителя зависит от перемешиваемых реактивов в реализуемом режиме смешивания, от ламинарности потоков на входе и выходе смесителя (то есть, числа Re). Некоторые смесители эффективны с более быстрыми потоками на входе, другие работают более эффективно с медленными потоками. Однако не существует единого подхода для оценки эффективности микросмесителей вследствие противоречивых мнений о том, как правильно определить количество и качество смешивания в микромасштабе.
Рисунок 6.4.2. Примеры конструкций смесителей (реакторов): а) смеситель серпантинного типа, b) смеситель на эффекте Coanda.
Разделение (сепарация) пробы при реализации капиллярного электрофореза на микрофлюидном чипе осуществляется в канале. Если в первых конструкциях МФЧ использовались сравнительно простые одноканальные топологии и линейные каналы (например, рис. 6.4.3 а), то по мере развития микроаналитических приборов появились и стали использоваться более сложные топологии чипов (рис. 6.4.3 б, в, г). Существенными характеристиками для достижения необходимого разрешения при разделении пробы являются: длина канала, параметры используемой среды разделения, параметры и режимы разделения.
Для улучшения качества разделения в канале МФЧ могут использоваться дополнительные элементы (наноструктуры), концентрирующие определенные фрагменты или изменяющие их подвижность. Так для разделения длинных ДНК молекул может быть использован чип с каналом, состоящим из множества ступенчатых элементов с нанометровыми размерами (рис. 6.4.4). Канал содержит узкие зоны сжатия пробы ДНК и более широкие области, которые позволяют создавать различия в электрофоретической подвижности компонентов, осуществляя, таким образом, эффективное разделение без использования гелевых матриц или импульсных электрических полей. Пойманные в узких зонах ДНК молекулы в конечном итоге мигрируют, с вероятностями, пропорциональными сечениям перекрытий молекул
Другим примером использования наноструктур в МФЧ является конструкция чипа с регулярными наноструктурами для разделения ДНК, приведенная на рис. 6.4.5.
Кроме перечисленных элементов топологии МФЧ используются и другие элементы и структуры, позволяющих проводить различного вида операции с пробой. Некоторые типичные схемы операций с пробой в МФЧ приведены на рис. 6.4.6.
85

А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
Клапаны, способные управлять движением жидкости, являются важными элементами во многих микрофлюидных устройствах. Существуют два типа клапанов: пассивные, которые не требуют никакой энергии и активные клапаны, которые используют энергию. Тип клапана, используемого в устройстве, зависит от решаемых задач. Активные клапаны применяются с внешними макроустройствами, которые обеспечивают поступление энергии и, в принципе, управляют клапаном. Некоторые конструкции содержат микроклапаны, приводимые в действие электромагнитами или пневматическими элементами. Другие активные клапаны используют энергию двигающейся жидкости, исключая потребность во внешней энергии. В последнее время ведутся разработки по созданию фоточувствительных полимеров, меняющих свою форму и свойства, эти особенности полимеров используются при создании фотоуправляемых микро/наноклапанов и насосов.
Современные технологии электронной техники позволяют создавать микронагреватели, микродатчики и другие функциональные элементы для МФЧ.
Рисунок 6.4.3. Топологии МФЧ для электрофоретических методов разделения пробы: а) – одна из первых конструкций МФЧ, б) – МФЧ с серпантинным каналом, в) – МФЧ с пост-колоночной дериватизацией, г) – многоканальный МФЧ для генетического анализа с двумя референтными каналами.
86

А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
Рисунок 6.4.4. МФЧ со ступенчатым наноразмерный канал для разделения фрагментов ДНК: А) продольный профиль канала, B) вид канала сверху, C) экспериментальная установка.
87

А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
Рисунок 6.4.5. МФЧ с регулярными наноструктурами для разделения ДНК.
Рисунок 6.4.6. Схемы реализации типичных операций на МФЧ: а) смешивание и взаимодействие пробы и реагента, б) образование фазовой границы, в) твердофазная экстракция, г) молекулярный транспорт и экстракция из растворителя, д) фазовое разделения, е) лазерный нагрев пробы или реагентов.
88
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
6.4.2.Конструкции аналитических микрочипов. Методы детектирования в микрочипах.
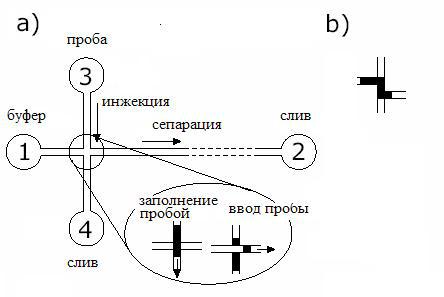
Всамом простом случае аналитического микрочипа необходимо, чтобы в чипе были: резервуары, в которые помещается транспортный буферный раствор и анализируемая проба; резервуары для слива отработанного материала; система каналов, соединяющих эти резервуары; элементы, обеспечивающие транспорт буфера и пробы. Если выбрать электрокинетические способы управления движением потоков и метод капиллярного электрофореза, как метод разделения пробы, то наиболее простая топология микрочипа представляет систему двух пересекающихся каналов оканчивающихся резервуарами – отверстиями (рис. 6.4.7). Эти отверстия снабжаются электродами, на которые подается напряжение с целью обеспечения процессов ввода и транспорта пробы. Конструкция такого МФЧ будет состоять из двух герметично соединенных пластин: пластины с микроканалами и отверстиями соединенной с защитной пластиной. При использовании оптических методов детектирования необходимо применять оптически прозрачные материалы: стекло, кварц, полимеры.
Если для работ по синтезу веществ критично поперечное сечение каналов, определяющее производительность за единицу времени, то при аналитическом использовании сечение канала может определять предел детектирования компонента. Чтобы создать эффективную миниатюрную аналитическую систему на основе МФЧ, необходимо оптимизировать массоперенос веществ, тепловыделение, использовать максимальную возможность увеличения плотности физических и химических процессов на единице поверхности МФЧ и обеспечить требуемую аналитическую чувствительность (или разрешение).
Рисунок 6.4.7. Топология простейшего МФЧ для электрофоретического разделения пробы (а) и укрупненный фрагмент пересечения каналов с Z-образной системой дозирования пробы (b).
Подготовка МФЧ осуществляется следующим образом: в резервуар 1 вносится буферный раствор, который под действием капиллярных сил заполняет каналы. Далее в резервуар 3 добавляется исследуемая проба, а затем на электроды, подведенные к резервуарам 3 и 4 на определенное время подается напряжение, под действием которого осуществляется массоперенос пробы по каналу инжекции к резервуару слива пробы 4. При этом часть пробы оказывается на участке, где каналы пересекаются.
89
А.А. Евстрапов. Курс лекций «Нанотехнологии в экологии и медицине»
Затем это напряжение выключается и подается высокое напряжение на электроды 1 и 2 (чтобы обеспечить эффективное разделение пробы на компоненты, обычно напряженность поля 200-500 В/см). Участок пробы («пробка» пробы), оказавшийся в месте пересечения каналов под действием электрического поля в сепарационном канале начинает двигаться к резервуару 2, причем заряженные компоненты пробы движутся с различными скоростями, распределяясь в процессе движения в соответствии с величиной своей электрофоретической подвижности. Области детектирования (область вблизи резервуара слива 2) сначала достигнут компоненты, имеющие малые размеры и большой отрицательный заряд, затем – частицы с другими соотношение заряда и размеров. Оптический детектор осуществляет регистрацию сигнала, причем амплитуда (площадь) регистрируемых пиков пропорциональна концентрации соответствующего компонента, а время миграции (время выхода пика) – содержит информацию об электрофоретической подвижности компонента.
Особенностью электрофореза в микрочиповом формате является относительно небольшая длина сепарационного канала (до нескольких см), что значительно ускоряет процесс разделения; отличные от КЭ условия ввода и дозирования пробы); меньший объем дозируемой пробы, что обуславливает проявление ряда специфических эффектов и во многих случаях низкий уровень аналитического сигнала. Последнее приводит к необходимости использования высокочувствительных систем детектирования. В Таблице 6.4.2 приведены сравнительные характеристики методов детектирования, наиболее часто используемые в микрофлюидных аналитических системах.
ВМФЧ объем области детектирования в ряде случаев определяет величину аналитического сигнала. Сигнал фотометрического детектора зависит от длины оптического пути (глубина или ширина канала), флуорометрического детектора – зависит от детектируемого объема, в то время как сигнал амперометрических детекторов пропорционален площади сечения канала. Для потенциометрических и
рефрактометрических детекторов аналитический сигнал почти не зависит от объема (Ca2+-селективный электрод, RI-детектор). В нанофлюидных системах создаются условия, при которых осуществляется детекция отдельных частиц, и в этом случае регистрируется сигнал от отдельной молекулы или частицы.
Впоследнее время проявляется тенденция создания аналитических систем на микрочиповой платформе, в которых разработчики пытаются объединить все основные процессы анализа. При этом даже используются различные системы детектирования, позволяющие получить информацию о компонентах пробы на разном уровне: микро- и нано. Вариант такой интегрированной платформы приведен на рис. 6.4.8.
90
