
- •Занятие № 12
- •1. Тема занятия «Молекулярные основы наследственности и изменчивости. Регуляция эскпрессии генов у про - и эукариот»
- •2. Формы работы:
- •3. Перечень вопросов для самоподготовки по теме практического занятия
- •4. Самоконтроль по тестовым заданиям данной темы
- •5. Самоконтроль по ситуационным задачам
- •6. Перечень практических умений по изучаемой теме.
- •7. Рекомендации по выполнениюНирс:
- •Ученые ищут новые способы лечения бас
- •Ученые из Японии выявили гены, связанные с заболеваниями периферических артерий
- •Аутоиммунные болезни: гены и их регуляция
- •Генетика
- •Эпигенетика
- •Совершит ли система редактирования днк революцию в медицине?
- •Http://cbio.Ru/page/43/id/5777/ Ученые аннотировали значительную часть микроРнк
- •Экзогенная микроРнк из пищи матери способна проходить через плаценту и регулировать экспрессию генов плода
- •1. Суть исходной ситуации
- •2. В передней доле гипофиза:
1. Суть исходной ситуации
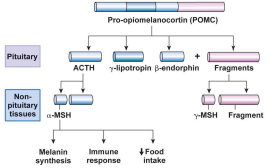
1.1. В состав единственного полипептидного продукта с мол. Массой 32000 дальтон входит несколько полипептидных гормонов, а также другие участки, аминокислотные последовательности которых тоже могут иметь биологическое значение.
1.2. Все существующие индивидуальные продукты имеют сходные границы, которые представлены парами основных аминокислот, образующих участки, расщепляемые трипсиноподобными ферментами. В двух тканях, в которых экспрессируется ген ПОМК, расщепление продукта происходит по разным сайтам.
2. В передней доле гипофиза:
2.1. В белок проопиомеланокортин(ПОМК)сначала вносится один разрыв, в результате которого образуетсяN-концевой фрагментиβ- липотропин(состоящий из 70-90 аминокислот).
2.2. Затем N-концевой фрагмент расщепляетсяс образованием гормонаАКТГ (длиной 39 аминокислот). В этой ткани реакция дальше не происходит.
3. В промежуточной доле гипофиза:
3.1. АКТГ расщепляется, образуяα-меланотропин(α-МСГ), обладающиймеланостимулирующейактивностью и состоящий из 13 амитнокислот.
3.2. Параллельно и β- липотропин также расщепляется еще в одном сайте. Это приводит к образованию анальгетикаβ - эндорфина(«гормона удовольствия», состоящего из 31 аминокислоты)
4. Выводы:
Подобные превращения свидетельствуют о том, что:
4.1. существует перекрывание последовательностей белков, в данном случае – гормонов.
4.2. Один ген способен кодировать различающиеся (хотя и перекрывающиеся) аминокислотные последовательности путём изменений в ходе процессинга белка.
Источник информации:Льюин Б. Гены. –М.:Мир,( с. 339-341)
Проопиомеланокортин: гормон радости, спорта, загара, секса и жиросжигания.
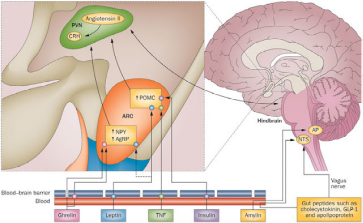
Как связаны с собой острый стресс, радость, счастье, жиросжигание и цвет кожи. Речь пойдет о гипофизе – это такой нервный центр, который является оперативным штабом и координирует разные системы органов в нашем организме.В гипофизе вырабатывается особое вещество, которое называется проопиомеланокортин (ПОМК).
В зависимости от ситуации, наш организм может разрезать это вещество разными способами и получить разные гормоны. Таким образом, из одного гормона можно получить множество разных веществ! Это и липотропин (гормон жиросжигания), эндорфин (удовольствие), мелноцитстимулирующий гормон (цвет кожи), адренокортикотропный гормон (стресс). Самый важный вывод! Все продукты расщепления проопиомеланокортина производятся в эквимолярных количествах и секретируются в кровь одновременно. Таким образом, невозможно увеличение секреции адренокортикотропного гормона без сопутствующего увеличения секреции бета-липотропного гормона. И наоборот, невозможно увеличение секреции бета-липотропного гормона без сопутствующего увеличения секреции кортикотропина. Это же верно про эндорфины. Без острого стресса не будет никакого удовольствия, так как эти гормоны производятся строго один к одному!
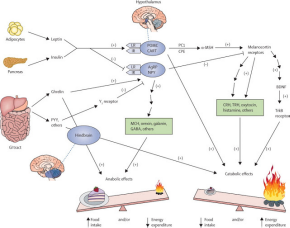
Функция проопиомеланокортина.
Активация гипофизарной системы проопиомеланокортина (ПОМК) происходит под воздействием физических, психологических и иммунологических стрессовых воздействий, которые индуцируют секрецию фрагментов ПОМК в сердечно-сосудистую систему. Наиболее демонстративно взаимодействия нейроэндокринной и иммунной систем проявляются в реакции стресс. Известно, что эта защитная биологическая реакция развивается в ответ на действие широкого спектра агрессивных факторов внешней среды, таких как микробные, температурные, болевые агенты, факторы неподвижности, гравитации, психоэмоциональные воздействия и ряд других. Проопиомеланокортин занимает центральное место в регуляции физиологического гомеостаза организма. Спектр действия пептидов - производных проопиомеланокортина - в организме очень широк. Под их контролем находятся процессы нормального развития, поведения, памяти, эмоционального и физиологического ответа на стресс. Нарушение нормального синтеза и процессинга производных ПОМК приводит к возникновению стресс зависимых заболеваний и психосоматических синдромов. Очевидно, присутствие идентичного для всех гормонов данной группы гептапептидного фрагмента определяет наличие у них таких важных общих функциональных свойств, как влияние на пигментацию меланоцитов ( меланоцитстимулирующая активность ) и жировой обмен в липоцитах адипозной ткани ( липотропная активность ), стимуляция биосинтеза кортикостероидов в коре надпочечников и пролиферация ее клеток ( кортикотропная активность ). Внутри отмеченного гептапептидного компонента имеется тетрапептид Мет-Глу-Гис-Фен , ответственный за регуляцию всеми гормонами семейства процессов формирования и особенно удержания долговременной памяти на уровне гиппокампа и амигдалы . Сколько резать в граммах?
Сам ПОМК не обладает гормонально активными свойствами. Гормонально активными являются продукты его расщепления специфическими эндопептидазами. При этом существует три различных пути расщепления ПОМК, дающих три различных семейства метаболитов, в зависимости от мест расщепления молекулы, что определяется воздействием специфических эндопептидаз. Отметим, что уровень лептина определяет, как будет идти процесс резки проопиомеланокортина.
1. Адренокортикотропный гормон ( АКТГ) из которого могут образоваться α-меланоцитстимулирующий гормон (МСГ) и кортикотропиноподобный промежуточный пептид (КППП), 2. β-Липотропин, служащий предшественником γ-липотропина и β-эндорфина. Из них в свою очередь образуются β-МСГ, γ-эндорфин и α-эндорфин. 3. γ-Меланоцитстимулирующий гормон. Указанные пептиды способны претерпевать дополнительные модификации с образованием других регуляторных пептидов (например, энкефалинов). Механизмы действия и эффекты большинства производных проопиомеланокортина недостаточно изучены. Таким образом, из одной молекулы образуются: АКТГ (адренокортикотропин), МСГ (альфа-меланоцитстимулирующие гормоны, бета-меланоцитстимулирующие гормоны и гамма-меланоцитстимулирующие гормоны), ЛПГ (бета-липотропин и гамма-липотропин), и бета-эндорфин. В зависимости от места синтеза (передняя либо средняя доля гипофиза) и от конкретных стимулов ПОМК подвергается следующим преобразованиям:
Путь активности (физуха и острый стресс)
В кортикотропах передней доли гипофиза при стимуляции кортикотропин-рилизинг-гормоном синтезируются эндопептидазы, расщепляющие ПОМК на адренокортикотропный гормон и бета-липотропный гормон. Бета-липотропный гормон — это гормон передней доли гипофиза, образующийся в кортикотропных клетках передней доли гипофиза при расщеплении проопиомеланокортина. Вместе с β-липотропным гормоном образуется адренокортикотропный гормон. β-липотропный гормон вызывает усиление жиросжигания в подкожной жировой ткани и уменьшение синтеза и отложения жира. Путь страсти (дофамин)
В меланотропах средней доли гипофиза при стимуляции дофамином производятся эндопептидазы, расщепляющие ПОМК на альфа-меланоцитстимулирующий гормон, бета-эндорфин и гамма-липотропный гормон. Гамма-липотропный гормон — это гормон средней доли гипофиза, образующийся в кортикотропных клетках средней доли гипофиза при расщеплении проопиомеланокортина. Вместе с γ-липотропным гормоном образуются альфа-меланоцитстимулирующий гормон, бета-эндорфин и др. Гамма-липотропный гормон вызывает усиление жиросжигания в подкожной жировой ткани и уменьшение синтеза и отложения жира. Альфа-меланоцитстимулирующий гормон стимулирует размножение меланоцитов кожи и усиление выработки меланоцитами чёрного пигмента — меланина. Благодаря этому эффекту альфа-меланоцитстимулирующий гормон усиливает пигментацию кожи и повышает устойчивость кожи к ультрафиолету. Путь темноты и покоя.
В меланотропах средней доли гипофиза производятся также эндопептидазы, расщепляющие ПОМК на гамма-меланоцитстимулирующий гормон и мет-энкефалин. Однако предполагается, что эти пептиды участвуют в регуляции экстрапирамидной, лимбической системы и нейроэндокринных функций и, кроме того, модулируют болевые восприятия, обладают эйфоригенными и подкрепляющими свойствами. Мет-энкефалин модулирует образование медиатора термогенеза- интерлейкина1, тормозит высвобождение дофамина и норадреналина из везикул симпатических нервных окончаний и подавляет секрецию тиреотропина, а также усиливает распад АТФ в мышечных клетках.
Липотропный гормон.
Липотропный гормон вызывает также очень приятные ощущуния удовольствия. Мишенью являются жировая ткань, где он стимулирует жиросжигание и мобилизацию жирных кислот. Основная роль – источник эндогенных опиатов (α-, β-, γ-эндорфинов) в головном мозге, которые вызывают обезболивание, снятие ощущений страха и т.п. Именно поэтому и говорят, что радость обладает прямым жиросжигающим действием.
Адренокортикотропный гормон, кортикотропин (АКТГ)
Адренокортикотропный гормон вызвает выработку кортизола. Нейротропные эффекты кортикотропина не зависят от гормонального действия, а являются результатом его прямого влияния на центральную нервную систему.
Меланоцитстимулирующие гороны
Существует три основные разновидности МСГ, часто их в целом называют меланокортин
Альфа-меланоцитстимулирующий гормон (α-МСГ) Бета-меланоцитстимулирующий гормон (β-МСГ) Гамма-меланоцитстимулирующий гормон (γ-МСГ).
Меланокортин: вызывает пигментацию кожи за счет образования меланина (фармакологический загар), повышает либидо и усиливает эрекцию (уже через 2 часа после первой инъекции), подавляет аппетит, способствует сжиганию жира. Мишенью являются меланоциты кожи, радужки, пигментного эпителия сетчатки глаза, в которых стимулирует меланиногенез и пигментацию. Активно влияют на пищевое поведение.
Заключение.
И теперь еще раз самый важный вывод! Все продукты расщепления проопиомеланокортина производятся в эквимолярных количествах и секретируются в кровь одновременно. Таким образом, невозможно увеличение секреции адренокортикотропного гормона без сопутствующего увеличения секреции бета-липотропного гормона. И наоборот, невозможно увеличение секреции бета-липотропного гормона без сопутствующего увеличения секреции кортикотропина. Это же верно про эндорфины. Без острого стресса не будет никакого удовольствия, так как эти гормоны производятся строго один к одному! Вы можете тянуть за разные части этого клубка: радость, острый стресс, эндорфин, творчество, радость, страсть, солнце и загар, физическая активность ...и все это будет запусткать выработку одного и того же гормона - проопиомеланокортина со всеми его положительными свойствами. Так что выбирайте, что вам больше нравится - и действуйте!
Материал по регуляции трансляции мРНК
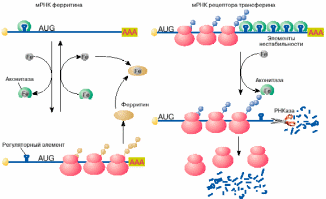
Яркий пример регуляции трансляции мРНК в эукариотических клетках получен при изучении механизмов поддержания в клетках уровня свободного железа. Железо входит в состав активных центров очень многих белков, таких, например, как гемоглобин , миоглобин, цитохромы , однако ионы свободного железа токсичны для клетки и поэтому связываются и переводятся в нетоксичную форму белком ферритином. Синтез ферритина в клетке, в свою очередь, зависит от уровня свободного железа: в присутствии железа ферритин синтезируется, в то время как при его недостатке трансляция мРНК ферритина останавливается на стадии инициации. Выяснилось, что регуляция синтеза ферритина целиком зависит от специфической последовательности длиной 26 нуклеотидов, образующей шпилечную структуру в 5'-НТО мРНК ферритина (рис. 4, а). Этот регуляторный элемент при отсутствии железа связывается со специфическим белком, который препятствует сканированию 5'-НТО рибосомами и, таким образом, подавляет трансляцию мРНК на стадии ее инициации. Этот белок- репрессор имеет сродство к ионам железа и при связывании с ними перестает связываться с ферритиновой мРНК. После диссоциации белка мРНК становится активной в синтезе ферритина. Вновь синтезированный ферритин отнимает железо у репрессора. Утратив железо, репрессор опять приобретает сродство к регуляторному элементу ферритиновой мРНК, связывается с ним и останавливает синтез ферритина. Большим сюрпризом явилось то, что белок-репрессор оказался хорошо известным ферментом цикла Кребса - аконитазой.
Информация обязательная для каждого обучающегося
Регуляция активности генов у прокариот.
Исследования на клетках Е. coli позволили установить, что у бактерий существуют ферменты 3 типов:
1.Конститутивные, присутствующие в клетках в постоянных количествах независимо от метаболического состояния организма (например, ферменты гликолиза);
2.Индуцируемые, их концентрация в обычных условиях мала, но может возрастать в 100Q раз и более, если, например, в среду культивирования клеток добавить субстрат такого фермента;
3.Репрессируемые, т.е. ферменты метаболических путей, синтез которых прекращается при добавлении в среду выращивания конечного продукта этих путей.
!!! Это НАДО ЗНАТЬ
!!! Процесс Транскрипции - первичные транскрипты. Их Особенность : не содержат Интронов, мРНК лишены "кэпа" и поли-А-конца, Транскрипция и Трансляция протекают почти одновременно.
!!!! При нормальных условиях роста E/coli синтезирует около 600-800 различных белков, многие гены (исходя из размера генома - 4×106 пар нуклеотидовне) не транскрибируются, т.е. неактивны.
!!! Гены белков, функции которых в метаболических процессах тесно связаны, часто в геноме группируются вместе в структурные единицы – Опероны .
Опероны - участки молекулы ДНК, которые содержат информацию о группе функционально взаимосвязанных структурных белков, и регуляторную зону, контролирующую транскрипцию этих генов.
!!! Структурные гены Оперона экспрессируются согласованно: либо все они транскрибируются, и тогда оперон активен, либо ни один из генов не "прочитывается", и тогда оперон неактивен. Принцип «ВСЕ или НИЧЕГО».
Оперон активен : все его гены транскрибируются, синтезируется полицистронная мРНК - матрица для синтеза всех белков этого оперона.
!!! Транскрипция структурных генов зависит от :
- способности РНК-полимеразы присоединяться к промотору, расположенному на 5'-конце оперона перед структурными генами;
- от присутствия белка-репрессора на смежном с промотором участке, который называют "оператор". Белок-репрессор синтезируется в клетке с постоянной скоростью и имеет сродство к операторному участку.
-структурно участки промотора и оператора частично перекрываются, поэтому присоединение белка-репрессора к оператору создаёт стерическое препятствие для присоединения РНК-полимеразы.
!!! Большинство механизмов регуляции синтеза белков направлено на изменение скорости связывания РНК-полимеразы с промотором, влияя, таким образом, на этап инициации транскрипции.
Теория оперона.
Теория оперона была предложена на основании данных, полученных при изучении свойств лактозного оперона (laс-оперона) Е. coli, т.е. оперона, в котором закодированы белки, участвующие в усвоении лактозы.
В отсутствие индуктора (лактозы) белок-репрессор связан с оператором. А поскольку участки оператора и промотора перекрываются, то присоединение репрессора к оператору препятствует связыванию РНК-полимеразы с промотором, и Транскрипция Структурных генов оперона НЕ идёт.
Когда в среде появляется индуктор, т.е. лактоза, то он присоединяется к белку-репрессору, изменяет его конформацию и снижает сродство к оператору. РНК-полимераза связывается с промотором - Транскрибирует структурные гены.
Снижение концентрации фермента в бактериальной клетке может осуществляться путём репрессии синтеза ферментов.
Механизмы регуляции экспрессии генов у эукариот.
В клетках млекопитающих наряду с адаптивной регуляцией, существуют механизмы, которые сохраняют стабильную (существующую на протяжении всей жизни клетки и даже многих её генераций) репрессию одних генов и депрессию других.
А. Организация гетерохроматина
Известно, что
1. В ядрах дифференцированных клеток хроматин имеет такую укладку, что только небольшое число генов (часто менее 1%) доступно для транскрипции.
2. Различают участки гетерохроматина, в которых ДНК упакована очень компактно и недоступна для транскрипции, и участки эухроматина, имеющие более рыхлую укладку и способные связывать РНК-полимеразу.
3. В разных типах клеток в область эухроматина попадают разные гены: в разных тканях транскрибируются разные участки хроматина.
Причины стойкой репрессии генов гетерохроматина:
-пространственная укладка ДНК
- метилирование дезоксицитидина ДНК-метилазами в 5'-CG-3' последовательностях ДНК
-связыванием с гистонами и образованием нуклеосом.
Области эухроматина (расположены активно транскрибируемые гены) обладают структурными особенностями:
-они более чувствительны к действию ферментов ДНК-аз
- молекулы гистонов, связанные с ДНК в этих участках, модифицированы (метилирование в гистонах Н2А и Н2В )
- присоединяется группа негистоновых HMG-белков, связывание с ними ослабляет взаимодействие ДНК и гистонов и вызывает дополнительное повышение транскрипционной активности генов.
Механизмы регуляции:
изменение количества структурных генов;
перестройка генов в хромосомах;
эффективность транскрипции разных участков генома;
характер посттранскрипционных модификаций первичных транскриптов;
на уровне трансляции;
с помощью посттрансляционных превращений вновь синтезированных полипептидных цепей.
В. Изменение количества генов
Амплификация (или увеличение числа) генов используется организмом в том случае, когда возникает необходимость увеличить синтез определённого генного продукта. Многие гены, кодирующие белки или РНК, необходимые организму в больших количествах (например, гистоны, рРНК, тРНК), постоянно присутствуют в амплифицированном состоянии.
Пример: К числу генов, для которых обнаружена амплификация, относят ген металлотионеина. Продукт экспрессии этого гена - низкомолекулярный белок металлотионеин, обладающий способностью связывать тяжёлые металлы (медь, цинк, кадмий, ртуть) и защищать клетки от отравления этими соединениями. Установлено, что в ответ на повышение концентрации тяжёлых металлов в крови в клетках происходит амплификация гена металлотионеина.
Утрата генетического материала - довольно редкий способ регуляции. Наиболее яркий пример потери всех генов за счёт разрушения ядра - процесс созревания эритроцитов.
С. Перестройка генов
Генетическая рекомбинация:
при половом слиянии яйцеклетки и сперматозоида;
при перемещении подвижных генетических элементов - транспозонов, в состав которых входят отдельные гены или группа генов, с исходной позиции в какое-либо другое место той же или другой хромосомы;
при формировании в лимфоцитах "библиотеки" генов, кодирующих антитела или иммуноглобулины.
Пример: Образование у H.s. около 10 млн (107) различных антител. Огромное многообразие белков иммунной системы кодируется ограниченным количеством генетического материала, изменения в котором обеспечиваются рекомбинациями и соматическими мутациями (или изменениями в структуре ДНК, которые сохраняются при последующих делениях клеток).
Д. Регуляция транскрипции
! Принимает участие значительно большее количестве участков ДНК и регуляторных факторов, контролирующих этот процесс.
! У животных и человека различные гены экспрессируются в разные моменты времени и с разной интенсивностью.
!есть гены, транскрибирующиеся конститутивно, т.е. постоянно и во всех тканях, например, гены гликолиза, синтеза РНК и некоторых белков (например, альбумина).
!есть гены, транскрибирующиеся только в специализированных клетках, т.е. имеет место тканеспецифическая экспрессия. Например, экспрессия генов α- и β-цепей глобина происходит только в клетках-предшественниках эритроцитов.
!Многие гены подвергаются адаптивной регуляции и являются объектами негативного контроля.
!!! Минимальный синтез любого белка поддерживается в том случае, если к ТАТА-участку промотора присоединяется ТАТА-связывающий белок, факторы транскрипции и РНК-полимераза, образующие инициирующий комплекс, осуществляющий синтез небольшого количества мРНК. Промоторы эукариотических генов находятся под контролем большого числа регуляторных участков на молекуле ДНК: TATA-, CAAT-, GC-последовательностей, энхансеров, сайленсеров-последовательностей, к которым присоединяются комплексы белков с различными лигандами (цАМФ, стероидными гормонами, метаболитами, ионами металлов и т.д.).
Е. Посттранскрипционная регуляция
Основные способы :
- альтернативный сплайсинг
- изменение стабильности РНК.
Альтернативный сплайсинг: многие эукариотические гены, будучи транскрибированы, образуют несколько вариантов зрелой мРНК в ходе процессинга (или созревания) первичного транскрипта, имеющего полиэкзонное строение.
! Часто промотор сохраняется на одном из концов транскрипта, а в ходе сплайсинга происходит "вырезание" одного или нескольких экзонов.
! В зрелой мРНК сохраняется часть интрона и включается в состав экзона с 5' или 3'-конца.
Часто встречающиеся варианты сплайсинга первичных транскриптов РНК: I. Вырезание одного из экзонов: а) синтез белка, содержащего полный набор экзонов (1-5); б) синтез белка, лишённого одного экзона (1, 2,4, 5); II. Сохранение участка интрона: а) с 5'-конца; б) с 3'-конца. III. Сохранение целого интрона. IV. Использование альтернативных промоторов (либо перед экзоном 1, либо перед экзоном 2). V. Использование альтернативных участков полиаденилирования (например, при последовательном сшивании экзонов после экзона 3, а если экзон 3 не прочитывается, то после экзона 4).
Изменение стабильности мРНК. Для того, чтобы участвовать в синтезе белка, мРНК должна выйти из ядра в цитоплазму через ядерные поры. Установлено, что в ядре клеток обычно синтезируется больший набор гетерогенных РНК, чем тот, что выходит в цитоплазму. мРНК, что, транспортируются из ядра в цитоплазму, защищаются от гидролитического разрушения, образуя комплексы с белками.
Продолжительность жизни разных мРНК варьирует в достаточно широких пределах. Пример: в ходе транскрипции гена β-глобина образуется мРНК с t1/2, равной примерно 10 ч.

Пример: "Редактирование" мРНК апопротеина В.
В ходе транскрипции гена апопротеина В в печени образуется мРНК, служащая матрицей для синтеза белка, состоящего из 4563 аминокислотных остатков.
В клетках тонкого кишечника экспрессия того же гена вызывает образование белка, состоящего из 2152 аминокислот. В РНК транскрипте цитозин кодона 2153 - САА превращается в урацил (U), и возникает стоп-кодон в середине молекулы мРНК. Это приводит к синтезу укороченного белка.
F. Регуляция трансляции и посттрансляционных модификаций
Различия в продолжительности жизни молекул белка
После того как белки синтезированы, время их жизни регулируется протеазами. ! Разные белки имеют разные t1/2: от нескольких часов до нескольких месяцев, а иногда и лет (н-р, период полураспада некоторых белков в клетках млекопитающих: ф. Альдолаза - T1/2,ч 118; Цитохром С – 150).
! Ферменты, катализирующие регуляторные реакции метаболических путей, как правило, подвергаются быстрому расщеплению, поэтому скорость обновления этих молекул достаточно высока.
! Некоторые белки расщепляются лизосомными ферментами.
! Для других белков показано расщепление в цитоплазме протеазами , их метят путём присоединения белка убиквитина, он обнаружен у многих организмов.
Точная работа всех матричных биосинтезов - репликации, транскрипции и трансляции - обеспечивает копирование генома и воспроизведение фенотипических характеристик организма в поколениях, т.е. наследственности.
Установлено, что геном постоянно претерпевает разнообразные изменения. Несмотря на эффективность механизмов коррекции и репарации ДНК, часть повреждений или ошибок в ДНК остаётся.
