
Pivovarennaya_inzheneria_ / Глава 3
.pdf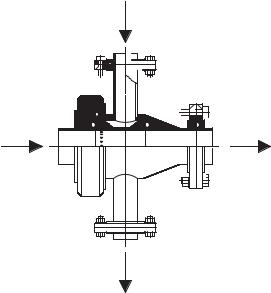
ДРОЖЖИ И ДРОЖЖЕВОЕ ХОЗЯЙСТВО ПИВОВАРЕННОГО ПРОИЗВОДСТВА |
145 |
|
|
стерильного воздуха. Барботеры загромождают внутреннее пространство дрожжеге нератора и затрудняют его мойку.
При внутренней аэрации с применением барботеров концентрация дрожжей в дрож жегенераторе может достигать 100–120 млн клеток/мл, в то время как при использо вании внешней аэрации в специальном аэраторе — 150–160 млн клеток/мл.
При внешней аэрации осуществляют циркуляцию культуры с помощью насоса через специальный дрожжевой аэратор витализатор, в котором, в отличие от аэратора сусла (см. раздел 6.4.5.3.6), проходное сечение канала должно быть одинакового диаметра — без сужений и без встроенных конструктивных элементов, поскольку изменение скорости потока негативно влияет на физиологическое состояние дрожжей. Кроме того, в аэраторе витализаторе должно поддерживаться стабильное избыточное давление, поскольку при резком разрежении могут разрываться оболочки клеток. Конструктивное устройство аэратора должно соответствовать требованиям тщательной безразборной мойки как его проточной части, так и каналов, по которым нагнетают сжатый стерильный воздух. Конструкция аэратора витализатора, разработанная предприятием Steinecker и отвечающая вышеперечисленным требованиям, показана на рис. 3.18.
Воздух
Вход |
Выход |
дрожжей |
дрожжей |
СИП отвод
Рис. 3.18. Принципиальное устройство аэратораAвитализатора дрожжевой культуры конструкции Steinecker
Условия перекачивания культуры должны быть таковы, чтобы на поверхности клеток не возникали касательные напряжения, а гидродинамические воздействия на дрожжи были минимальны. Это обеспечивают, в частности, относительно невысокими скоростя ми потока (до 1,2 м/с) и применением специальных насосов для перекачивания дрожжей.
146 |
ПИВОВАРЕННАЯ ИНЖЕНЕРИЯ |
|
|
3.3.5. Хранение семенных и избыточных дрожжей
По окончании главного брожения низовые дрожжи скапливаются на дне бродильного аппарата, образуя плотный осадок, состоящий из трех слоев:
1)в верхнем слое содержатся частицы, осевшие последними, в частности, наиболее активные дрожжевые клетки, белковые хлопья, хмелевые смолы и прочие взвеси;
2)в среднем слое содержатся активные дрожжевые клетки с минимальным количе ством механических и биологических загрязнений;
3)в нижнем слое скапливаются преимущественно нежизнеспособные дрожжевые клетки и белок, а также живые тяжелые клетки, осевшие в начальной стадии бро
жения.
Верхний и нижний слои осадочных дрожжей отделяют от общей дрожжевой массы и повторно не используют, а средний слой отводят из бродильного аппарата в сборники для хранения. В последующем их используют повторно в качестве семенных дрожжей, как правило, до 5–8 циклов.
Семенные дрожжи должны обладать хорошей жизнеспособностью — достаточ ной бродильной силой, характеризующейся способностью сбраживать не менее 1% экстракта в течение первых 24 ч после внесения дрожжей, при этом через 4–5 сут остаточный экстракт в пиве не должен превышать 0,1–0,3%. В семенных дрожжах должны отсутствовать чужеродные дрожжи и прочие микроорганизмы. Средняя концентрация густых семенных дрожжей составляет 3 109 клеток/мл. Содержание мертвых клеток в семенных дрожжах должно быть менее 2% (в крайнем случае, не более 5%). Дрожжи должны обладать хорошей седиментационной способностью — остаточная концентрация дрожжей в пиве по окончании главного брожения не долж на превышать 2 106 клеток/мл.
Осадочные дрожжи отводят из ЦКБА при температуре 5–6 °С в количестве 2,8–3,2 л дрожжей с каждого гектолитра пива, охлаждают до 1–2 °С и аэрируют для декарбони зации. Если дрожжи нужно хранить относительно долго, например неделю, то аэрацию в этом случае не делают.
Дрожжи в процессе хранения находятся в пассивном состоянии, при этом лучше всего их хранить под углекислотой. Но перед брожением дрожжи должны быть актив ными и сильными, для чего осуществляют:
•первую аэрацию — для удаления из дрожжевой массы диоксида углерода;
•вторую аэрацию — непосредственно перед подачей дрожжей в ЦКБА.
Для лучшего удаления диоксида углерода культуру дрожжей перекачивают насо сом по циркуляционному контуру, причем входящая в аппарат струя выходит из пат рубка вертикально вверх и рассекается с помощью отбойного колпака. В сборниках для хранения дрожжей обеспечивают противодавление (0,07 МПа), чтобы избежать обильного пенообразования при аэрации.
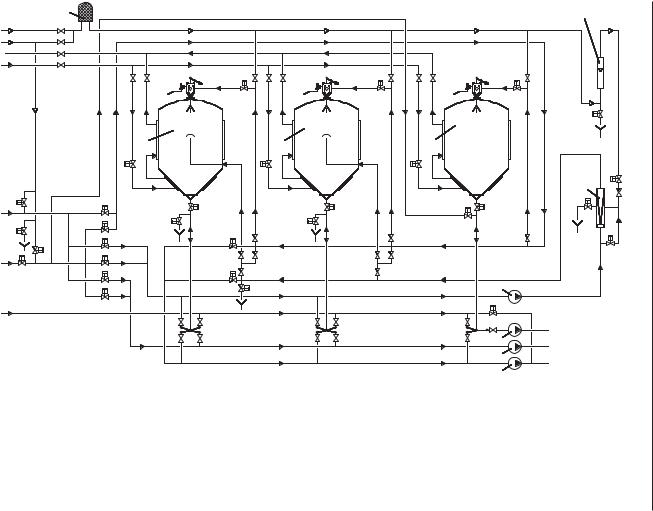
Для обеспечения аэрации дрожжей в нескольких сборниках для хранения ис пользуют единый циркуляционный контур с общим аэратором, но если применя ют разные штаммы дрожжей, то целесообразно для циркуляции и аэрации приме нять раздельные линии. Схема установки для хранения семенных дрожжей пока зана на рис. 3.19.
1 |
4 |
Воздух
Пар
Хладагент  Хладагент
Хладагент
2 |
2 |
3 |
5
СИП
подача
Вода
холодная
6
Дрожжи
осадочные
 Дрожжевые отходы
Дрожжевые отходы
7
 Дозирование дрожжей
Дозирование дрожжей
8
 СИП возврат
СИП возврат
9
Рис. 3.19. Схема установки для хранения семенных дрожжей:
1 — фильтр стерилизующий; 2 — сборник для семенных дрожжей; 3 — сборник для отработанных дрожжей; 4 — расходомер; 5 — аэратор; 6 — насос циркуляционный; 7 — насос для отвода отработанных дрожжей; 8 — насос для подачи семенных дрожжей
на брожение; 9 — насос для возврата растворов СИП
147 ПРОИЗВОДСТВА ПИВОВАРЕННОГО ХОЗЯЙСТВО ДРОЖЖЕВОЕ И ДРОЖЖИ
148 |
ПИВОВАРЕННАЯ ИНЖЕНЕРИЯ |
|
|
Избыточные дрожжи накапливают в специальном сборнике, осуществляют в нем автолиз дрожжей, после чего направляют в сельское хозяйство для кормовых целей. В некоторых случаях избыточные дрожжи перерабатывают в пивные дрожжи меди цинского назначения, богатые биологически активными соединениями, в частности витамином D.
3.3.5.1. Сборники семенных и избыточных дрожжей
Конструкция сборников семенных и избыточных дрожжей во многом аналогична кон струкции дрожжегенератора — они представляют собой вертикальные аппараты цилинд роконической формы из высококачественной нержавеющей стали с углом конического днища 90°. Внутренняя поверхность сборников должна быть отполирована. На цилинд рической и конической частях корпусов сборников размещены рубашки. Сборники уста навливают на трубчатых опорах и оснащают тензометрическими взвешивающими уст ройствами для контроля массы содержащихся в них дрожжей. Сборники оснащают про боотборниками.
Внижней части конического днища сборников располагают люк диаметром 450 мм
соткидной крышкой, фиксируемой болтовыми соединениями. Уплотнение люка, сопри касающееся с внутренней поверхностью сборника, обычно изготавливают из силикона.
На верхней крышке сборников располагают предохранительный и вакуумный клапа ны, стерилизующий воздушный фильтр и систему подсветки.
3.3.6.Инженерные расчеты оборудования для получения и хранения дрожжей
Расчет рабочей вместимости дрожжегенератора, гл:
νрд = |
VрбNб |
, |
(3.40) |
|
|||
|
Nд |
|
|
где Nб — начальная концентрация дрожжей в бродильном аппарате, млн клеток/мл; Nд — концентрация дрожжей в семенной культуре, млн клеток/мл; Vpб — рабочая вмес тимость бродильного аппарата, гл.
Норма внесения дрожжей в цилиндроконический аппарат составляет 12–15 млн клеток/мл.
Общую вместимость дрожжегенератора определяют с учетом коэффициента заполне ния, который принимают равным 0,6.
Рабочую вместимость каждого сборника для хранения семенных дрожжей рассчиты вают исходя из объема дрожжей, необходимого для внесения в один ЦКБА, а количество сборников должно обеспечить двухсуточный запас хранения семенных дрожжей.
Рабочую вместимость сборников для избыточных дрожжей рассчитывают на двух суточное хранение, с учетом того, что из каждого гектолитра сусла получают около 2 л избыточных дрожжей, требующих утилизации.
Коэффициент заполнения сборников для семенных и избыточных дрожжей при нимают 0,7. Соотношение диаметра к высоте цилиндрической части сборников при нимают обычно 1 : (1–2).
ДРОЖЖИ И ДРОЖЖЕВОЕ ХОЗЯЙСТВО ПИВОВАРЕННОГО ПРОИЗВОДСТВА |
149 |
|
|
3.4. ОСНОВНЫЕ ПРОБЛЕМЫ И ТЕНДЕНЦИИ ТЕХНИЧЕСКОГО РАЗВИТИЯ ПОЛУЧЕНИЯ И ХРАНЕНИЯ ПИВНЫХ ДРОЖЖЕЙ
При техническом совершенствовании систем для получения и хранения пивных дрож жей следует стремиться к обеспечению наиболее благоприятных условий для развития дрожжей, при которых их концентрация была бы максимально возможной, упитанность достаточно высокой, а количество нежизнеспособных клеток — минимальным.
Одним из путей к созданию таких систем является организация непрерывного куль тивирования дрожжей, которое достаточно широко и эффективно применяют в совре менной биотехнологии.
По сравнению с периодическим культивированием дрожжей, при котором развитие культуры лимитируется потреблением субстрата, а также накоплением продуктов мета болизма и биомассы, при непрерывном культивировании влияние этих лимитирующих факторов может быть устранено за счет бесперебойной подачи в биореактор свежего суб страта и непрерывного отвода образующихся продуктов и биомассы.
При непрерывном культивировании культура дрожжей стабилизируется в фазе ак тивного биосинтеза (в фазе экспоненциального роста) довольно продолжительное время. При этом все стадии процесса осуществляют одновременно в самых благоприятных усло виях при неизменных и оптимальных параметрах.
К преимуществам непрерывного культивирования относят:
•более высокое качество получаемых дрожжей, поскольку культивирование осу ществляют в условиях установившегося режима, обеспечивающих оптимальное физиологическое состояние культуры — в фазе экспоненциального роста;
•компактность и меньшую материалоемкость оборудования по сравнению с обо рудованием периодического действия той же производительности;
•простоту обслуживания, поскольку сокращаются затраты рабочего времени на вспомогательные операции — загрузку и разгрузку дрожжегенератора, его мойку
исанитарную обработку;
•простоту автоматизации, поскольку все параметры неизменны;
•постоянную работу установки с полной нагрузкой;
•более высокую продуктивность по сравнению с периодическим культивированием. Однако концентрация готовой культуры дрожжей, получаемых в процессе непре
рывного культивирования, всегда бывает ниже, что требует дополнительных затрат на сгущение биомассы. Это обстоятельство является основной причиной, сдерживаю щей применение в пивоварении систем непрерывного культивирования дрожжей.
Помимо этого к техническим проблемам непрерывного культивирования дрожжей следует отнести:
•более высокие требования к герметизации оборудования для сохранения асептики;
•более сложное конструктивное устройство аппаратуры и систем контроля, что ведет к увеличению капитальных затрат;
•повышенную степень загрязнения внутренних поверхностей дрожжегенератора и расположенных внутри его устройств при продолжительном культивировании дрожжей;
•угроза утраты ценных свойств генноинженерных штаммов.

150 |
ПИВОВАРЕННАЯ ИНЖЕНЕРИЯ |
|
|
Еще одним перспективным направлением развития систем для получения чистой культуры дрожжей является создание биомембранных систем, сочетающих в себе пре имущества и особенности биологических и мембранных процессов. Благодаря каче ственно новым системным свойствам биомембранные системы обладают также и но выми технологическими возможностями. Их функционирование максимально при ближается по своей сущности и эффективности к естественным процессам жизнедея тельности, протекающим в живой природе.
В биомембранных системах переработка субстрата и образование биомассы дрожжей сопровождается непрерывным выделением из культуральной жидкости через селектив ные мембраны образующихся продуктов метаболизма, смещая при этом динамическое равновесие системы в сторону образования биомассы и тем самым существенно повышая (иногда в десятки раз!) продуктивность процесса. В биомембранных системах возможно культивирование популяции дрожжей с очень высокой плотностью — около 100 г/л.
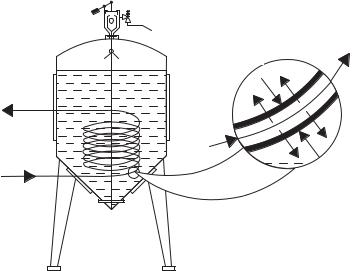
Принципиальное устройство биомембранной системы для культивирования мик роорганизмов показано на рис. 3.20. Устройства биореактора для аэрирования и тер мостабилизации культуры дрожжей на схеме условно не показаны.
34
|
2 |
Продукты |
|
|
метаболизма |
Субстрат |
1 |
5 |
|
|
(сусло) |
Культура |
|
|
|
дрожжей |
Рис. 3.20. Принципиальное устройство биомембранной системы для культивирования микроорганизмов:
1 — насос для подпитки свежим субстратом; 2 — биореактор; 3 — дроссельный вентиль; 4 — мембранный аппарат; 5 — циркуляционный насос
Применение полупроницаемых мембран в биореакторах не ограничивается функцией отвода продуктов метаболизма. С их помощью могут быть реализованы принципиально
ДРОЖЖИ И ДРОЖЖЕВОЕ ХОЗЯЙСТВО ПИВОВАРЕННОГО ПРОИЗВОДСТВА |
151 |
|
|
новые высокоэффективные методы аэрации культуральной среды, во многом лишен ные недостатков, присущих, как известно, обычной барботажной аэрации культуры, следствием которой является:
•обильное пенообразование (несмотря на применение пеногасителей);
•невозможность использования вместимости биореактора более чем на 70% (ко эффициент заполнения обычно составляет 0,5–0,7);
•необходимость сложной многоступенчатой системы очистки и стерилизации воз духа на входе и очистки отработанной газовой смеси на выходе из биореактора.
Одно из технических решений мембранной аэрации основано на том, что мембрана выполняет функцию барботера — равномерно распределяет в нижней части реакцион ного пространства подаваемый в биореактор воздух, который, поднимаясь через слой культуральной жидкости, насыщает ее кислородом. Важной технологической особен ностью этого процесса является отсутствие пенообразования, которое можно объяс нить, по видимому, тем, что пузырьки воздуха, проникающие через мембрану, имеют очень маленький размер. Поэтому за время прохождения снизу вверх через слой куль туральной жидкости воздух практически полностью растворяется в ней, а кислород усваивается микроорганизмами. Благодаря более эффективному потреблению возду ха его расход может быть существенно снижен, что уменьшает эксплуатационные зат раты на аэрацию. Кроме того, производительность биореактора может быть увеличена за счет более полного использования вместимости биореактора, поскольку не требует ся свободное пространство над уровнем жидкости для пены.
Более совершенный способ мембранной аэрации основан на использовании диф фузионных непористых мембран, селективно проницаемых для газов, которые обеспе чивают не только подвод кислорода к культуральной жидкости, но и отвод из нее диоксида углерода, образующегося в процессе жизнедеятельности популяции. Таким образом, такие мембраны выполняют в биореакторе функцию искусственного легкого.
Вкачестве материала, применяемого для изготовления таких газообменных диф фузионных мембран, наиболее широко применяют силаксановые полимеры, обладаю щие высокой селективной проницаемостью по кислороду и диоксиду углерода, при чем для последнего она примерно в 5 раз выше. Это обстоятельство имеет особое зна чение при реализации мембранной аэрации для культивирования микроорганизмов.
Функционирование системы мембранной аэрации может быть пояснено на рис. 3.21, на котором показано принципиальное устройство биореактора, оснащенного га зообменными диффузионными мембранами. Чаще всего они представляют собой эла стичные трубки из силаксанового полимера, размещенные в реакционном простран стве в форме змеевика, навитого на жесткий каркас.
Впроцессе культивирования микроорганизмов неочищенный атмосферный воз дух продувается компрессором через газообменную трубку, погруженную в культу ральную жидкость. При этом вследствие различия концентраций газов в культураль ной жидкости и в воздухе, продуваемом в трубке, трансмембранный газообмен осуще ствляется следующим образом. Кислород, концентрация которого в прокачиваемой по трубке воздушной смеси всегда выше (21%), чем в культуральной среде, где он интен сивно потребляется микроорганизмами, диффундирует из трубки в реакционное простран ство биореактора, в то время как диоксид углерода диффундирует в противоположном
152 |
ПИВОВАРЕННАЯ ИНЖЕНЕРИЯ |
|
|
направлении — из культуральной среды в полость газообменной трубки, из которой с отработанной газовоздушной смесью выбрасывается в атмосферу. Это происходит потому, что концентрация диоксида углерода из за интенсивного дыхания культуры в ферментационной среде будет всегда выше, чем в газовоздушной среде, продувае мой по трубке. При этом подавление роста культуры повышенным содержанием диок сида углерода исключено, поскольку, как отмечалось выше, проницаемость мембраны по диоксиду углерода почти впятеро выше, а количество выделяемого в среду диокси да углерода пропорционально количеству потребляемого популяцией кислорода.
|
CO2 |
Воздух |
|
|
|
|
CO2 2 |
|
CO |
2 |
|
2 |
|
|
O |
|
|
2 |
|
|
Воздух |
|
|
Воздух |
|
|
|
|
CO2 |
Воздух |
|
O2 |
|
CO22 |
|
|
|
|
|
COO |
|
|
2 |
2 |
Рис. 3.21. Принципиальное устройство дрожжегенератора с системой мембранной аэрации
Расход прокачиваемого по газообменной трубке воздуха регулируют, как правило, в зависимости от показателя рН культуральной жидкости. При увеличении расхода воз духа трансмембранный перенос диоксида углерода из культуральной жидкости возраста ет и значение рН повышается, компенсируя тем самым его снижение в процессе культи вирования микроорганизмов.
Особого внимания заслуживает тот факт, что при использовании диффузионных га зообменных мембран не требуется применения относительно сложных многоступенча тых систем очистки и стерилизации воздуха перед подачей его в биореактор и при выпус ке отработанного воздуха в атмосферу. При этом стерильность процесса сохраняется, по скольку диффузионные мембраны не пористые и посторонняя микрофлора не может проникнуть через них внутрь биореактора и, наоборот, клетки, культивируемые в аппа рате, не могут проникнуть через мембрану наружу. Последнее обстоятельство также важно
ДРОЖЖИ И ДРОЖЖЕВОЕ ХОЗЯЙСТВО ПИВОВАРЕННОГО ПРОИЗВОДСТВА |
153 |
|
|
с точки зрения экологической безопасности биотехнологических производств, по скольку даже при использовании специальных систем очистки газовых выбросов из промышленных биореакторов число клеток может превышать 105 в 1 м3 воздуха.
Итак, культивирование микроорганизмов в биореакторе, снабженном системой мембранной аэрации на основе диффузионных газообменных мембран, позволяет:
•исключить системы очистки и стерилизации воздуха и газовых выбросов соот ветственно на входе и выходе биореактора, а следовательно, снизить затраты на оборудование и обслуживание;
•исключить пенообразование в процессе культивирования, а следовательно, ис ключить использование пеногасителей;
•повысить производительность биореактора почти на треть за счет увеличения его рабочей вместимости вплоть до 100%;
•повысить надежность асептики процесса;
•улучшить экологическую безопасность производства.
Недостатками мембранных систем для аэрации культуральных сред на основе диф фузионных мембран являются:
•обрастание их культурой в процессе эксплуатации;
•технические трудности при мойке и стерилизации между циклами культивиро вания;
•трудность масштабирования, поскольку развитие площади газообмена лимити руется внутренним пространством биореактора.
Уменьшение требуемой площади поверхности газообмена может быть обеспечено благодаря увеличению движущей силы трансмембранного массопереноса, которой является разность концентрации. Для этого через газообменные трубки продувают не атмосферный воздух, а воздух, обогащенный кислородом или даже чистый кислород.
Обогащение воздуха кислородом перед подачей в систему газообмена осуществляют, как правило, в газоразделительных мембранных аппаратах, которые в составе односту пенчатых установок позволяют получать воздух с контролируемым содержанием кисло рода от 21 до 36%, а при двухступенчатом мембранном разделении концентрация в возду хе может быть увеличена до 50%.
Контрольные вопросы для самопроверки
1.Каковы роль и техническое значение дрожжей в производстве пива?
2.Какие виды пивных дрожжей применяют в пивоварении?
3.Перечислите структурные элементы дрожжевой клетки и укажите их функциональное назначение.
4.Что входит в состав пивных дрожжей?
5.Охарактеризуйте обмен веществ дрожжевой клетки.
6.Сопоставьте особенности жизнедеятельности пивных дрожжей в аэробных и анаэробных условиях.
7.Что такое время генерации?
8.Что такое удельная скорость роста? От каких факторов она зависит?
9.Какой закономерностью описывается культивирование микроорганизмов в благоприятA ных условиях?
154 |
ПИВОВАРЕННАЯ ИНЖЕНЕРИЯ |
|
|
10.Какое влияние оказывает температура на развитие микроорганизмов? Приведите графиA ческую интерпретацию характера этого влияния.
11.Какое влияние оказывает значение рН на развитие микроорганизмов? Приведите графиA ческую интерпретацию характера этого влияния.
12.Какое влияние оказывает концентрация растворенного кислорода на развитие аэробных микроорганизмов? Приведите аналитическое выражение и графическую интерпретацию характера этого влияния.
13.Какое влияние оказывает концентрация лимитирующего субстрата на развитие микроорA ганизмов? Приведите аналитическое выражение и графическую интерпретацию характеA ра этого влияния.
14.Какое влияние оказывает концентрация метаболитов на развитие микроорганизмов? Приведите аналитическое выражение и графическую интерпретацию характера этого влияния.
15.Приведите основное уравнение микрокинетики роста микроорганизмов. Какой физичесA кий смысл имеют кинетические константы, входящие в это уравнение?
16.Охарактеризуйте кинетику развития микроорганизмов в биореакторе периодического действия.
17.Какими способами получают культуру дрожжей? Приведите критический анализ этих способов.
18.Какие основные требования предъявляют к современным системам для получения чистой культуры дрожжей?
19.Как устроены основные типы установок для получения чистой культуры дрожжей? Опишите их принцип действия.
20.Какие способы и оборудование применяют для стерилизации сусла в установках чистой культуры дрожжей?
21.Из каких основных конструктивных узлов состоит дрожжегенератор? Как он функционируA ет?
22.Каково принципиальное устройство аэратора дрожжей? Как он работает?
23.Сформулируйте основные тенденции развития систем для получения чистой культуры дрожжей.
