
Вьюник. Лекция № 12
.pdf
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Водневий зв‘язок
Водневий зв‘язок характерний для найбiльш ЕН елементiв: F, O, N, (Cl, S).
Водневий зв‘язок як особливий тип взаємодiї має складну природу внаслiдок значного внеску електростатичної i певною мiрою донорно-акцепторної взаємодiї.
Взагалi вважають, що Н-зв‘язок має електростатичне походження. Повний аналiз природи Н-зв‘язку вказує на 4-ри фактори в розумiнi Н-зв‘язку:
а електростатична взаємодiя(притягання); б поляризацiйнi ефекти;
в сили вiдштовхування на коротких вiдстаннях; г вандерваальсовi взаємодiї.
31/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Водневий зв‘язок
Утворення Н-зв‘язку зобов‘язано малому розмiру атома Н, вiдсутностi бiля ядра електронної оболонки. Усе це зумовлює його здiбнiсть глибоко упроваджуватися в електроннi оболонки сусiднього негативно поляризованого атома.
Особливiстю Н-зв‘язку є його направленiсть. Подiбно до ковалентного зв‘язку водневий характеризується насиченiстю. З урахуванням цього Н-зв‘язок утворюється немовби за рахунок побiчної валентностi.
Водневий зв‘язок дуже поширений i вiдiграє важливу роль у структурi багатьох неорганiчних та органiчних сполук.
Молекули фтороводню асоцiйованi в ланцюги за рахунок цього зв‘язку навiть у газоподiбному станi.
32/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Водневий зв‘язок
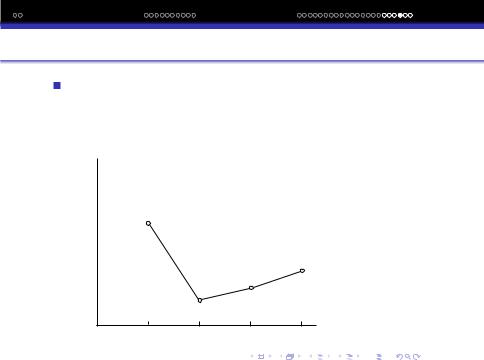
Н-зв‘язок зумовлює багато властивостей води. У зв‘язку з наявнiстю мiцних Н-зв‘язкiв i значних вандерваальсових сил мiж молекулами вода має аномально високi температури плавлення i кипiння.
tпл |
|
|
50 |
|
H2O |
|
||
0 |
|
|
|
H2Te |
|
|
||
-50 |
|
|
|
H2Se |
|
|
||
|
|
|
|
|
H2S |
-100
2 |
3 |
4 N періода |
33/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Водневий зв‘язок
Розрiзнюють мiжмолекулярний та внутрiшньомолекулярний Н-зв‘язок.
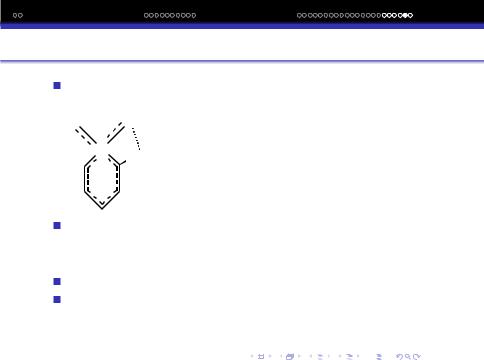
Н-зв‘язок приводить до утворення нових сполук, наприклад, NH3 · H2O-кристали утворюються при охолодженi розчину.
Мiжатомний водневий зв‘язок: [HF2]− [H···F···H]+. Водневий зв‘язок вiдiграє важливу роль в хiмiчних процесах,в живiй i неживiй природi. Вiн визначає структуру речовин i суттєво впливає на фiзичнi i хiмiчнi властивостi.
34/36

Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Водневий зв‘язок
Асоцiацiя спиртiв карбонових кислот i т.iнш. Димери карбонових кислот досить стiйкi i зберiгаються навiть у газоподiбному станi.
H |
|
+ |
H |
|
|
|
H |
|
H |
|
|
||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
H |
|
|
|
|
|
|
H |
|||
0 . 97Aº
º H

 º
º
1.07A 1.63A
В розчинниках з н-зв‘язком протон праявляє аномальну електричну провiднiсть, яка обумовлена специфiчним естафетним механiзмом переносу електрики.
35/36

Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
36/36
