
Вьюник. Лекция № 12
.pdf
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Теорiї металiчного зв‘язку
Зонна теорiя Фермi-Дiрака
2В енергетичнiй зонi металiв немає промiжку мiж заповненими й незаповненими МО, тому невелике зовнiшнє промотування (нагрiвання, освiтлення, опромiнення, створення рiзницi потенцiалiв i iнш.) спричиняє перемiщення e¯з валентної зони в зону провiдностi i виникнення електричного струму.
Отже, щоб отримати металiчну провiднiсть, уся суцiльна енергетична зона з МО має бути заповнена e¯ лише частково.
Ця умова виконується для s-елементiв 1-ої групи.
Для s-елементiв 2-ої групи уся s-зона заповнена електронами. Проте цi елементи у вiльному станi є Ме.
11/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Теорiї металiчного зв‘язку
Зонна теорiя Фермi-Дiрака
Це пояснюється тим, що в утворенi загальної енергетичної зони МО беруть участь вакантнi валентнi орбiталi (np0) атомiв.
За допомогою зонної теорiї можна пояснити також походження металiчного блиску.
Вважають,що e¯ металiчного кристала здатнi поглинати енергiю свiтла i переходити на вищi рiвнi в енергетичнiй зонi. Вiдразу ж пiсля цього вони випромiнюють енергiю i повертаються на стацiонарнi рiвнi.
12/36

Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Теорiї металiчного зв‘язку
Зонна теорiя Фермi-Дiрака
Наявнiсть великого числа надзвичайно близьких енергетичних рiвнiв приводить до того, що свiтло, яке потрапило на кристал, практично повнiстю вiдбивається. Крiм ЗМО та РМО утворюються ще i незв‘язуючi (НМО).
N=1 N=2 N=4 N=8 N=16 |
N=1023 |
13/36

Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Диполь-дипольна взаємодiя
Мiж незарядженими атомами i молекулами дiють сили притягання, природа яких не може бути пояснена на пiдставi уявлень про iонний, ковалентний або металiчний зв‘язок.
Неможливо пояснити, наприклад, якi сили зумовлюють зчеплення молекул F2 або Cl2 при утворенi рiдких або твердих фаз. Як вiдомо, цi сили малi. Наприклад, енергiя сублимацiї Cl2 складає десь бiля 20 -25 Кдж/моль. Вони були названi вандерваальсовими.
Ван-дер-Ваальс голандський фiзик, лауреат Нобелiв-
h
ської премiї, вивiв рiвняння стану реального газу P +
a
v2 (v − b) = RT].
14/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Диполь-дипольна взаємодiя
Вандервальсовi сили виникають без передачi атомами e¯. Виникнення цих сил пов‘язане з електростатичною взаємодiєю постiйних i наведених диполiв.
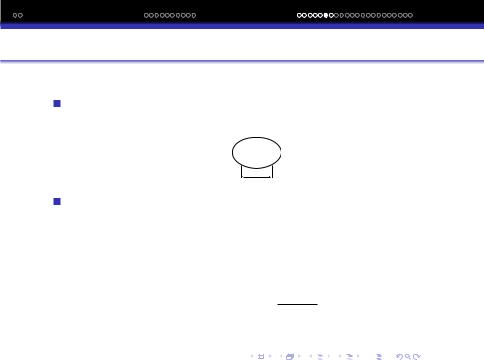
В залежностi вiд характеру розполiлу електронної густини молекули можуть бути полярними i неполярними.
Схематично зображують вiдповiдно овалом з просторово роздiленими зарядами i у виглядi кулi.
15/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Диполь-дипольна взаємодiя
Полярнi молекули є диполями, тобто системами, якi складаються iз двох рiвних за величиною i протилежних за знаком заряду (+q,−q) частин, розмiщених на вiдстанi l одна вiд одної.
Вiдстань мiж центрами тяжiння зарядiв +q, −q називається довжиною диполя.
Полярнiсть молекули i полярнiсть зв‘язку оцiнюється величиною електричного момента диполя (дипольного момента).
Дипольний момент дорiвнює добутку зосередженого на полюсах полярної молекули заряду, пропорцiйного заряду електрона 1.601 · 10−19 Кл, на вiдстань мiж ними µ = ql[Кл · м]; [1.601 ·10−19 ·10−10 = 1.601 ·10−29] Кл ·м.
1D = 0.333 ·10−29Кл ·м.
16/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Диполь-дипольна взаємодiя
Електричний момент диполя векторна величина. Напрям його умовно позначають вiд позитивного заряду до негативного.
Якщо молекула утворена бiльш нiж 2-а атомами, її полярнiсть зумовлюється не лише полярнiстю окремих зв‘язкiв, а й просторовою будовою молекули i визначається як векторна сума дипольних моментiв усiх зв‘язкiв i незв‘язуючих пар.
Молекули типу AB2 можуть мати лiнiйну (BeCl2, CO2), або кутову (H2O, SO2, O3) будову.
Навпаки, лiнiйнi молекули S−−C−−O, H−C−−N полярнi, бо зв‘язки у них мають рiзнi довжини й полярностi. Полярною є також молекула води, що зумовлено її кутовою будовою.
O−−C−−O, µCO2 = 0 , µH2O = 1.84D.
←−−−−→
17/36

Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Диполь-дипольна взаємодiя
Молекула представляє собою динамiчну систему, в якiй постiйно вiдбувається рух e¯ та коливання ядер. Отже розподiл заряду в нiй не може бути строго сталим.
Наприклад, молекули F2 та Cl2 належать до неполярних µ = 0. Проте, в кожний момент часу вiдбуваються тимчасовi змiщення зарядiв до одного iз атомiв Cl або F CL −→ CL CL ←− CL з утворенням миттєвих мiкродиполiв.
Оскiльки обидва змiщення рiвноймовiрнi, середнiй розподiл заряду вiдповiдає середньому нульовому значенню µ.
Постiйний та наведений (iндукцiйний) диполь. Якщо молекули мають постiйнi диполi, то зв‘язок мiж ними виникає за рахунок електростатичного притягання, наприклад, мiж молекулами HCl.
18/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Диполь-дипольна взаємодiя
Диполi, що взаємодiють, орiєнтуються один вiдносно одного протилежно зарядженими полюсами.
+ −
l
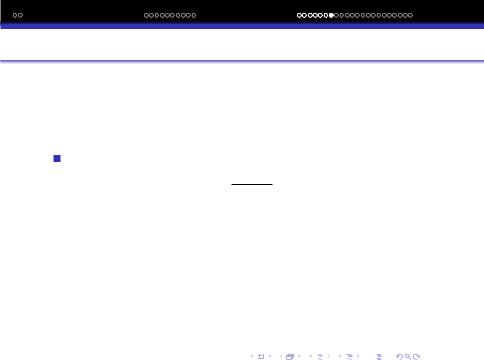
Така взаємодiя називається орiєнтацiйною або диполь – дипольною. Енергiя орiєнтацiйної взаємодiї залежить вiд величини дипольних моментiв молекул, вiдстанi мiж ними та температури.
Для однакових полярних молекул цю залежнiсть можна
представити рiвнянням Eор = − 2µ4 .
3kTr6
19/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Диполь-дипольна взаємодiя
У разi взаємодiї рiзних полярних молекул ця залежнiсть
2µ2µ2
набуває вигляду Eор = −3kTr1 26.
Знак ” −” означає, що результатом ММВ є притягання молекул, що спричинює зниження енергiї системи.
20/36
