
Вьюник. Лекция № 12
.pdf
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Iндукцiйна взаємодiя
Iндукцiйна взаємодiя. В багатьох випадках в молекулах виникають iндукованi диполi завдяки дiї (впливу) оточуючих молекул. Такi взаємодiї називаються iндукцiйними.
Вони роблять деякий внесок у ММВ. У випадку речовин з полярними молекулами iндукцiйна взаємодiя додається до орiєнтацiйної.
При взаємодiї ж полярних молекул з неполярними, останннi можуть поляризуватися електричним полем полярних. У неполярних молекулах виникають iндукованi дипольнi моменти. Мiж iндукованими i постiйними диполями виникає взаємодiя.
21/36

Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Iндукцiйна взаємодiя
Енергiя iндукцiйної взаємодiї посилюється з пiдвищенням здатностi молекул до поляризацiї i послаблюється зi зростанням вiдстанi мiж молекулами. Вона не залежить вiд температури.
Енергiю iндукцiйної взаємодiї можна обчислити за форму-
лою Eiнд = − |
2αµ2 |
, де α – поляризуємiсть молекул. |
||
r6 |
||||
|
|
|
||
|
|
+ − |
+ − |
|
22/36

Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Дисперсiйна взаємодiя
Дисперсiйна взаємодiя. Виникнення орiєнтацiйних та iндукцiйних сил притягання не дає пояснення конденсованому стану iнертних газiв, водню, хлору, кисню i т.iнш. Їх конденсацiя вказує на наявнiсть ММВ.
Для пояснення цього Лондон припустив, що крiм сил притягання, зумовленних взаємодiєю постiйних i iндукованих диполiв, iснують ще так званi дисперсiйнi сили, якi дiють незалежно вiд того чи iснують другi сили зчеплення.
Вони дiють мiж любими атомами i молекулами незалежно вiд їх будови.
Енергiю дисперсiйної взаємодiї можна приблизно оцiнити
за рiвнянням Eдисп = −3α2hν6 0, де ν0-нульова енергiя, ха-
4r
рактерна для кожного атома або молекули; hν0 ≈ I1.
23/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Дисперсiйна взаємодiя
Дисперсiйнi сили виникають внаслiдок синхронiзацiї тимчасових миттєвих диполiв взаємодiючих частинок. Миттєвi диполi виникають внаслiдок змiщення електронних оболонок, що перебувають у постiйному русi, вiдносно ядер.
Саме постiйний рух електронiв спричинює те, що перерозподiл зарядiв у молекулах стає несиметричним i в частинках виникають миттєвi диполi. Мiж миттєвими дiполями виникають сили притягання.
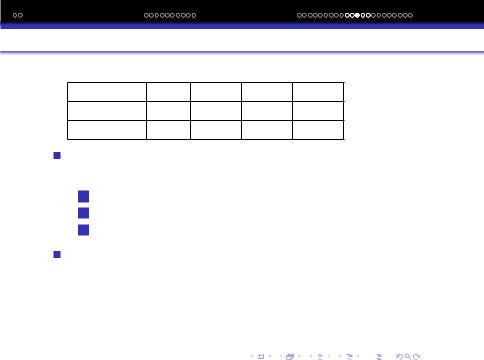
Дисперсiйна взаємодiя є унiверсальною. Якраз посиленням дисперсiйної взаємодiї можна пояснити пiдвищення Tпл та Tкип в ряду галогенiв (Табл).
24/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
|
Мiжмолекулярнi взаємодiї |
||
Мiжмолекулярнi взаємодiї |
|
|
|||
Молекула |
F2 |
Cl2 |
Br2 |
I2 |
|
|
Tпл,K |
53.2 |
172.2 |
266.0 |
386.8 |
Tкип,K |
85.0 |
239.1 |
333.0 |
457.5 |
|
Отже виникнення вандерваальсових сил визначається 3- |
|||||
ма факторами: |
|
|
|
||
1 |
взаємодiєю мiж постiйними диполями (Eор); |
||||
2 |
взаємодiєю мiж iндукованими i постiйними диполями (Eiнд); |
||||
3 |
взаємодiєю мiж миттєвими iндукованими диполями (Eдисп). |
||||
Грунтуючись на викладеному можна зробити висновок, що мiж полярними молекулами дiють три рiзновидностi вандерваальсової взаємодiї, а мiж неполярними тiльки дисперсiйна.
25/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Мiж полярними молекулами в деяких випадках взаємодiї зумовленi 2-ма iз цих чинникiв (табл.).
Речовина |
µ,D |
Eор |
Eiнд |
Eдисп |
Eсум,Кдж/моль |
Tкип,K |
H2 |
0 |
0 |
0 |
0.17 |
0.17 |
20.21 |
CO |
0.12 |
0 |
0.01 |
8.79 |
8.80 |
81 |
|
|
|
|
|
|
|
HCl |
1.03 |
3.34 |
1.00 |
16.72 |
21.05 |
188 |
|
|
|
|
|
|
|
NH3 |
1.5 |
13.28 |
1.55 |
14.72 |
29.55 |
239.6 |
H2O |
1.84 |
36,32 |
1.92 |
8.98 |
47.22 |
373 |
Таким чином, енергiя мiжмолекулярного притягання визначається алгебраїчною сумою: Eсум = Eор +Eiнд +Eдисп.
26/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
На малих вiдстаннях мiж молекулами, коли їхнi електроннi оболонки майже доторкуються одна одної, виникає сильне вiдштовхування.
Отже повну енергiю ММВ визначають алгебраїчною су-
мою енергiй притягання та вiдштовхування вiдповiдно до n m
рiвняння Eпов = Eпр + Eвiдшт = −r6 + r12, де n, m – сталi вiдповiдно називають коефiцiєнтом притягання та вiд-
штовхування.
27/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Донорно-акцепторна взаємодiя
Донорно-акцепторнi взаємодiї. Якщо одна iз молекул має вiльну електронну пару, а iнша вiльну орбiталь, то мiж ними можлива донорно-акцепторна взаємодiя.
Ця взаємодiя проявляється в первинних актах i перехiдних станах багатьох реакцiй, лежить в основi каталiтичних процесiв, обумовлює сольватацiю молекул i iонiв в розчинах.
В результатi донорно-акцепторної взаємодiї утворюються молекулярнi комплекси. Вони дуже рiзноманiтнi.
Механiзм їх утворення, склад залежать вiд типу орбiталей, якi приймають участь в донорно-акцепторнiй взаємодiї.
28/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Донорно-акцепторна взаємодiя
+ BF3 −−→ NH3·BF3 E = 167 кдж/моль
+ I2  I2
I2  C6H6 π розр.
C6H6 π розр.
орбіталь
π- ел.
В енергетичному вiдношенi молекулярнi комплекси рiзноманiтнi. E ≈ 6 −12 Кдж/моль; E ≈ 200 Кдж/моль.
29/36
Особливостi металiв |
Теорiї металiчного зв‘язку |
Мiжмолекулярнi взаємодiї |
Мiжмолекулярнi взаємодiї
Водневий зв‘язок
Водневий зв‘язок. Багаточисленi експериментальнi данi свiдчать про те, що атом гiдрогену здатний сполучатися одночасно з 2-ма iншими атомами, що входять до складу рiзних молекул або однiєї i тiєї ж молекули.
З одним iз атомiв (А) гiдроген зв‘язаний сильнiше (ковалентний зв‘язок), чим з другим (В).
Останнiй зв‘зок називається водневим (Н- зв‘язок). Його зображують трьома крапками. RA−H···BR1.
Якщо енергiя звичайного хiмiчного зв‘язку становить в середньому 200-400 Кдж/моль, то у випадку Н-зв‘язку вона складає 6-40 Кдж/моль.
Проте, його енергiя перевищує вандерваальсову енергiю приблизно в 10 раз.
30/36
