
- •Основные функции печени:
- •Этиология острой печеночной недостаточности
- •Клиническая картина острой печеночной недостаточности
- •Диагностика острой печеночной недостаточности
- •Печеночная энцефалопатия
- •Печеночная кома
- •Почечная недостаточность
- •Дыхательная недостаточность.
- •Кардиоваскулярные расстройства
- •Нарушение кислотно-основного состояния и водно-электролитного баланса.
- •Коагулопатии и кровотечения.
- •Панкреатит
- •Портальная гипертензия
- •Асцит и печеночный гидроторакс.
- •Спонтанный бактериальный перитонит.
- •Лабораторная диагностика
- •Трансплантация печени
- •Терапия мезенхимальными стволовыми клетками
- •Молекулярная адсорбирующая рециркулирующая система
- •Физиология почек: клубочковая фильтрация
- •Физиология почек: канальцевая реабсорбция
- •Регуляция почечного кровотока.
- •Процесс мочевыделения
- •Преренальная форма острой почечной недостаточности, возникающая в результате нарушений водно-электролигного баланса.
- •Медикаментозная преренальная форма острой почечной недостаточности.
Острая почечная и печеночная недостаточность
Анатомо-физиологические особенности печени
Масса печени составляет 1,5—2 кг. Она делится на правую и левую доли. При этом правая доля имеет большие размеры, чем левая. Печень получает 1,5 л крови в 1 мин, что составляет около 25 % объема сердечного выброса, и использует лишь 20 % кислорода от его общего количества, потребляемого организмом.
Печень имеет двойную систему кровообращения: через воротную вену и общую печеночную артерию. Печеночная артерия является сосудом высокого давления и имеет высокое периферическое сопротивление. Воротная печеночная вена не имеет клапанного аппарата. Печеночный кровоток регулируется симпатической частью автономной нервной системы. Гиперсимпатикотония сопровождается уменьшением интенсивности кровотока в печени. В результате этого при шоке и других состояниях, сопровождающихся повышением тонуса симпатической части автономной нервной системы, кровь сосудов печени является резервом для пополнения объема циркулирующей крови.
Печень состоит из стромы и паренхимы. Паренхима образована железистыми клетками-гепатоцитами. Основной функционально-морфологической единицей печени является печеночная долька (схема 6).
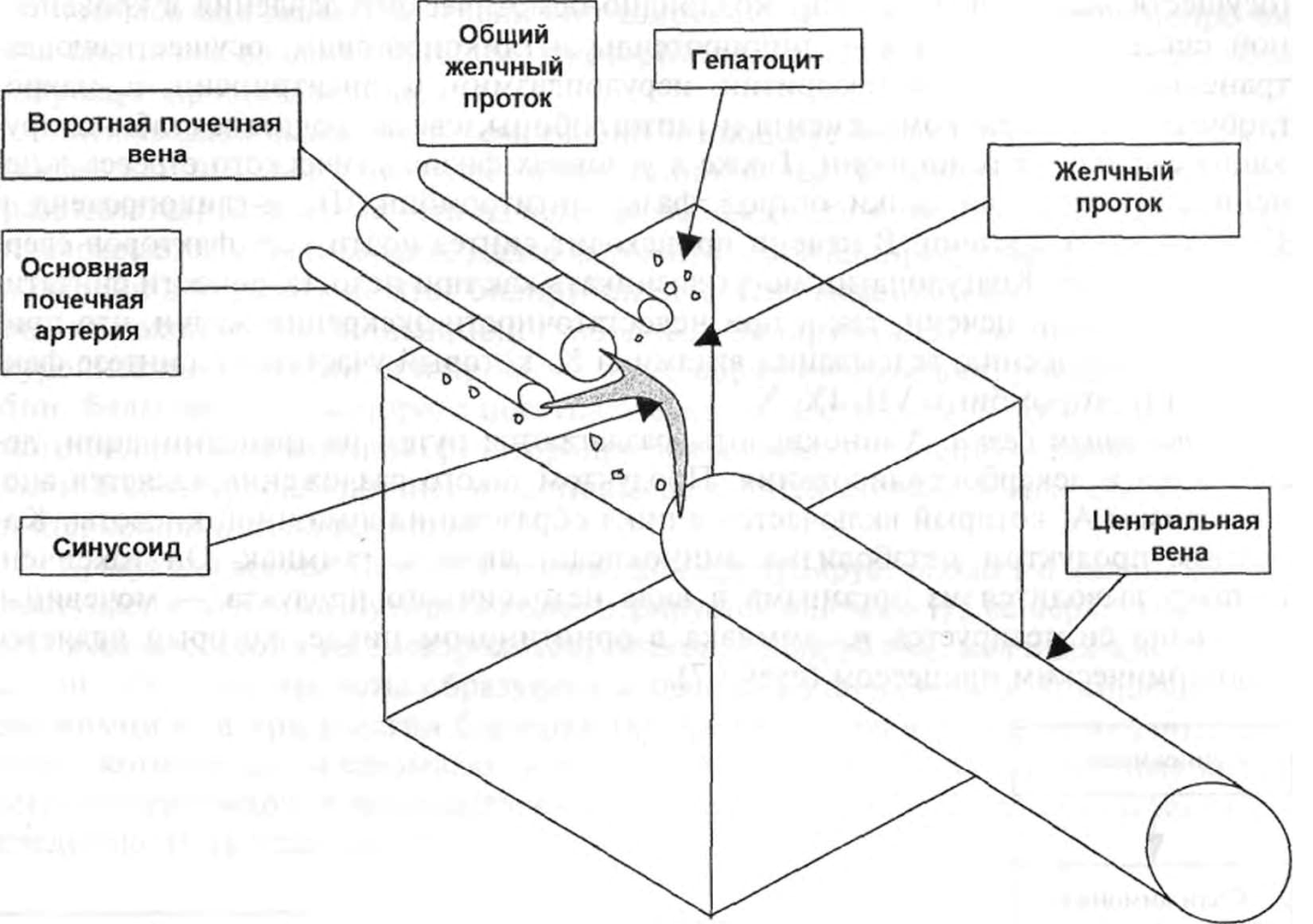
Печеночные дольки соединяются между собой стромой. В печеночной дольке условно выделяют центральную, промежуточную и периферическую зоны. Между дольками расположена портальная триада, которую образуют междольковые желчевыводящие протоки, междольковые артерии и вены (относящиеся к системе воротной печеночной вены). Радиальные пространства между гепатоцитами называются синусоидами. Они направляют смешанную кровь из общей печеночной артерии и воротной печеночной вены к центру дольки, откуда она дренируется в центральные вены. Центральные вены объединяются между собой и формируют печеночные вены, впадающие в нижнюю полую вену.
Гепатоциты представляют собой железистые клетки печени размером 18— 40 мкм. Их размеры могут изменяться в течение суток в зависимости от степени наполнения сосудистого русла кровью и интенсивности процессов обмена. Гепатоциты периферических отделов печеночных долек выполняют функцию депонирования и принимают участие в процессах детоксикации. В гепатоцитах центральных отделов печени осуществляются процессы метаболизма и экскреции в желчные протоки веществ экзо- и эндогенного происхождения.
Каждая клетка печени участвует в образовании нескольких желчных канальцев. В билиарном отделе гепатоцитов происходит экскреция веществ в желчные протоки. Более 10 % массы печени составляют звездчатые ретикулоэндотелиоциты (так называемые клетки Купффера). Биотрансформация лекарственных средств, токсинов и продуктов обмена происходит в гладком эндоплазматическом ретикулуме гепатоцитов независимо от их локализации в дольке. Процесс выведения желчи нарушается при повреждении гепатоцитов и развитии паренхиматозного гепатита, который приводит к желтухе. Непосредственное повреждение структурных элементов печени (на уровне генетического аппарата, за счет гипоксии, нарушения кровообращения, интоксикации, гнойно-септических заболеваний, инфекций, нарушения проходимости желчных проток) предопределяет развитие заболеваний печени и острой печеночной недостаточности.
Основные функции печени
Основные функции печени:
Метаболизм углеводов, белков и жиров.
Нейтрализация лекарственных препаратов и токсинов.
Депо гликогена, витаминов А, Б, С, Е, а также железа и меди.
Резервуар для крови.
Фильтрация бактерий, деградация эндотоксинов, метаболизм лактата.
Экскреция желчи и мочевины.
Иммунологическая функция с синтезом иммуноглобулинов и фагоцитарная активность за счет клеток Купффера.
Гемопоэз у плода.
Метаболизм белков. Печень играет главную роль в метаболизме и анаболизме белков, удаляет аминокислоты из крови для последующего их участия в процессах глюконеогенеза и синтеза белков, а также выделяет аминокислоты в кровь для использования их периферическими клетками. Поэтому печень имеет большое значение в процессах утилизации аминокислот и удалении из организма азота в виде мочевины. Она синтезирует такие важные белки, как альбумины (осуществляющих поддержание коллоидно-осмотического давления в кровеносной системе), глобулины — липопротеиды и гликопротеиды, осуществляющие транспортную функцию (ферритин, церулоплазмин, а1-антитрипсин, a2-макроглобулин), факторы комплемента и гаптоглобины, связывающие и стабилизирующие свободный гемоглобин. Также в условиях физиологического стресса в печени синтезируются белки острой фазы: антитромбин III, а-гликопротеид и С-реактивный протеин. В печени происходит синтез почти всех факторов свертывания крови. Коагулопатии могут возникать как при недостаточности синтетической функции печени, так и при недостаточности экскреции желчи, что приводит к уменьшению всасывания витамина К, который участвует в синтезе факторов II (протромбин), VII, IX, X.
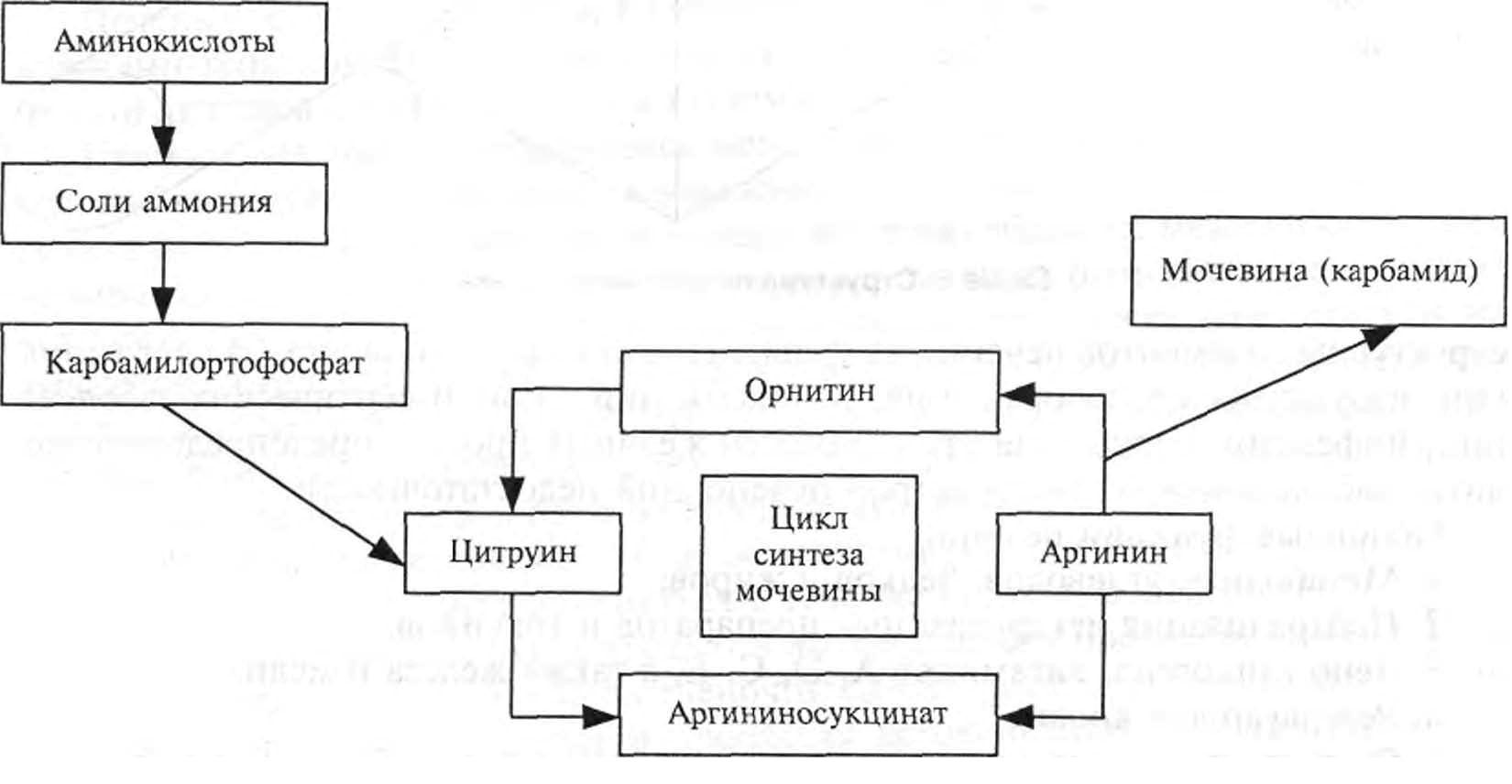
Катаболизм белка. Аминокислоты разлагаются путем их трансаминации, де-аминации и декарбоксилирования. Продуктом такого разложения является ацетилкоэнзим А, который включается в цикл образования лимонной кислоты. Конечным продуктом метаболизма аминокислот является аммиак. Он токсичен, поэтому выводится из организма в виде нетоксичного продукта — мочевины. Мочевина синтезируется из аммиака в орнитиновом цикле, который является эндотермическим процессом (схема 7).
 Креатинин
также синтезируется в печени из метионина,
глицина и аргинина. Фосфокреатинин,
который синтезируется в мышцах, служит
источником энергии для синтеза АТФ.
Креатинин образуется из фосфокреатинина
и выводится с мочой.
Креатинин
также синтезируется в печени из метионина,
глицина и аргинина. Фосфокреатинин,
который синтезируется в мышцах, служит
источником энергии для синтеза АТФ.
Креатинин образуется из фосфокреатинина
и выводится с мочой.
При голодании печень поддерживает гомеостаз глюкозы посредством глюконеогенеза и продукции кетоновых тел. Также выполняет функцию депо гликогена. В ней происходит гликогенолиз и глюконеогенез, когда запасы гликогена истощаются.
Метаболизм жиров. В печени синтезируются жирные кислоты и липопротеиды, она также является органом, в котором происходит синтез эндогенного холестерола и простагландина.
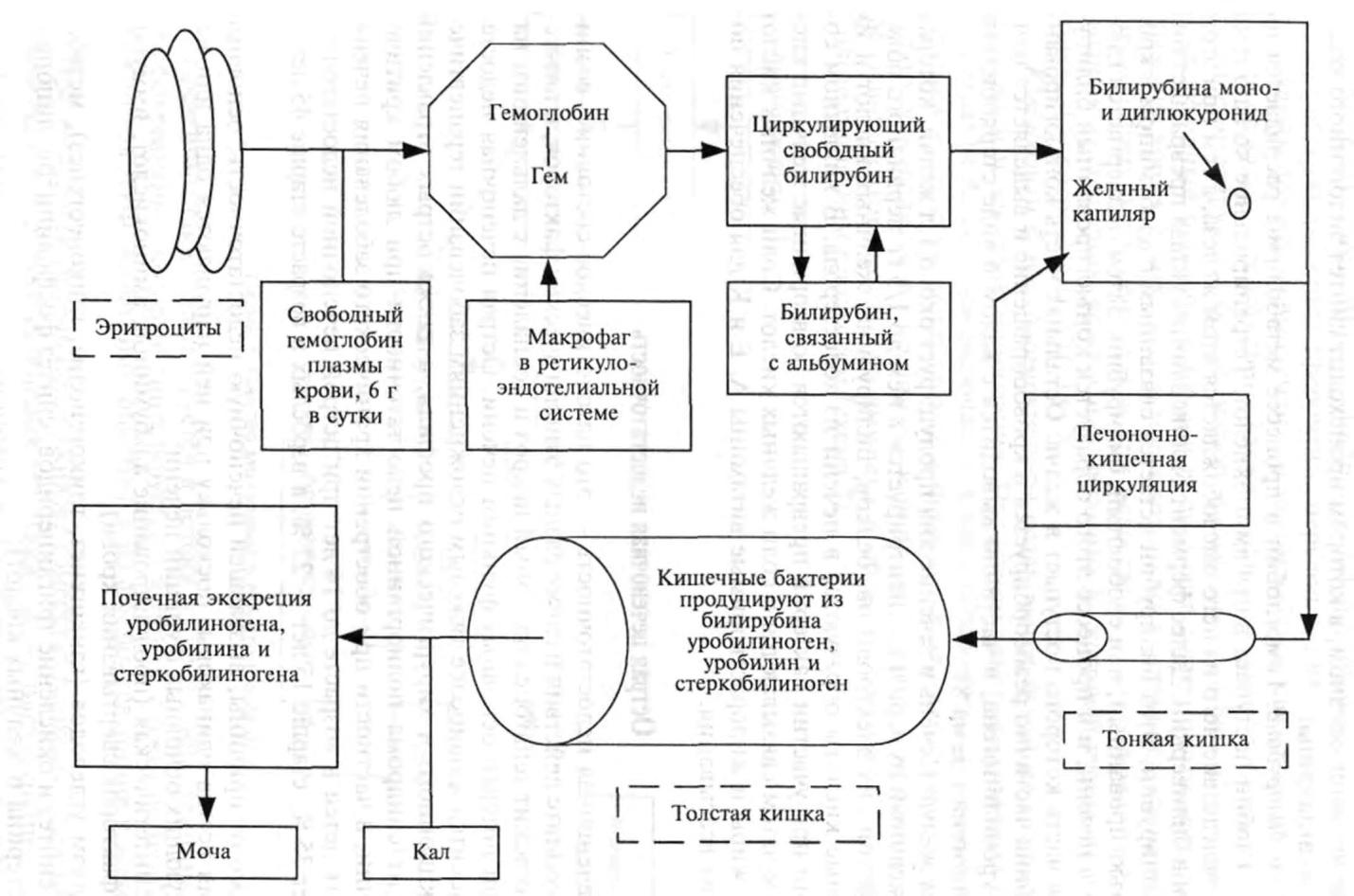
Метаболизм билирубина. Гемоглобин в процессе метаболизма распадается на гем и глобин. Глобин поступает в пул аминокислот. Тетрапирольное кольцо гема разрывается, вследствие чего из него высвобождается атом железа, а гем при этом превращается в биливердин. Далее фермент биливердинредуктаза превращает биливердин в билирубин. Этот билирубин остается связанным с альбумином в крови как неконъюгированный, или свободный, билирубин. Затем подвергается глюкуронизации в печени, и в процессе этого образуется конъюгированный билирубин, большая часть которого поступает в желчь. Остальная часть конъюгированного билирубина частично реабсорбируется в кровообращение и выделяется почками в виде уробилиногена, и частично выводится с калом в виде стеркобилина и стеркобилиногена (схема 8).
Продукция желчи. Печень в течение дня продуцирует около 1 л желчи, которая поступает в желчный пузырь и концентрируется в нем до 1/5 ее первичного объема. Желчь состоит из электролитов, белков, билирубина, желчных кислот и их солей. Желчные кислоты образуются в печени из холестерола. В кишечном содержимом они при участии бактерий превращаются во вторичные желчные кислоты, которые затем связываются в соли желчных кислот. Соли желчных кислот эмульгируют жиры и жирорастворимые витамины А, Е и К для обеспечения последующего их всасывания.
Острая печеночная недостаточность
Острая печеночная недостаточность — это патологическое состояние, возникающее в результате действия разнообразных этиологических факторов, в патогенезе которого лежит гепатоцеллюлярный некроз и воспаление с дальнейшим нарушением или потерей основных функций печени. Острая печеночная недостаточность относится к наиболее тяжелым осложнениям заболеваний терапевтического, инфекционного и хирургического профиля, а также острых отравлений как компонент синдрома полиорганной недостаточности при любом критическом состоянии, в частности при обострении хронического заболевания печени. Выживаемость детей в возрасте до 14 лет при острой печеночной недостаточности составляет 35%, старше 15 лет — 22%, а взрослых в возрасте старше 45 лет — 5%.
Независимо от причины, вызвавшей печеночную недостаточность, основные ее проявления всегда одинаковы, поскольку при ней нарушаются одна или несколько следующих основных функций печени:
1) белок-синтетическая (продуцирование альбуминов, аминокислот, иммуноглобулинов, факторов свертывания крови);
2) метаболизм углеводов (гликогенез, гликогенолиз, гликонеогенез) и жиров (синтез и окисление триглицеридов, синтез фосфолипидов, липопротеидов, холестерина и желчных кислот);
3) детоксицирующая (обезвреживание аммиака, токсинов и лекарственных веществ);
4) поддержание кислотно-основного состояния в организме путем метаболизма лактата и пигментный обмен (синтез билирубина, конъюгация и экскреция его в желчь);
5) обмен биологически активных вешеств (гормонов, биогенных аминов), витаминов (А, D, Е, К) и микроэлементов.
В зависимости от времени возникновения симптомов различают:
молниеносную форму печеночной недостаточности (основные ее симптомы недостаточности развиваются не менее чем за 4 нед. до ее полного клинического проявления);
острую печеночную недостаточность (формируется на фоне различных заболеваний печени и желчных путей в течение 1—6 мес.);
хроническую печеночную недостаточность (развивается постепенно в результате перенесенных острых и хронических заболеваний печени или печеночных ходов в течение более 6 мес.).
Острая печеночная недостаточность возникает при поражении 75—80% паренхимы печени.
Выделяют три вида острой печеночной недостаточности:
1) острая печеночно-клеточная (гепатоцеллюлярная) недостаточность, в основе которой лежат нарушения функции гепатоцитов и дренажной функции билиарной системы;
2) острая портокавальная («шунтовая») недостаточность, возникающая вследствие портальной гипертензии;
3) смешанная острая печеночная недостаточность.
