
- •Екатеринбург
- •Содержание
- •1. Основные закономерности
- •1.1. Основные понятия
- •1.2. Энтальпия химических реакций
- •1.3. Закон Гесса. Следствие закона Гесса
- •1.4. Энтропия
- •1.5. Возможность самопроизвольного прохождения химических реакций. Энергия Гиббса
- •1.6. Скорость химических реакций
- •1.7. Химическое равновесие
- •Выражение константы равновесия имеет вид
- •1.8.. Принцип Ле Шателье
- •2. Электронное строение атомов и молекул
- •2.1. Квантово-механическая модель электронного строения атома
- •2.2. Основные закономерности распределения электронов в атомах
- •2.3. Электронные формулы атомов. Периодическая система д.И.Менделеева
- •3. Основные классы неорганических соединений: оксиды, гидроксиды, соли.
- •3.1. Оксиды, гидроксиды, соли
- •3.2. Некоторые свойства неорганических соединений Свойства оксидов и гидроксидов
- •Свойства солей
- •4.1. Основные понятия
- •4.2. Растворы электролитов. Электролитическая диссоциация
- •4.3. Ионные реакции в растворах электролитов
- •4.4. Диссоциация воды. Водородный показатель
- •4.5. Гидролиз солей
- •Гидролиз солей слабых кислот и сильных оснований. Гидролиз NaNo2.
- •Гидролиз солей слабых оснований и сильных кислот.
- •Гидролиз солей слабых оснований и слабых кислот.
- •Совместный гидролиз солей.
1.7. Химическое равновесие
В природе существуют реакции практически необратимые (идущие в одном направлении) и обратимые реакции (идущие в прямом и обратном направлениях). Пример необратимой реакции: 2KClO3 = 2KCl + 3O2, обратимой реакции: 2SO2 + O2 Û 2SO3. Большинство реакций обратимы, в уравнениях таких реакций ставят знак обратимости (стрелки в двух направлениях Û).
Если в какой-либо замкнутой системе может идти обратимая реакция, то наступит такой момент, когда скорости прямой и обратной реакций станут одинаковыми.
Состояние системы, характеризующееся равными скоростями прямой и обратной реакций, называют состоянием химического равновесия.
Химическое
равновесие имеет динамический характер.
Это означает, что количество любого
вещества, расходующегося в ходе прямой
реакции, равно его количеству, образующемуся
в результате обратной реакции. В условиях
химического равновесия концентрации
всех веществ в системе не изменяются
со временем, их называют равновесными
концентрациями.
Равновесные концентрации обозначают
символом вещества в квадратных скобках:
![]() .
.
Рассмотрим
состояние химического равновесия в
системе H2
+ I2
Û
2HI
при 450 0С,
когда иод находится в парообразном
состоянии. Реакцию, идущую слева направо,
называют прямой, а справа налево -
обратной. При химическом равновесии
скорость прямой реакции равна скорости
обратной реакции:
![]() .
Кинетические уравнения для прямой и
обратной реакций в данной системе
согласуются с законом действующих масс,
следовательно,
.
Кинетические уравнения для прямой и
обратной реакций в данной системе
согласуются с законом действующих масс,
следовательно,
![]() .
.
После преобразования получим:
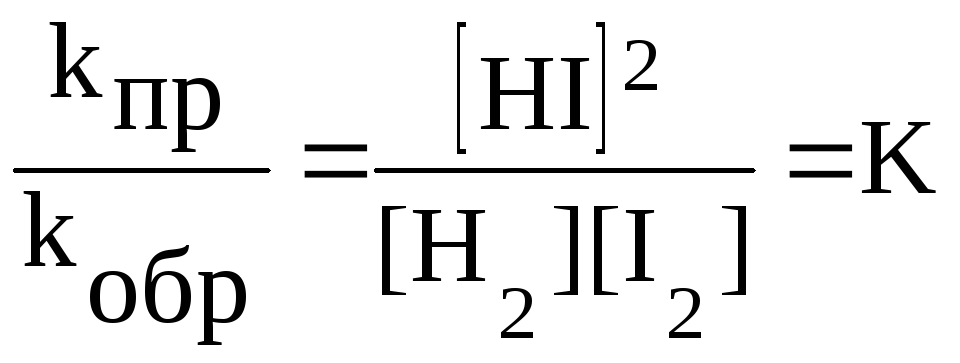 .
.
Постоянную
величину
![]() называют константой химического
равновесия. Она зависит от природы
реагирующих веществ и температуры,
но не зависит от концентраций веществ.
В общем виде для системы
называют константой химического
равновесия. Она зависит от природы
реагирующих веществ и температуры,
но не зависит от концентраций веществ.
В общем виде для системы
aA + bB Û cC + dD
Выражение константы равновесия имеет вид
![]() .
.
Особенность записи выражения константы равновесия для гетерогенных равновесий заключается в том, что концентрации твёрдых веществ считают неизменными, условно равными единице, и в уравнение для константы равновесия не включают.
Так, для реакции
MgCO3(Т) Û MgO(Т) + CO2(Г)
![]() .
.
Константа равновесия – важнейшая характеристика обратимых химических реакций. Чем больше значение константы равновесия, тем больше концентрации продуктов реакции, тем с большей полнотой проходит прямая реакция.
1.8.. Принцип Ле Шателье
Если на систему не оказывать внешнего воздействия, то состояние равновесия будет сохраняться как угодно долго. При изменении внешних условий равновесие может быть нарушено, однако через некоторое время установится новое состояние равновесия, характеризующееся новыми равновесными концентрациями. Переход от одного состояния химического равновесия к другому называют смещением равновесия. Направление смещения определяется принципом Ле Шателье:
если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то равновесие сместится в направлении реакции, уменьшающей это воздействие.
Влияние концентраций компонентов системы. При увеличении концентрации какого-либо из веществ увеличится скорость реакции, расходующей это вещество, следовательно, равновесие смещается в сторону этой реакции. При уменьшении концентрации вещества равновесие сместится в сторону реакции
образования этого вещества. Если, например, в системе
CH4(Г)
+ 2H2O(Г)
Û
CO2(Г)
+ 4H2(Г),
![]() >0,
>0,
увеличить концентрацию метана CH4 или паров воды, это приведёт к смещению равновесия вправо. Если увеличить концентрацию диоксида углерода, равновесие сместится влево.
Влияние общего давления в системе. При увеличении давления равновесие смещается в сторону реакции, идущей с образованием меньшего количества газообразных веществ, при уменьшении давления - в сторону реакции, идущей с образованием большего количества газообразных веществ. Для рассматриваемой системы увеличение давления смещает равновесие влево, уменьшение давления – вправо (слева 3 моль газов, справа – 5).
Влияние температуры. При повышении температуры равновесие смещается в сторону эндотермической (DН > 0) реакции, т.е. в сторону поглощения тепла, при понижении температуры - в сторону экзотермической (DН< 0) реакции. В рассматриваемой системе нагревание приведёт к смещению равновесия вправо, охлаждение – влево (если прямая реакция эндотермическая, обратная – экзотермическая).
