
- •Составители:
- •Т.Б.Мошкова, доц., канд. С.-х. Наук
- •Общие методические указания
- •Обязательный минимум содержания дисциплины
- •Специальные вопросы химии
- •Контрольное задание 1
- •Моль. Эквиваленты и молярные массы
- •Эквивалентов простых и сложных веществ
- •Закон эквивалентов
- •Строение атома
- •Периодическая система элементов д.И.Менделеева
- •Химическая связь и строение молекул
- •Элементы химической термодинамики Энергетика химических процессов
- •Кинетика химических процессов Химическое равновесие
- •Способы выражения концентрации растворов
- •Общие свойства растворов
- •Электролитическая диссоциация Реакции в растворах электролитов
- •Гидролиз солей
- •Контрольное задание 2 Окислительно-восстановительные реакции
- •Электродные потенциалы и электродвижущие силы
- •Электролиз расплавов и растворов
- •Коррозия металлов
- •Комплексные соединения
- •Жесткость воды и методы ее устранения
- •Органические соединения Полимеры
- •Химические элементы Их соединения и аналитические реакции
- •Теоретические основы аналитической химии
- •Задания
- •Качественный анализ
- •Количественный анализ
- •Задания
- •Органические соединения
Количественный анализ
Задача этого раздела аналитической химии – определение количественного содержания отдельных элементов в соединениях (или отдельных веществ в смесях). С помощью количественного анализа находят массовые соотношения между элементами в соединениях, определяют количество растворенного вещества в определенном объеме раствора, иногда узнают процентное содержание какого-нибудь элемента в однородной смеси веществ.
В сельскохозяйственной практике чаще всего определяют содержание того или иного компонента в неоднородных веществах; например: азота, оксида фосфора (V) или оксида калия – в азотных, фосфорных или калийных удобрениях, микроэлементов - в почве, сахаров – в растительном материале. Количественный анализ имеет большое значение для биологии и агрохимии, почвоведения, физиологии растений.
Пример 1. На титрование 22 мл раствора гидроксида натрия
(Т![]() = 0,004254 г/мл) израсходовано 23,44 мл раствора
хлороводородной кислоты. Вычислите
титр раствора и молярную концентрацию
эквивалентов кислоты.
= 0,004254 г/мл) израсходовано 23,44 мл раствора
хлороводородной кислоты. Вычислите
титр раствора и молярную концентрацию
эквивалентов кислоты.
Решение. Находим молярную концентрацию эквивалентов гидроксида натрия в растворе по формуле:
![]() н.,
н.,
где
М![]() =
=![]() г/моль.
г/моль.
Так
как затрачиваемые на титрование объемы
растворов обратно пропорциональны их
молярным концентрациям эквивалентов
веществ, следовательно
![]() ,
отсюда
,
отсюда
![]()
Титр раствора хлороводородной кислоты
![]()
где
Мэ(НСl)
=![]() г/моль.
г/моль.
Пример 2. На титрование 0,4080 г карбоната калия затрачено 40,60мл раствора серной кислоты. Вычислите титр раствора и молярную концентрацию эквивалентов серной кислоты.
Решение.
По закону эквивалентов
![]() ;
;
отсюда
![]() .
.
Найдем молярные массы эквивалентов
![]()
![]()
Подставляем эти значения в формулу и находим
![]()
Такое количество кислоты содержится в 40,60 мл раствора, следовательно
![]()
Молярную концентрацию эквивалентов серной кислоты рассчитываем по формуле:
![]()
Пример 3. В 200 мл раствора содержится 0,6975 г сульфата железа(II). На титрование 20 мл этого раствора в присутствии серной кислоты израсходовано 22мл раствора перманганата калия. Рассчитайте молярную концентрацию эквивалентов и титр раствора перманганата калия.
Решение. При титровании раствора сульфата железа (II) раствором перманганата калия происходит следующая окислительно-восстановительная реакция
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
окислитель восстановитель
M

 n+7
+ 5ē = Mn+2
1 2 - восстановление
n+7
+ 5ē = Mn+2
1 2 - восстановление
5 x 2
Fe+2 - 1ē = Fe+3 5 10 - окисление
Находим
молярную концентрацию эквивалентов
сульфата железа (II) по формуле
![]() ,
где
,
где

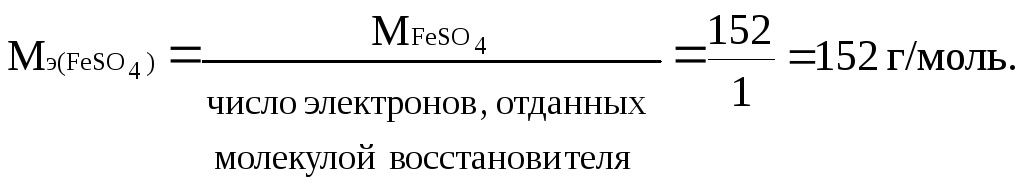
Следовательно,
молярная концентрация эквивалентов
сульфата железа(II) равна
![]()
Исходя
из соотношения:
![]() вычисляем молярную концентрацию
эквивалентов перманганата калия
вычисляем молярную концентрацию
эквивалентов перманганата калия
![]()
Титр раствора перманганата калия рассчитываем по формуле:
![]() ,
где
,
где

следовательно,![]()
Задания
531. В 0,5 л раствора содержится 1,25 г карбоната натрия. На титрование 25 мл раствора карбоната натрия было израсходовано 12 мл раствора серной кислоты. Рассчитайте титр раствора и молярную концентрацию эквивалентов серной кислоты.
532. Рассчитайте молярную концентрацию эквивалентов и титр раствора хлороводородной кислоты, если на нейтрализацию 0,1735г карбоната натрия затрачено 20,55 мл раствора хлороводородной кислоты.
533. На нейтрализацию 20 мл 0,2135н. раствора хлороводородной кислоты затрачено 15,35 мл раствора гидроксида натрия. Определите молярную концентрацию эквивалентов и титр раствора гидроксида натрия.
534. На титрование 25 мл 0,1250н. раствора гидроксида натрия израсходовано 26,05 мл раствора серной кислоты. Определите титр раствора и молярную концентрацию эквивалентов серной кислоты.
535. Сколько граммов гидроксида натрия содержится в растворе, если на его нейтрализацию было израсходовано 22,5 мл 0,5н. раствора серной кислоты?
536. На титрование 2,2120 г карбоната натрия израсходовано 20,4 мл раствора хлороводородной кислоты. Вычислите титр и молярную концентрацию эквивалентов раствора хлороводородной кислоты.
537. На титрование 0,2020 г карбоната натрия затрачено 20,25мл раствора серной кислоты. Определите титр и молярную концентрацию эквивалентов раствора серной кислоты.
538. На титрование 25 мл раствора карбоната натрия, титр которого равен 0,005315г/мл, затрачено 26,82 мл раствора хлороводородной кислоты. Определите титр и молярную концентрацию эквивалентов раствора кислоты.
539. В 200 мл раствора содержится 1,0602 г карбоната натрия. На титрование 20 мл этого раствора было израсходовано 19,02 мл раствора хлороводородной кислоты. Рассчитайте титр и молярную концентрацию эквивалентов раствора хлороводородной кислоты.
540. Титр раствора карбоната калия равен 0,005320 г/мл. На титрование 20,00 мл этого раствора израсходовано 21,20 мл раствора серной кислоты. Рассчитайте титр и молярную концентрацию эквивалентов раствора серной кислоты.
541. Титр раствора серной кислоты равен 0,004902 г/мл. На титрование 20,00 мл этого раствора израсходовано 20,40 мл раствора гидроксида натрия. Рассчитайте титр и молярную концентрацию эквивалентов раствора гидроксида натрия.
542. На титрование 20,00 мл раствора азотной кислоты затрачено 15,00 мл 0,12н. раствора гидроксида натрия. Вычислите молярную концентрацию эквивалентов, титр раствора кислоты и массу азотной кислоты в 250 мл раствора.
543. В 250 мл раствора содержится 1,6802 г оксалата натрия Na2C2O4. На титрование 20 мл этого раствора в присутствии серной кислоты израсходовано 21,22 мл раствора перманганата калия KMnO4. Вычислите титр и молярную концентрацию эквивалентов раствора перманганата калия.
544. Титр раствора оксалата натрия ТNa2C2O4 = 0,006780г/мл. На титрование 25 мл этого раствора в присутствии серной кислоты израсходовано 24,84 мл раствора KMnO4. Рассчитайте титр и молярную концентрацию эквивалентов раствора перманганата калия.
545. В 200 мл раствора содержится 1,3484 г оксалата натрия Na2C2O4. На титрование 25 мл этого раствора в присутствии серной кислоты израсходовано 24,02 мл раствора перманганата калия. Вычислите титр и молярную концентрацию эквивалентов раствора перманганата калия.
546. Сколько мл раствора гидроксида калия, титр которого равен 0,01111г/мл, потребуется для нейтрализации 25,00 мл раствора хлороводородной кислоты, имеющего титр 0,007777г/мл?
547. На титрование 20,00 мл 0,1025н. раствора оксалата натрия Na2C2O4 израсходовано в присутствии серной кислоты 19,20 мл раствора перманганата калия. Вычислите титр и молярную концентрацию эквивалентов раствора перманганата калия.
548. На титрование 25 мл 0,1202н. раствора хлороводородной кислоты израсходовано 24,80 мл раствора гидроксида натрия. Вычислите молярную концентрацию эквивалентов, титр раствора щелочи и массу гидроксида натрия в 200 мл этого раствора.
549. Какой объем 0,15н. раствора гидроксида натрия пойдет на титрование 21,00 мл раствора серной кислоты с титром 0,003810 г/мл? Вычислите титр раствора гидроксида натрия.
550. На титрование 25,00 мл раствора щавелевой кислоты H2C2O42H2O, полученного растворением 1,7334г ее в мерной колбе вместимостью 250 мл, израсходовано в присутствии серной кислоты
22,10 мл раствора перманганата калия. Вычислите титр и молярную концентрацию эквивалентов раствора перманганата калия.
