
- •Составители:
- •Т.Б.Мошкова, доц., канд. С.-х. Наук
- •Общие методические указания
- •Обязательный минимум содержания дисциплины
- •Специальные вопросы химии
- •Контрольное задание 1
- •Моль. Эквиваленты и молярные массы
- •Эквивалентов простых и сложных веществ
- •Закон эквивалентов
- •Строение атома
- •Периодическая система элементов д.И.Менделеева
- •Химическая связь и строение молекул
- •Элементы химической термодинамики Энергетика химических процессов
- •Кинетика химических процессов Химическое равновесие
- •Способы выражения концентрации растворов
- •Общие свойства растворов
- •Электролитическая диссоциация Реакции в растворах электролитов
- •Гидролиз солей
- •Контрольное задание 2 Окислительно-восстановительные реакции
- •Электродные потенциалы и электродвижущие силы
- •Электролиз расплавов и растворов
- •Коррозия металлов
- •Комплексные соединения
- •Жесткость воды и методы ее устранения
- •Органические соединения Полимеры
- •Химические элементы Их соединения и аналитические реакции
- •Теоретические основы аналитической химии
- •Задания
- •Качественный анализ
- •Количественный анализ
- •Задания
- •Органические соединения
Химическая связь и строение молекул
Под химической связью понимают различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических веществ. По своей природе химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронами друг с другом. Основные виды химической связи: ковалентная, ионная, металлическая. Для описания ковалентной связи используют два метода – метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
В основе метода ВС лежат следующие положения:
1.В образовании ковалентной связи участвуют только неспаренные электроны двух атомов с противоположно направленными спинами (обменный механизм образования связи), либо электронная пара одного атома

 - донора и свободная орбиталь другого
атома – акцептора (донорно-акцепторный
механизм).
- донора и свободная орбиталь другого
атома – акцептора (донорно-акцепторный
механизм).
2.Ковалентная химическая связь между двумя атомами возникает как результат перекрывания атомных орбиталей с образованием электронных пар (обобществление двух электронов).
Согласно теории валентных связей ковалентная связь направлена в сторону максимального перекрывания атомных орбиталей взаимодействующих атомов.
Геометрическая
(пространственная) структура молекулы,
состоящей из более чем двух атомов,
обусловлена взаимным расположением
атомных орбиталей, участвующих в
образовании химических связей. Молекула
АВ2может иметь линейную![]() ,
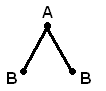
или угловую структуру (а). Молекула АВ3может иметь форму правильного треугольника
(б), тригональной пирамиды (в). Молекула
АВ4– форму тетраэдра (г).
,
или угловую структуру (а). Молекула АВ3может иметь форму правильного треугольника
(б), тригональной пирамиды (в). Молекула
АВ4– форму тетраэдра (г).
а)
 б)
б)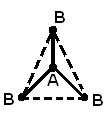 в)
в)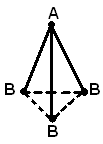 г)
г)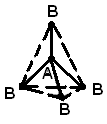
Пространственная структура молекулы определяется видом гибридизации валентных орбиталей центрального атома и числом неподеленных электронных пар, содержащихся в валентном электронном слое.
Пример 1.Опишите с позиций метода валентных связей строение молекул: а) РН3, б)BBr3. Какие атомные орбитали участвуют в образовании химических связей? Укажите тип гибридизации (если гибридизация имеет место). Какова пространственная структура этих молекул?
Решение.а) Образование молекулы РН3.
Напишем электронные формулы атомов, образующих молекулу PH3, в основном (нормальном) состоянии:15Р 1s22s22p63s23p3;1Н 1s1
Электронно-графические формулы внешнего уровня этих атомов:

 p
s
p
s

 s
1H1
s
1H1
15Р 3
В данной молекуле центральным атомом является атом фосфора, у которого в образовании трех химических связей участвуют только p– орбитали, расположенные на одном подуровне и обладающие одинаковой формой и одинаковой энергией. Следовательно, в молекуле РН3гибридизация отсутствует.
Для наглядного изображения валентных схем можно использовать следующий способ. Электроны, находящиеся на внешнем электронном слое, обозначают точками, располагаемыми вокруг химического символа атома. Общие для двух атомов электроны показывают точками, помещаемыми между их химическими символами; двойная или тройная связь обозначается соответственно двумя или тремя парами общих точек. Применяя эти обозначения, образование молекулы РН3можно представить так:
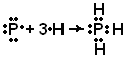 H
H
Эту схему можно записать иначе: Н – Р – Н, где каждая пара электронов, связывающая два атома, соответствует одной черточке, изображающей ковалентную связь в структурных формулах.
р – электронные облака атома фосфора ориентированы во взаимноперпендикулярных направлениях (вдоль осей координат) –рх, ру, рzи имеют гантелевидную форму. У атома водорода в образовании химической связи Р-Н участвуетs-электрон, имеющий сферическую форму облака. При образовании молекулы РН3происходит перекрывание р - электронных облаков атома фосфора сs-электронными облаками трех атомов водорода:

В соответствии с требованиями метода валентных связей три связи
Р - Н должны располагаться под углами, близкими к 90С. Следовательно, пространственное расположение одинарных связей определяет геометрическую структуру молекулы. Молекула РН3должна иметь форму тригональной пирамиды:

В вершине пирамиды находится атом фосфора, а в вершинах основания атомы водорода.
б) Образование молекулы ВВr3. В молекуле ВВr3центральным атомом является атом бора.
Электронные формулы атомов:
5В 1s22s22p135Br1s22s22p63s23p63d104s24p5
Электронно-графические формулы внешнего уровня имеют вид:
pp





 ss
ss

 5B2
5B2
 35Br4
35Br4


Поскольку бор в соединении трехвалентен, запишем электронно-графическую формулу атома бора в возбужденном состоянии:

 р
р
 s
s
5B* 2
В образовании трех химических связей в молекуле ВВr3участвуют однаs- и две р-орбитали, расположенные на разных подуровнях и обладающие разной формой и разной энергией:
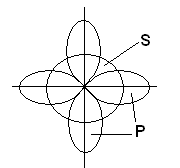
В этом случае вместо исходных одной s- и двухp-орбиталей возбужденного атома бора образуется три равноценные гибридные орбитали (sp2– гибридизация). Приsp2гибридизации гибридные электронные облака располагаются в направлениях, лежащих в одной плоскости и ориентированных под углами 120 друг к другу:

Этому типу гибридизации соответствует образование плоской треугольной молекулы. При образовании молекулы ВВr3происходит перекрывание трех гибридных орбиталей атома бора с р - электронными орбиталями трех атомов брома:
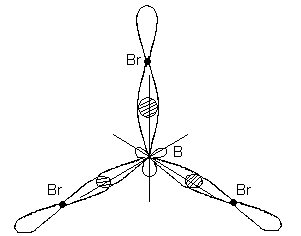
Молекула ВВr3имеет форму плоского правильного треугольника, в центре которого расположен атом бора, а в вершинах – атомы брома. Все три связи В-Brв молекуле ВВr3равноценны.
Пример 2.Нарисуйте энергетические схемы образования молекулыF2и молекулярного ионаF2+по методу молекулярных орбиталей. Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этих частицах? Укажите их магнитную характеристику (парамагнетизм или диамагнетизм).
Решение.Согласно теории молекулярных орбиталей (ММО) молекула рассматривается как совокупность положительно заряженных ядер и отрицательно заряженных электронов, где каждый электрон движется в поле остальных электронов и всех ядер.
Описать молекулу согласно теории ММО – это значит определить тип ее орбиталей, их энергии и выяснить характер распределения электронов по орбиталям.
При образовании молекулы возникают молекулярные орбитали двух видов – связывающие и разрыхляющие. Если при образовании молекулы из атомов переход электрона на молекулярную орбиталь будет сопровождаться уменьшением энергии, то такая молекулярная орбиталь является связывающей.Если переход электрона на молекулярную орбиталь сопровождается увеличением энергии, то такая молекулярная орбиталь будетразрыхляющей.
Электроны в молекулах располагаются на - и- молекулярных орбиталях.-орбитали могут быть образованы перекрываниемs– атомных орбиталей и перекрыванием 2рх- атомных орбиталей. При этом образуются молекулярные орбитали:-связывающие (св) и-разрыхляющие (разр). При перекрывании 2руи 2рzатомных орбиталей образуются молекулярные орбитали:св2Ру,св2Рzираз2Ру,раз2Рz. Порядок размещения электронов по молекулярным орбиталям тот же, что и в случае атомных орбиталей, то есть соответствует принципу наименьшей энергии, принципу Паули, правилу Хунда.
Энергетическая диаграмма АО атомов фтора и МО молекулы фтора.
Электронная формула атома фтора в нормальном состоянии:
9F1s22s22p5.
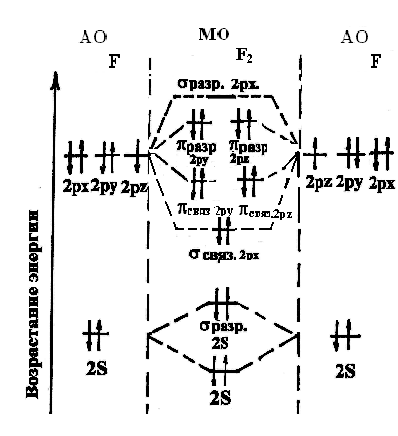
Электроны первого энергетического уровня не дают большого вклада в образование химических связей, поэтому учитываем электроны только внешнего (второго) уровня.
Электронные конфигурации атомов фтора и молекулы F2:
![]() ,
,
где КК – четыре 1s– электрона, практически не оказывающие влияния на химическую связь.
Порядок (кратность) связи =
![]() .
.
Так как 10, то образование молекулыF2возможно.
По энергетической диаграмме молекулы F2видно, что это соединение имеет только спаренные электроны, т.е. диамагнитно.
Энергетическая диаграмма АО атома F и иона F+ и МО молекулярного иона F2+.
Электронные формулы: 9F1s22s22p5;9F+1s22s22p4.
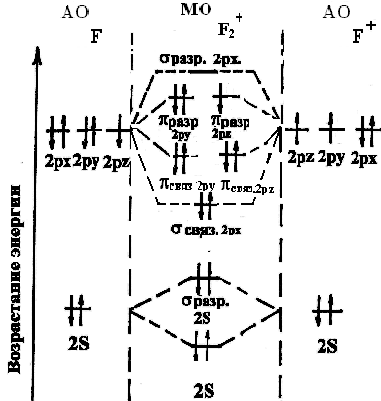
Электронная конфигурация молекулярного иона F2+:
![]() .
.
Порядок связи = (8-5)/2 = 1,5, т.к. 1,50, то образование ионаF2+возможно.
По энергетической диаграмме иона F2+видно, что данное соединение имеет один неспаренный электрон, т.е. обладает парамагнитными свойствами (втягивается в магнитное поле).
ЗАДАНИЯ
61.Какой способ образования ковалентной связи называется донорно-акцепторным? Покажите электронную структуру молекулы аммиака и объясните механизм образования катиона аммония NH4+. Укажите донор и акцептор.
62.Какая ковалентная связь называется -связью и какая-связью? Разберите на примере строения молекулы азота, хлороводорода, изображая перекрывание электронных облаков.
63.Дайте понятие неполярной и полярной ковалентной связи. Приведите примеры молекул с неполярной и полярной ковалентной связью. Что называется электрическим моментом диполя? Какая из молекул HCl,HBr,HIимеет наибольший момент диполя? Ответ мотивируйте, исходя из электроотрицательности соответствующих элементов.
64.Какая химическая связь называется водородной? Между молекулами каких веществ она образуется? Покажите схемы образования водородной связи при взаимодействии: а) двух молекул HF; б) между молекулами воды в структуре льда (твердая фаза воды). Почему Н2О по сравнению с ее аналогамиH2S-H2Se-H2Teплавится и кипит при более высокой температуре?
65.По разности электроотрицательностей соединяющихся атомов определите, какая из приведенных связей Cs-Cl,Ca-S,Ba-Fнаиболее приближается к ионной связи. Опишите свойства ионной связи. Чем объясняется склонность молекул с ионной связью к ассоциации? Какое строение имеет кристаллическая решетка ионных соединений в твердом состоянии?
66.Опишите с позиций метода валентных связей (ВС) строение молекул: ВеJ2иBF3. Какие атомные орбитали участвуют в образовании химических связей? Укажите тип гибридизации. Какова пространственная структура этих молекул?
67.Опишите с позиций метода валентных связей (ВС) строение молекул ВеCl2иSiH4. Какие атомные орбитали участвуют в образовании химических связей? Укажите тип гибридизации. Какова пространственная структура этих молекул?
68.Опишите с позиций метода валентных связей (ВС) строение молекул Н2О и ВеF2. Какие атомные орбитали участвуют в образовании химических связей? Укажите тип гибридизации. Какова пространственная структура этих молекул?
69.Опишите с позиций метода валентных связей (ВС) строение молекул СН4иHgCl2. Какие атомные орбитали участвуют в образовании химических связей? Укажите тип гибридизации. Какова пространственная структура этих молекул?
70.Нарисуйте энергетическую схему образования молекулы Не2и молекулярного иона Не2+по методу молекулярных орбиталей (МО). Как метод МО объясняет устойчивость иона Не2+и невозможность существования молекулы Не2?
71.Опишите с позиций метода валентных связей (ВС) строение молекул ВеН2иNF3. Какие атомные орбитали участвуют в образовании химических связей? Укажите тип гибридизации. Какова пространственная структура этих молекул?
72.Опишите с позиций метода валентных связей (ВС) строение молекул НgI2и ВCl3. Какие атомные орбитали участвуют в образовании химических связей? Укажите тип гибридизации. Какова пространственная структура этих молекул?
73.Опишите с позиций метода валентных связей (ВС) строение молекул Н2SиCCl4. Какие атомные орбитали участвуют в образовании химических связей? Укажите тип гибридизации (если гибридизация имеет место). Какова пространственная структура этих молекул?
74.Опишите с позиций метода валентных связей (ВС) строение молекул РCl3иSiCl4. Какие атомные орбитали участвуют в образовании химических связей? Укажите тип гибридизации (если гибридизация имеет место). Какова пространственная структура этих молекул?
75.Опишите с позиций метода валентных связей (ВС) строение молекул SiF4иNH3. Какие атомные орбитали участвуют в образовании химических связей? Укажите тип гибридизации (если гибридизация имеет место). Какова пространственная структура этих молекул?
76.Опишите с позиций метода валентных связей (ВС) строение молекулы Н2О. Объясните на примере молекулы Н2О, как влияет на величину валентного угла участие неподеленных электронных пар в образовании гибридных электронных облаков.
77.Нарисуйте энергетическую схему образования молекулы О2по методу молекулярных орбиталей. Определите порядок связи в этой молекуле. Как метод МО объясняет парамагнитные свойства молекулы кислорода.
78.Нарисуйте энергетическую схему образования молекулы N2по методу молекулярных орбиталей. Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле? Укажите магнитную характеристику молекулыN2(парамагнитизм или диамагнетизм).
79.Опишите с позиций метода валентных связей (ВС) строение молекул НBrиHgBr2. Какие атомные орбитали участвуют в образовании химических связей? Укажите тип гибридизации (если гибридизация имеет место). Какова пространственная структура этих молекул?
80.Опишите с позиций метода валентных связей (ВС) строение молекул NH3. Объясните на примере молекулы NH3, как влияют на величину валентного угла участие неподеленных электронных пар в образовании гибридных электронных облаков.
