
- •Составители:
- •Т.Б.Мошкова, доц., канд. С.-х. Наук
- •Общие методические указания
- •Обязательный минимум содержания дисциплины
- •Специальные вопросы химии
- •Контрольное задание 1
- •Моль. Эквиваленты и молярные массы
- •Эквивалентов простых и сложных веществ
- •Закон эквивалентов
- •Строение атома
- •Периодическая система элементов д.И.Менделеева
- •Химическая связь и строение молекул
- •Элементы химической термодинамики Энергетика химических процессов
- •Кинетика химических процессов Химическое равновесие
- •Способы выражения концентрации растворов
- •Общие свойства растворов
- •Электролитическая диссоциация Реакции в растворах электролитов
- •Гидролиз солей
- •Контрольное задание 2 Окислительно-восстановительные реакции
- •Электродные потенциалы и электродвижущие силы
- •Электролиз расплавов и растворов
- •Коррозия металлов
- •Комплексные соединения
- •Жесткость воды и методы ее устранения
- •Органические соединения Полимеры
- •Химические элементы Их соединения и аналитические реакции
- •Теоретические основы аналитической химии
- •Задания
- •Качественный анализ
- •Количественный анализ
- •Задания
- •Органические соединения
Кинетика химических процессов Химическое равновесие
Химическая кинетика изучает скорости химических реакций, механизмы их протекания и факторы, влияющие на скорость.
Гомогенные реакции протекают в однофазной системе и идут равномерно во всем объеме системы. Гетерогенные реакции протекают в многофазной системе на границе раздела фаз, где реагирующие вещества соприкасаются друг с другом.
Скорость химической реакции определяется количеством вещества вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции).
Пример 1.Напишите выражения скорости реакции для систем:
1. 2H2(г) + 2NO(г)=N2(г)+ 2Н2О(г)
2. 2PbS(к)+ 3O2(г)= 2PbO(к)+ 2SO2(г)
3. 2NH4NO3(к)= 2N2(г)+O2(г)+ 4H2O(г)
4. СS2(ж)+ 3O2(г)=CO2(г)+ 2SO2(г)
Решение.Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, в степенях равных стехиометрическим коэффициентам в уравнении реакции.
1. Реакция 1 - гомогенная, реагирующие вещества находятся в одной фазе – газообразной. Запишем выражение скорости прямой реакции:
![]()
где V– скорость реакции,k–
константа скорости реакции,![]() - концентрации реагирующих веществ, 2,2
– стехиометрические коэффициенты в
уравнении реакции.
- концентрации реагирующих веществ, 2,2
– стехиометрические коэффициенты в
уравнении реакции.
2. В случае гетерогенных реакций 2,3,4, в которых наряду с газообразными участвуют вещества, находящиеся в твердом состоянии (PbS(к),NH4NO3(к)) или жидкое индивидуальное вещество (CS2(ж)), образующие самостоятельные фазы и не меняющие своих свойств в ходе реакции, взаимодействие происходит на поверхности раздела фаз. Концентрации веществ, образующих твердую или жидкую фазу, остаются постоянными и не влияют на скорость реакции. Поэтому в выражение скорости реакции включаются только концентрации газообразных компонентов. Запишем выражение скорости реакций 2,3,4 соответственно:
![]() ;
;![]() ;
;![]()
Пример 2.
Как изменится скорость химической реакции 2NO(г)+O2(г)= 2NO2(г), если: а) концентрацию оксида азота (II) увеличить в 5 раз, б) объем системы увеличить в 2 раза.
Решение.а) Согласно закону действующих масс
первоначально скорость реакции равна:![]() .
После увеличения концентрации оксида
азота (II) в 5 раз скорость
реакции равна:
.
После увеличения концентрации оксида
азота (II) в 5 раз скорость
реакции равна:![]() .
.
Следовательно, скорость реакции возрастает в 25 раз.
б) При увеличении
объема системы в 2 раза концентрация
каждого из газообразных реагирующих
веществ уменьшится в 2 раза:
![]() ,
,![]() .
.
Скорость реакции после увеличения объема:
![]()
Следовательно, при увеличении объема системы в 2 раза скорость реакции уменьшится в 8 раз.
Пример 3.Как изменится скорость реакции 2Mg(к)+O2(г)= 2MgO(к), если общее давление в системе увеличить в 5 раз.
Решение.Скорость этой гетерогенной реакции
зависит только от концентрации
газообразного вещества (кислорода), так
как в уравнении скорости реакции
концентрация твердого вещества (Mg(к))
не входит:![]() .
.
Увеличение давления в системе в 5 раз вызовет уменьшение объема системы в 5 раз, а концентрация газообразного кислорода возрастает в
5 раз, (![]() ),
и скорость реакции будет равна:
),
и скорость реакции будет равна:![]() .
Следовательно, после увеличения давления
в 5 раз скорость реакции возрастает в 5
раз.
.
Следовательно, после увеличения давления
в 5 раз скорость реакции возрастает в 5
раз.
Пример 4.Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 700С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры выражается эмпирическим правилом Вант-Гоффа, согласно которому при увеличении температуры на 10скорость большинства гомогенных реакций увеличивается в 2-4 раза.
Математически правило Вант-Гоффа выражается уравнением:
![]() ,
где Т1, Т2– температура
реакции,V1,V2– скорости реакций при данных температурах,- температурный
коэффициент.
,
где Т1, Т2– температура
реакции,V1,V2– скорости реакций при данных температурах,- температурный
коэффициент.
В данном примере температура повысилась на 40С (Т=Т2– Т1), скорость реакции будет равна:
![]()
Следовательно, при повышении температуры на 40С скорость реакции увеличится в 16 раз.
Пример 5.Запишите выражение константы равновесия для обратимых систем:
1. 4HBr(г)+O2(г)2Br2(г)+ 2H2O(г)
2. 2ZnS(к)+ 3O2(г)2ZnO(к)+ 2SO2(г)
3. CaCO3(к)CaO(к)+CO2(г)
4. 2H2S(г)+ 3O2(г)2H2O(ж) + 2SO2(г)
Решение. Химическая реакция называется обратимой, если в данных условиях протекает не только прямая реакция (), но и обратная реакция (). Обратимые реакции не доходят до конца. С течением времени концентрация исходных веществ уменьшается, что приводит к уменьшению скорости прямой реакции. Скорость обратной реакции возрастает, так как увеличиваются концентрации продуктов реакции. Когда скорости прямой и обратной реакций становятся равными, наступает состояние химического равновесия. В условиях химического равновесия концентрации исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями, которые принято обозначать символом в квадратных скобках.
Состояние химического равновесия характеризуется константой химического равновесия Кс, которая равна отношению произведению равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
В случае гомогенной системы в выражении константы равновесия входят равновесные концентрации всех компонентов. В случае гетерогенной системы, компонентами которой являются газообразные и твердые вещества или газообразные и жидкие индивидуальные вещества, в выражение константы равновесия входят концентрации только газообразных веществ.
Система 1 – гомогенная, состоит только из газообразных веществ. Константа химического равновесия
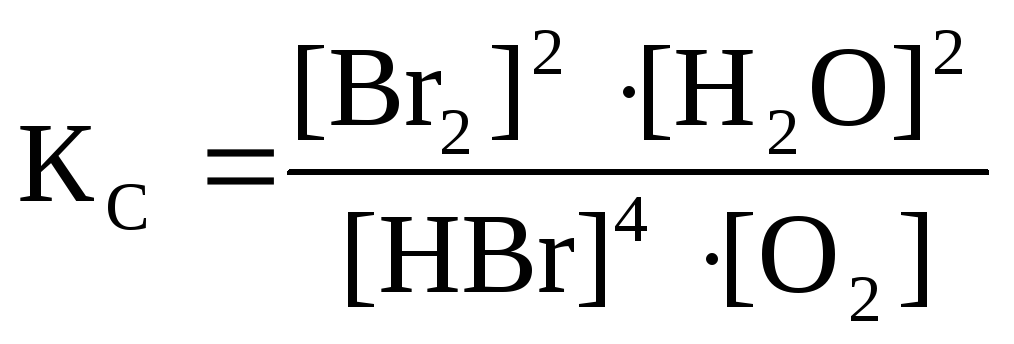
Системы 2,3,4 – гетерогенные, равновесие устанавливается на границе раздела твердое вещество – газ (система 2,3) и жидкое вещество – газ (система 4). Концентрации твердых и жидких индивидуальных веществ постоянные и в выражение константы равновесия не входят.
Выражения констант равновесия для систем 2,3,4 соответственно:
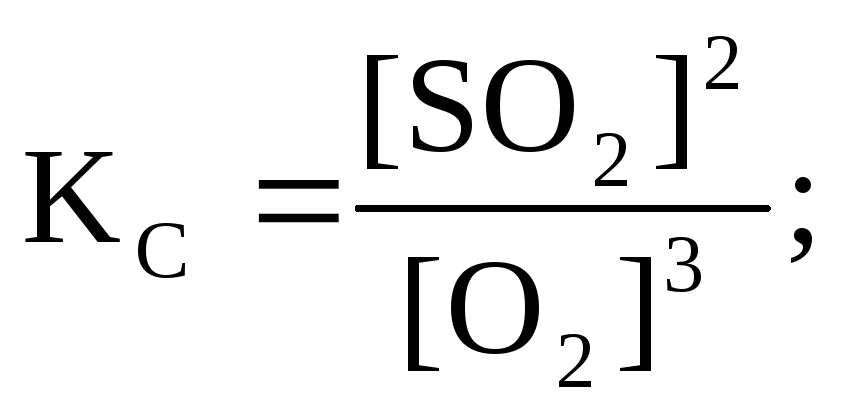
![]() ;
;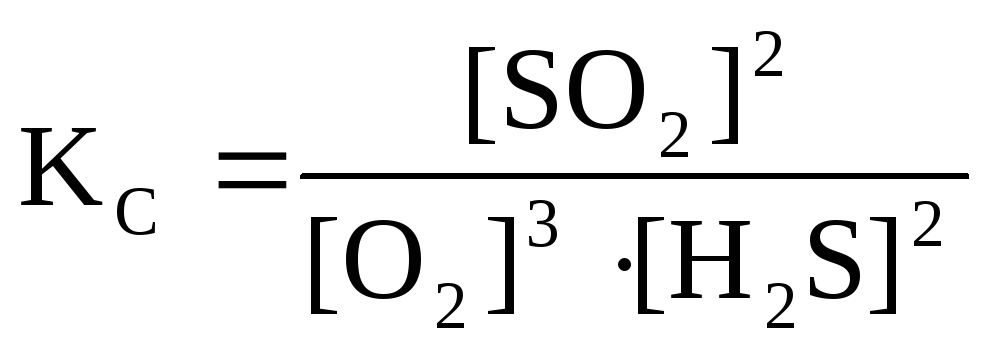
Пример 6.При синтезе аммиакаN2(г)+3Н2(г)2NН3(г)равновесие установилось при следующих равновесных концентрациях веществ (моль/л): [N2] = 2,5; [Н2] = 1,8; [NН3] = 3,6. Рассчитайте константу равновесия этой реакции и начальные концентрации исходных веществ. По величине константы равновесия укажите, какие вещества будут преобладать в равновесной системе: исходные или продукты реакции?
Решение.Вычислим константу равновесия реакции:
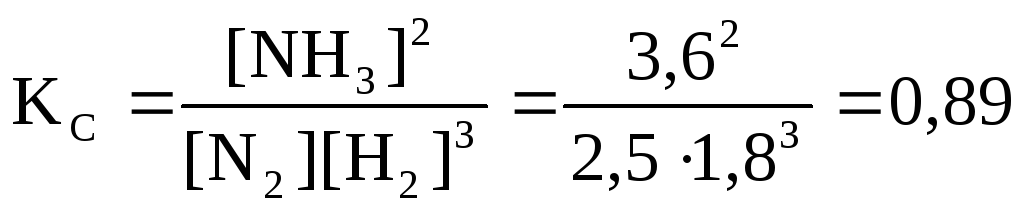
Константа равновесия определяет глубину превращения исходных веществ в продукты реакции – глубину протекания процесса в момент достижения равновесия. Если Кс1 в системе преобладают продукты реакции и чем больше константа равновесия (Кс1), тем больше выход продуктов реакции. При Кс1 в системе преобладают исходные вещества и выход продуктов реакции мал. При Кс = 1 реакция становится равновероятной.
В примере Кс1, следовательно, в равновесной системе преобладают исходные вещества и выход продуктов реакции мал.
Начальная концентрация вещества складывается из равновесной концентрации этого вещества и количества вещества, израсходованного на образование равновесной концентрации продукта реакции. На основании уравнения реакции определим количество израсходованного азота:
на образование 2 моль NН![]() расходуется 1 мольN
расходуется 1 мольN![]()
на образование 3,6 моль NН![]() расходуется х мольN
расходуется х мольN![]()
Отсюда
![]() мольN
мольN![]() .
.
Начальная концентрация азота
![]() моль/л.
моль/л.
Аналогично составим и решим пропорцию:
на образование 2 моль NН![]() расходуется 3 моль Н
расходуется 3 моль Н![]()
на образование 3,6 моль NН![]() расходуется у моль Н
расходуется у моль Н![]()
у
![]() моль Н
моль Н![]()
Начальная концентрация водорода
![]() моль/л.
моль/л.
Таким образом, реакция началась при концентрациях:
![]() моль/л;
моль/л;
![]() моль/л.
моль/л.
Пример 7.Даны системы:
1. PCl5(г)PCl3(г)+Cl2(г),Н = 92,59 кДж
2. PbS(к)+3O2(г)2PbO(к)+ 2SO2(г),Н = -841,0 кДж
Напишите выражения констант равновесия для данных систем. Как следует изменить концентрацию исходных веществ и продуктов реакции, давление, температуру, чтобы сместить равновесие в сторону прямой реакции?
Решение:Выражения констант химического равновесия для гомогенной (1) и гетерогенной (2) систем:
![]()
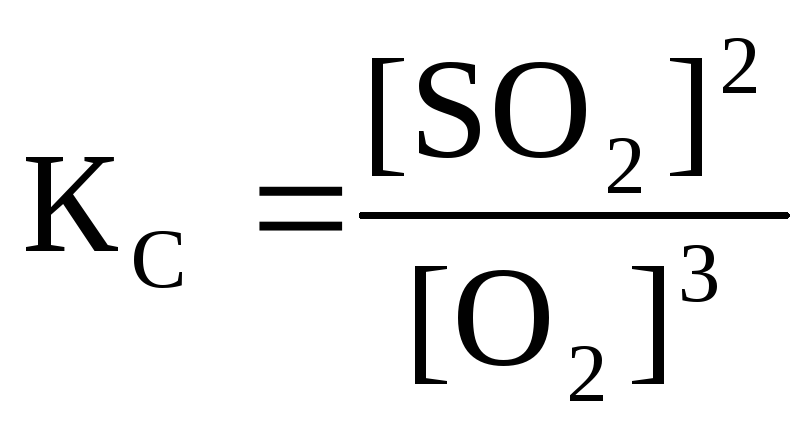
Направление, в котором смещается равновесие, определяется принципом Ле - Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится в том направлении, которое ослабляет эффект внешнего воздействия.
Рассмотрим влияние каждого из трех параметров на смещение химического равновесия.
а) Влияние концентрации на состояние равновесия ограничено содержанием в системе только тех веществ, концентрации которых входят в выражение константы равновесия. При увеличении концентрации одного из газообразных веществ (реагента или продукта), находящегося в равновесной системе, равновесие смещается в сторону расхода данного вещества. При уменьшении концентрации вещества равновесие смещается в сторону образования этого вещества.
В системе 1 увеличение концентрации исходного вещества PCl5, а также уменьшение концентрации продуктов реакцииPCl3иCl2смещает равновесие в сторону образования продуктов реакции.
В системе 2 увеличение концентрации исходного газообразного вещества O2, а также уменьшение концентрации продукта реакции - газообразногоSO2смещает равновесие в сторону образования продуктов реакции.
б) Изменение давления оказывает влияние на равновесие в том случае, если в реакции участвует хотя бы одно газообразное вещество и число молей исходных газообразных веществ и газообразных продуктов реакции не одинаково. При увеличении давления равновесие смещается в сторону образования веществ с меньшим объемом (меньшим числом молей газов). При понижении давления равновесие смещается в сторону образования веществ с большим объемом (большим числом молей газов). Если протекание реакции не сопровождается изменением объема, то изменение давление не влияет на состояние равновесия.
В системе 1 в реакцию вступил 1 моль газообразного вещества, образовалось в результате реакции 2 моля газообразного вещества (объем системы увеличился). Следовательно, чтобы сместить равновесие в сторону прямой реакции, следует уменьшить давление.
В гетерогенной системе 2 в реакцию вступило 3 моля газообразного вещества, образовалось в результате реакции 2 моля газообразного вещества. Следовательно, чтобы сместить равновесие в сторону прямой реакции следует увеличить давление.
в) При повышении температуры равновесие смещается в направлении протекания эндотермической реакции. При понижении температуры равновесие смещается в направлении протекания экзотермической реакции.
Реакция 1 протекает с поглощением тепла (НО), реакция эндотермическая. Для смещения равновесия в сторону прямой реакции следует повысить температуру.
Реакция 2 протекает с выделением тепла (НО), реакция экзотермическая. Для смещения равновесия в сторону прямой реакции следует понизить температуру.
Пример 8.Во сколько раз изменятся скорости прямой и обратной реакций в системеCl2(г)+ 2HI(г)I2(к)+ 2HCl(г), если уменьшить давление в системе в 3 раза. В каком направлении сместится равновесие в системы?
Решение.Первоначальные скорости прямой и обратной реакций были следующие:
![]() ;
;![]()
В уравнении скорости обратной реакции концентрация твердого вещества I2(к)не входит, т.к. она постоянна.
При уменьшении давления в 3 раза первоначальный объем системы увеличится в 3 раза, а концентрации каждого из газообразных компонентов уменьшаются в 3 раза:
![]() ,
,![]() ,
,![]()
При новых концентрациях скорости прямой и обратной реакций:
![]()
![]()
Скорость прямой реакции уменьшилась в 27 раз, а скорость обратной реакции уменьшилась в 9 раз, следовательно, равновесие сместится в сторону обратной реакции.
ЗАДАНИЯ
121. Окисление серы и оксида серы (IV) протекает по уравнениям:
а) S(к) + О2(г)=SО2 (г)
б) 2SО2(г)+ О2(г)= 2SО3(г)
Приведите формулировку закона действующих масс и напишите выражения для скорости данных реакций. Определите, как изменяется скорость этих реакций, если: а) объемы каждой из систем уменьшить в четыре раза; б) концентрацию кислорода уменьшить в два раза.
122.Напишите выражения для константы равновесия систем: а) СО2(г)+ С(графит) 2СО(г)
б) 2СО2(г)2СО(г)+ О2(г)
Как изменятся скорости прямых реакций, если концентрацию СО2в каждой системе уменьшить в 4 раза? Как следует изменить давление, чтобы повысить выход СО?
123.Напишите выражения для констант равновесия систем: а) СО(г)+ Н2О (г)СО2(г) + Н2(г)
б) 3Fe2O3(к)+CO(г)2Fe3O4(к)+CO2(г)
Как изменится скорость прямой реакции, если а) в каждой системе уменьшить концентрацию СО в 3 раза; б) повысить давление в системах в 2 раза. В каком направлении при этом сместится равновесие? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций.
124. Почему при изменении давления смещается равновесие системы N2(г) + 3Н2(г) 2NН3(г) и не смещается равновесие системы
N2(г)+О2(г) 2NО(г)? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до и после увеличения давления в системе в 2 раза. Напишите выражения для констант равновесия каждой из данных систем.
125. Каким законом выражается зависимость скорости реакции от концентрации реагирующих веществ? Напишите формулировку этого закона. Составьте выражение для скорости химической реакции
4НCl(г)+ О2(г)= 2Н2О(г)+ 2Cl2(г). Во сколько раз изменится скорость данной реакции, если: а) увеличить концентрацию НCl в 3 раза; б) увеличить давление в 2 раза; в) увеличить температуру на 40. Температурный коэффициент скорости реакции= 2.
126.Во сколько раз изменится скорость химической реакции 4NН3(г)+3О2(г)= 2N2(г)+ 6Н2О(г), если а) увеличить объем системы в 2 раза; б) увеличить концентрацию кислорода в 2 раза; в) понизить температуру на 300. Температурный коэффициент скорости реакции= 3.
127.Напишите выражения для констант равновесия систем:
а) 2SО2(г)+ О2(г)2SО3(г)
б) 2H2S(г)+SO2(г)3S(ромб)+ 2H2O(ж)
Как изменится скорость прямой реакции, если а) в каждой системе увеличить концентрацию SО2в 3 раза; б) понизить давление в системах в 2 раза. В каком направлении при этом сместится равновесие? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций.
128. Напишите выражения константы равновесия для систем:
а) 2СО(г)+ О2 (г)2СО2(г)(реакция экзотермическая)
б) MgCO3(к)MgO(к)+ СО2(г)(реакция эндотермическая)
В каком направлении сместятся равновесия этих систем: а) при повышении температуры; б) при понижении давления в 2 раза. Ответ мотивируйте на основании принципа Ле – Шателье.
129. Напишите выражения для констант равновесия систем: а) 3Fe(к)+ 4Н2О(г)Fe3O4(к)+ 4Н2(г)
б) СО(г)+ Н2О(г)СО2(г)+ Н2(г)
Как изменится скорость прямой реакции, если а) в каждой системе уменьшить концентрацию паров воды в 3 раза; б) увеличить давление в системах в 2 раза. В каком направлении при этом сместится равновесие? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций.
130. Напишите выражения констант равновесия для систем:
а) С2Н4(г)+ 3О2(г)2СО2(г)+ 2Н2О(ж)
б) 2Н2(г)+ О2(г)2Н2О(г)
Как изменится скорость прямой реакции, если: а) в каждой системе увеличить концентрацию кислорода в 3 раза; б) понизить давление в системах в 2 раза. В каком направлении при этом сместится равновесие? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций.
131. Напишите выражения константы равновесия для систем:
а) СаО(к)+ 3С(графит)СаС2(к)+ СО(г)(реакция эндотермическая);
б) N2 (г)+3Н2(г)2NН3 (г)(реакция экзотермическая).
Как влияют понижение температуры и уменьшение давления на равновесие данных систем? Ответ мотивируйте на основании принципа Ле - Шателье.
132. Напишите выражения констант равновесия для систем:
а) СО2(г)+ С(к)2СО(г)(реакция эндотермическая);
б) 2SО2(г)+ О2(г)2SО3(г)(реакция экзотермическая).
Как влияет повышение температуры и понижение давления на равновесие этих систем? Ответ мотивируйте на основании принципа Ле - Шателье.
133. Напишите выражения констант равновесия для систем:
а) FeО(к)+ СО(г)Fe(к)+ СО2(г)(реакция экзотермическая)
б) 2N2 (г)+ О2(г)2N2О(г)(реакция эндотермическая).
Как следует изменить температуру, чтобы равновесие этих систем сместить влево? Почему при изменении давления равновесие смещается только в одной системе? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до и после уменьшения давления в системе в 2 раза.
134.Напишите выражения констант равновесия для систем:
а) SО2(г)+ 2Н2(г)S(ромб)+2Н2О (г)
б) СО2(г)+ 4Н2(г)СН4(г)+ 2Н2О(г)
Как изменится скорость прямой реакции, если а) в каждой системе уменьшить концентрацию водорода в 3 раза; б) понизить давление в системе в
2 раза? В каком направлении при этом сместится равновесие? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции.
135. Равновесие системы 2СО(г)+ О2 (г)2СО2(г),Н = -566,2 кДж установилось при следующих концентрациях (моль/л): [СО] = 2; [О2] = 0,5; [СО2 ] = 2. Вычислите константу равновесия и исходные концентрации СО и О2. По величине константы укажите, какие вещества преобладают в равновесной системе: исходные или продукты реакции? В каком направлении сместится равновесие: а) при повышении температуры; б) при увеличении концентрации СО? Ответ мотивируйте на основании принципа Ле - Шателье.
136. Равновесие системы 2SО2(г)+ О2(г) 2SО3(г)установилось при следующих концентрациях (моль/л): [SО2] = 0,6; [О2] = 0,9; [SО3] = 1,5. Вычислите константу равновесия и исходные концентрации SО2и О2. По величине константы укажите, какие вещества преобладают в равновесной системе: исходные или продукты реакции? В каком направлении сместится равновесие: а) при увеличении давления; б) при увеличении концентрации кислорода? Ответ мотивируйте на основании принципа Ле - Шателье.
137. Равновесие системы 4НCl(г) + О2(г)2Н2О(г)+ 2Cl2(г)установилось при следующих концентрациях (моль/л): [НCl] = 0,2; [О2] = 0,32;
[Н2О] = 0,14; [Cl2] = 0,14. Вычислите константу равновесия и исходные концентрации хлороводорода и кислорода. По величине константы укажите, какие вещества преобладают в равновесной системе: исходные или продукты реакции? В каком направлении сместится равновесие: а) при повышении давления; б) при увеличении концентрации хлороводорода? Ответ мотивируйте на основании принципа Ле - Шателье.
138. Равновесие системы Fe2O3(к)+ 3СО(г)2Fe(к)+ 3СО2(г)установилось при следующих концентрациях (моль/л): [СО] = 1; [СО2] = 2. Вычислите константу равновесия и исходную концентрацию СО. По величине константы укажите, какие вещества преобладают в равновесной системе: исходные или продукты реакции? В каком направлении сместится равновесие: а) при повышении давления; б) при увеличении концентрации оксида углерода (II)? Ответ мотивируйте на основании принципа Ле - Шателье.
139. Равновесие системы СО(г)+ Н2О (г)СО2(г)+ Н2(г)установилось при следующих концентрациях (моль/л): [СО] = 0,004; [Н2О] = 0,064; [СО2] = 0,016; [H2] = 0,016. Вычислите константу равновесия и исходные концентрации СО и Н2О. По величине константы укажите, какие вещества преобладают в равновесной системе: исходные или продукты реакции? В каком направлении сместится равновесие а) при увеличении концентрации оксида углерода (II); б) при увеличении концентрации водорода? Ответ мотивируйте на основании принципа Ле - Шателье.
140. Равновесие системы 2Cl2(г)+ 2Н2О(г)4НCl(г)+ О2(г)установилось при следующих концентрациях (моль/л): [Cl2] = 0,8; [Н2О] = 2,2; [НCl] = 1,1; [О2] = 1,6. Вычислите константу равновесия и исходные концентрации Cl2 и Н2О. По величине константы укажите, какие вещества преобладают в равновесной системе: исходные или продукты реакции? В каком направлении сместится равновесие: а) при увеличении концентрации Cl2; б) при повышении давления? Ответ мотивируйте на основании принципа Ле - Шателье.
