
2_1-2_136
.doc
![]() . (6)
. (6)
Звідки отримаємо зміну температури
![]() . (7)
. (7)
Підставляємо в формулу (7) данні умови задачі, виражені в системі СІ, і отримаємо відповідь:
![]() =
=
-
Яку роботу треба здійснити, щоб розділити сферичну краплю ртуті радіусом R =3 мм на дві однакові краплі?
2.103.
Розв’язок.
Д
Дано
R
= 3 мм
![]() = 0,5 Дж/м2
= 0,5 Дж/м2
![]() = ?
= ?
![]() ,
(1)
,
(1)
де - поверхневий натяг; S – площа поверхневого шару, м2.
Оскільки каплю ділимо на дві однакові краплі, то зміна площі поверхневого шару дорівнюватиме
![]() , (2)
, (2)
де
![]() - діаметр великої кулі, який знаходимо
з рівності об’ємів великої кулі суми
маленьких:
- діаметр великої кулі, який знаходимо
з рівності об’ємів великої кулі суми
маленьких:
![]() . (3)
. (3)
Тоді зміну поверхні отримаємо підстановкою радіуса малої краплі з виразу (3) у вираз (2):
 , (4)
, (4)
Підставляємо
вираз
![]() з (4) у формулу енергії (1) і отримаємо
вираз для розрахунку работи:
з (4) у формулу енергії (1) і отримаємо
вираз для розрахунку работи:
![]() = (5)
= (5)
Підставляємо в формулу (5) данні умови задачі, виражені в системі СІ, і отримаємо відповідь:
![]() =
=
-
Яку роботу проти сил поверхневого натягу треба здійснити, щоб збільшити вдвічі об'єм мильної бульбашки радіусом R = 1 см? Поверхневий натяг мильного розчину = 0,043 Н/м.
2.104.
Дано
R
= 1 см
![]() = 0,043 Н/м
= 0,043 Н/м
![]() = ?
= ?
Додаткова енергія, яку мають молекули в поверхневому шарі рідини, отримала назву поверхневої і визначається таким чином:
![]() ,
(1)
,
(1)
де - поверхневий натяг; S – площа поверхневого шару, м2.
Оскільки необхідно збільшити вдвічі об'єм мильної бульбашки, то підрахуємо на скільки збільштеся площа її вільної поверхні, враховуючи що бульбашка має зовнішню і внутрішню поверхню:
![]() , (2)
, (2)
де
![]() - радіус великої бульбашки, який знаходимо
з умови задачі:
- радіус великої бульбашки, який знаходимо
з умови задачі:
![]() . (3)
. (3)
Тоді зміну поверхні отримаємо підстановкою радіуса великої бульбашки з виразу (3) у вираз (2):
![]() , (4)
, (4)
Підставляємо
вираз
![]() з (4) у формулу енергії (1) і отримаємо
вираз для розрахунку роботу:
з (4) у формулу енергії (1) і отримаємо
вираз для розрахунку роботу:
![]() (5)
(5)
Підставляємо в формулу (5) данні умови задачі, виражені в системі СІ, і отримаємо відповідь:
![]() =
=
-
Яку роботу проти сил поверхневого натягу треба здійснити, щоб видути мильну бульбашку діаметром d = 4 см? Поверхневий натяг мильного розчину = 0,043 Н/м.
2.105.
Дано
d
= 4 см
![]() = 0,043 Н/м
= 0,043 Н/м
![]() = ?
= ?
Додаткова енергія, яку мають молекули в поверхневому шарі рідини, отримала назву поверхневої і визначається таким чином:
![]() ,
(1)
,
(1)
де - поверхневий натяг; S – площа поверхневого шару, м2.
Оскільки необхідно видути мильну бульбашку, то підрахуємо на скільки збільштеся площа її вільної поверхні, враховуючи що бульбашка має зовнішню і внутрішню поверхню:
![]() , (2)
, (2)
Підставляємо
вираз
![]() з (2) у формулу енергії (1) і отримаємо
вираз для розрахунку роботи:
з (2) у формулу енергії (1) і отримаємо
вираз для розрахунку роботи:
![]() (5)
(5)
Підставляємо в формулу (5) данні умови задачі, виражені в системі СІ, і отримаємо відповідь:
![]() =
=
-
Знайти тиск повітря у повітряній бульбашці діаметром d = 0,01 мм, що знаходиться на глибині h = 20 см під поверхнею води. Атмосферний тиск
 о
=
101,7 кПа.
о
=
101,7 кПа.
2.106.
Дано
h
= 20 см
![]() =
0,01 мм
=
0,01 мм![]() = 0,073 Н/м
= 0,073 Н/м![]() = 101,7 кПа
= 101,7 кПа
![]() = ?
= ?
Надлишковий тиск, зумовлений кривизною поверхні рідини (формула Лапласа), для сферичної поверхні:
![]() .
(1)
.
(1)
Тоді повний тиск дорівнюватиме
![]() . (2)
. (2)
де
![]() - риск водяного стовпа.
- риск водяного стовпа.
Після підстановки у формулу (2) даних умови задачі, отримаємо відповідь
![]() =
=
-
Тиск повітря всередині мильної бульбашки на
 = 133,3 Па більше
атмосферного. Знайти
її діаметр. Поверхневий
натяг мильного розчину
= 0,043 Н/м.
= 133,3 Па більше
атмосферного. Знайти
її діаметр. Поверхневий
натяг мильного розчину
= 0,043 Н/м.
2.107.
Дано
![]() = 0,043 Н/м
= 0,043 Н/м![]() = 133,3 Па
= 133,3 Па
![]() = ?
= ?
Надлишковий тиск, зумовлений кривизною поверхні рідини (формула Лапласа), для сферичної поверхні:
![]() .
(1)
.
(1)
Згідно з умовою
надлишковий тиск дорівнює
![]() .
Тоді діаметр бульбашки дорівнюватиме
.
Тоді діаметр бульбашки дорівнюватиме
![]() . (2)
. (2)
Після підстановки у формулу (2) даних умови задачі, отримаємо відповідь
![]() =
=
-
Маса m = 10 г реального гелію займає об'єм V = 100 см3 при тиску
 =
100 МПа. Знайти
температуру
=
100 МПа. Знайти
температуру
 газу.
газу.
2.108.
Дано
m
= 10 г
![]() = 4∙10-3 кг/моль
= 4∙10-3 кг/моль![]() =
100 см3
=
100 см3
![]() = 100 МПа
= 100 МПа
![]() = ?
= ?
Рівняння Ван-дер-Ваальса для одного молю газу має вигляд
 ,
(.1)
,
(.1)
а для довільної маси газу
 , (2)
, (2)
де
![]() = і
= і
![]() — сталі
Ван-дер-Ваальса. В цьому рівнянні
— сталі
Ван-дер-Ваальса. В цьому рівнянні
![]() —тиск, зумовлений
силами
взаємодії молекул,
—тиск, зумовлений
силами
взаємодії молекул,
![]() —
об'єм, зв'язаний з власним об'ємом молекул.
—
об'єм, зв'язаний з власним об'ємом молекул.
Зв'язок критичних
параметрів — молярного об'єму, тиску і
температури газу — із сталими
![]() і
і
![]() Ван-дер-Ваальса
Ван-дер-Ваальса
![]() .
(3)
.
(3)
Сталу
![]() знайдемо з другого та квадрату третього
рівнянь з (3):
знайдемо з другого та квадрату третього
рівнянь з (3):
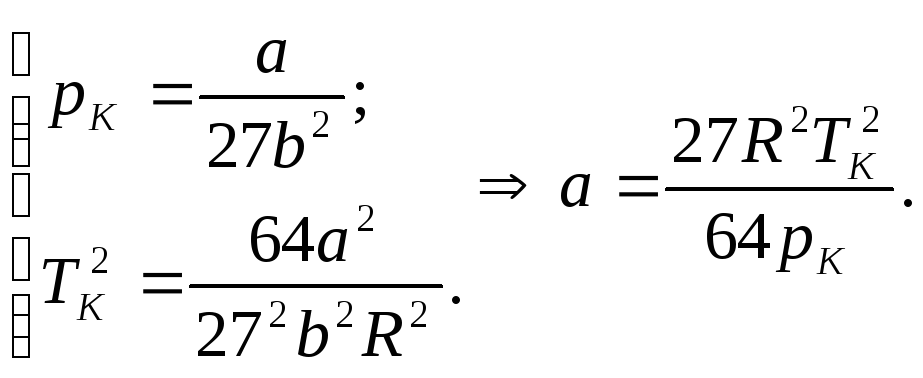 (4)
(4)
А
сталу
![]() визначаємо поділивши одне на одне друге
та третє рівняння з (3)
визначаємо поділивши одне на одне друге
та третє рівняння з (3)
![]() , (5)
, (5)
де
![]() = 5,2 К,
= 5,2 К,
![]() = 0,23 МПа – критичні параметри для гелію.
= 0,23 МПа – критичні параметри для гелію.
Отримані сталі Ван-дер-Ваальса з формул (4) і (5) підставляємо у формулу (2) та розв’язуємо її відносно температури:
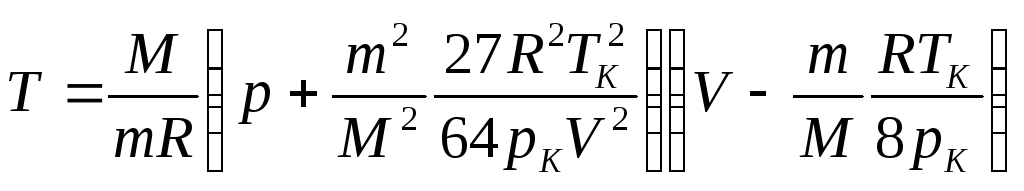 , (6)
, (6)
Підставляємо у вираз (6) даних умови і отримаємо відповідь:
![]() =
=
-
Один кмоль вуглекислого газу знаходиться при температурі Т = 100°С. Знайти тиск газу, вважаючи його реальним. Задачу розв’язати для об'ємів V1 = l м3 і V2 = 0,05 м3.
2.109.
Дано
Т
= 100°С V1
= l м3
V2
= 0,05 м3
![]() = 1 кмоль
= 1 кмоль![]() = 44∙10-3 кг/моль
= 44∙10-3 кг/моль![]() = 100 МПа
= 100 МПа
![]() = ?
= ?
![]() = ?
= ?
Рівняння Ван-дер-Ваальса для одного молю газу має вигляд
 ,
(.1)
,
(.1)
а для довільної маси газу
![]() , (2)
, (2)
де
![]() = і
= і
![]() — сталі
Ван-дер-Ваальса. В цьому рівнянні
— сталі
Ван-дер-Ваальса. В цьому рівнянні
![]() —тиск, зумовлений
силами
взаємодії молекул,
—тиск, зумовлений
силами
взаємодії молекул,
![]() —
об'єм, зв'язаний з власним об'ємом молекул.
—
об'єм, зв'язаний з власним об'ємом молекул.
Зв'язок критичних
параметрів — молярного об'єму, тиску і
температури газу — із сталими
![]() і
і
![]() Ван-дер-Ваальса
Ван-дер-Ваальса
![]() .
(3)
.
(3)
Сталу
![]() знайдемо з другого та квадрату третього
рівнянь з (3):
знайдемо з другого та квадрату третього
рівнянь з (3):
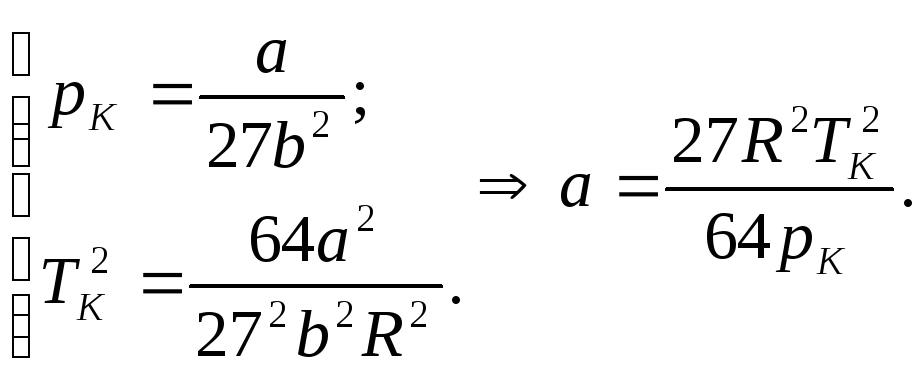 (4)
(4)
А
сталу
![]() визначаємо поділивши одне на одне друге
та третє рівняння з (3)
визначаємо поділивши одне на одне друге
та третє рівняння з (3)
![]() , (5)
, (5)
де
![]() = 304 К,
= 304 К,
![]() = 7,4 МПа – критичні параметри для
вуглекислого газу.
= 7,4 МПа – критичні параметри для
вуглекислого газу.
Отримані сталі Ван-дер-Ваальса з формул (4) і (5) підставляємо у формулу (2) та розв’язуємо її відносно тиску:
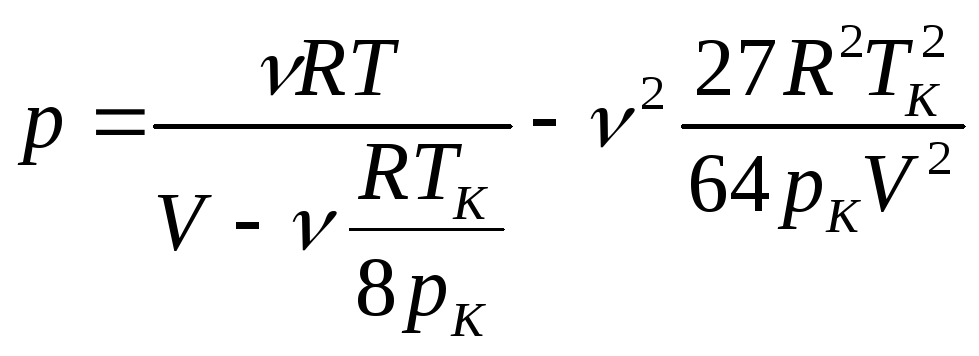 , (6)
, (6)
Підставляємо у вираз (6) даних умови і отримаємо відповіди:
![]() =
=
![]() =
=
2.110.
Знайти зміну ентропії
при
переході
![]() = 8 г
кисню від об'єму
= 8 г
кисню від об'єму
![]() = 10 л
при
температурі t1
= 80°С до об'єму
= 10 л
при
температурі t1
= 80°С до об'єму
![]() = 40 л
при
температурі t2
= 300°С.
= 40 л
при
температурі t2
= 300°С.
2.110.
Дано
V1
= 10 л
t1
= 80°С V2
= 40 л t2 = 300°С
![]() = 8 г
= 8 г![]() = 32∙10-3 кг/м3
= 32∙10-3 кг/м3
![]() = ?
= ?
Для любого оборотного кругового процесу, сума зведених кількостей теплоти дорівнює нулю. Тобто:
![]() .
(1)
.
(1)
З рівності нулю цього інтеграла слідує, що підінтегральний вираз дорівнює повному диференціалу деякої функції, яка визначається тільки станом термодинамічної системи і не залежить від способу переходу до цього стану. Тобто:
![]() .
(2)
.
(2)
Приріст ентропії
![]() при переході термодинамічної системи
із стану 1
у стан 2 дорівнює
при переході термодинамічної системи
із стану 1
у стан 2 дорівнює
![]() . (3)
. (3)
Таким чином, зміна ентропії при переході ідеального газу з одного стану у другий, не залежить від виду термодинамічного процесу і, з урахуванням першого принципу термодинаміки:
![]() , (4)
, (4)
де
![]() - елементарна кількість теплоти, що
підводиться до термодинамічної системи;
- елементарна кількість теплоти, що
підводиться до термодинамічної системи;
![]() - зміна внутрішньої енергії системи;
- зміна внутрішньої енергії системи;
![]() - робота, виконувана системою проти
зовнішніх сил при нескінченно малій
зміні об’єму, тоді, після інтегрування,
маємо
- робота, виконувана системою проти
зовнішніх сил при нескінченно малій
зміні об’єму, тоді, після інтегрування,
маємо
![]() .
(5)
.
(5)
Молярну теплоємність газу для випадку його участі в ізохорному процесі
![]() , (6)
, (6)
![]() = 5 - кількість
ступенів вільності молекул газу.
= 5 - кількість
ступенів вільності молекул газу.
З урахуванням теплоємності з виразу (6), вираз (5) прийме вигляд:
![]() .
(7)
.
(7)
Підставляємо в формулу (7) данні умови задачі, виражені в системі СІ, і отримаємо відповідь:
![]() =
=
-
Знайти зміну ентропії при переході
 = 6 г
водню від об'єму
V1
= 10 л
під тиском
= 6 г
водню від об'єму
V1
= 10 л
під тиском
 =150 кПа
до об'єму
V2
= 60 л
під тиском
=150 кПа
до об'єму
V2
= 60 л
під тиском
 = 100 кПа.
= 100 кПа.
2.111.
Дано
V1
= 10 л
V2
= 60 л
![]() = 6 г
= 6 г![]() = 2∙10-3 кг/м3
= 2∙10-3 кг/м3![]() =150 кПа
=150 кПа![]() = 100 кПа
= 100 кПа
![]() = ?
= ?
Для любого оборотного кругового процесу, сума зведених кількостей теплоти дорівнює нулю. Тобто:
![]() .
(1)
.
(1)
З рівності нулю цього інтеграла слідує, що підінтегральний вираз дорівнює повному диференціалу деякої функції, яка визначається тільки станом термодинамічної системи і не залежить від способу переходу до цього стану. Тобто:
![]() .
(2)
.
(2)
Приріст ентропії
![]() при переході термодинамічної системи
із стану 1
у стан 2 дорівнює
при переході термодинамічної системи
із стану 1
у стан 2 дорівнює
![]() . (3)
. (3)
Таким чином, зміна ентропії при переході ідеального газу з одного стану у другий, не залежить від виду термодинамічного процесу і, з урахуванням першого принципу термодинаміки:
![]() , (4)
, (4)
де
![]() - елементарна кількість теплоти, що
підводиться до термодинамічної системи;
- елементарна кількість теплоти, що
підводиться до термодинамічної системи;
![]() - зміна внутрішньої енергії системи;
- зміна внутрішньої енергії системи;
![]() - робота, виконувана системою проти
зовнішніх сил при нескінченно малій
зміні об’єму, тоді, після інтегрування,
маємо
- робота, виконувана системою проти
зовнішніх сил при нескінченно малій
зміні об’єму, тоді, після інтегрування,
маємо
![]() .
(5)
.
(5)
Молярну теплоємність газу для випадку його участі в ізохорному процесі
![]() , (6)
, (6)
![]() = 5 - кількість
ступенів вільності молекул газу.
= 5 - кількість
ступенів вільності молекул газу.
З системи рівнянь Менделєєва — Клапейрона для двох станів газу:
 (7)
(7)
Отримаємо відношення температур:
![]() . (8)
. (8)
З урахуванням теплоємності з виразу (6) відношення температур з виразу (8), вираз (5) прийме вигляд:
![]() .
(9)
.
(9)
Підставляємо в формулу (9) данні умови задачі, виражені в системі СІ, і отримаємо відповідь:
![]() =
=
-
Маса m = 6,6 г водню ізобарно розширяється від об'єму V1 до об'єму V2 = 2V1. Знайти зміну ентропії при цьому розширенні.
2.112.
Дано
V2
= 2∙V1
![]() = 6,6 г
= 6,6 г![]() = 2∙10-3 кг/м3
= 2∙10-3 кг/м3![]() =
=
![]()
![]() = ?
= ?
Для любого оборотного кругового процесу, сума зведених кількостей теплоти дорівнює нулю. Тобто:
![]() .
(1)
.
(1)
З рівності нулю цього інтеграла слідує, що підінтегральний вираз дорівнює повному диференціалу деякої функції, яка визначається тільки станом термодинамічної системи і не залежить від способу переходу до цього стану. Тобто:
![]() .
(2)
.
(2)
Приріст ентропії
![]() при переході термодинамічної системи
із стану 1
у стан 2 дорівнює
при переході термодинамічної системи
із стану 1
у стан 2 дорівнює
![]() . (3)
. (3)
Таким чином, зміна ентропії при переході ідеального газу з одного стану у другий, не залежить від виду термодинамічного процесу і, з урахуванням першого принципу термодинаміки:
![]() , (4)
, (4)
де
![]() - елементарна кількість теплоти, що
підводиться до термодинамічної системи;
- елементарна кількість теплоти, що
підводиться до термодинамічної системи;
![]() - зміна внутрішньої енергії системи;
- зміна внутрішньої енергії системи;
![]() - робота, виконувана системою проти
зовнішніх сил при нескінченно малій
зміні об’єму, тоді, після інтегрування,
маємо
- робота, виконувана системою проти
зовнішніх сил при нескінченно малій
зміні об’єму, тоді, після інтегрування,
маємо
![]() .
(5)
.
(5)
Молярну теплоємність газу для випадку його участі в ізохорному процесі
![]() , (6)
, (6)
![]() = 5 - кількість
ступенів вільності молекул газу.
= 5 - кількість
ступенів вільності молекул газу.
З системи рівнянь Менделєєва — Клапейрона для двох станів газу:
 (7)
(7)
Отримаємо відношення температур:
![]() . (8)
. (8)
З урахуванням теплоємності з виразу (6) відношення температур з виразу (8), вираз (5) прийме вигляд:
![]() .
(9)
.
(9)
Підставляємо в формулу (9) данні умови задачі, виражені в системі СІ, і отримаємо відповідь:
![]() =
=
-
На скільки тиск повітря всередині мильної бульбашки діаметром d = 5 мм більше нормального атмосферного тиску
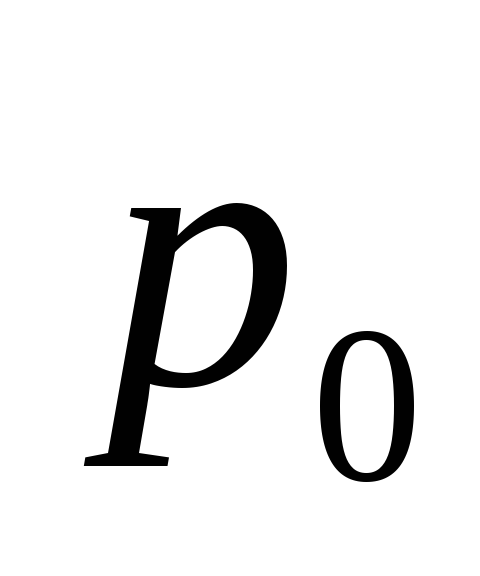 ?
?
2.113.
Дано
![]() = 5 мм
= 5 мм![]() = 0,043 Н/м
= 0,043 Н/м![]() = 105 Па
= 105 Па
![]() = ?
= ?
Надлишковий тиск, зумовлений кривизною поверхні рідини (формула Лапласа), для сферичної поверхні:
![]() .
(1)
.
(1)
Згідно з умовою
надлишковий тиск дорівнює
![]() .
Тоді маємо
.
Тоді маємо
![]() . (2)
. (2)
Після підстановки у формулу (2) даних умови задачі, отримаємо відповідь
![]() =
=
-
Знайти зміну ентропії при ізотермічному розширенні
 = 6 г
водню від тиску
= 6 г
водню від тиску
 = 100 кПа
до тиску
= 100 кПа
до тиску
 = 50 кПа.
= 50 кПа.
2.114.
Дано
![]() = 6 г
= 6 г![]() = 2∙10-3 кг/м3
= 2∙10-3 кг/м3![]() =
=
![]()
![]() = 100 кПа
= 100 кПа![]() = 50 кПа
= 50 кПа
![]() = ?
= ?
Для любого оборотного кругового процесу, сума зведених кількостей теплоти дорівнює нулю. Тобто:
![]() .
(1)
.
(1)
З рівності нулю цього інтеграла слідує, що підінтегральний вираз дорівнює повному диференціалу деякої функції, яка визначається тільки станом термодинамічної системи і не залежить від способу переходу до цього стану. Тобто:
![]() .
(2)
.
(2)
Приріст ентропії
![]() при переході термодинамічної системи
із стану 1
у стан 2 дорівнює
при переході термодинамічної системи
із стану 1
у стан 2 дорівнює
![]() . (3)
. (3)
