
- •Техніка безпеки в хімічній лабораторії
- •Заняття 1. Біогенні елементи; біологічна роль, застосування в медицині.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Характерні реакції іонів деяких макро – та мікроелементів
- •Заняття 2. Комплексоутворення в біологічних системах.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •КомплексНі сполуки
- •Заняття 3. Величини, що характеризують кількісний склад розчинів. Приготування розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Приготування розчину кобальт (іі) нітрату розбавленням більш концентрованого розчину
- •Заняття 4. Кислотно-основна рівновага в організмі. Водневий показник біологічних рідин.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Гідроліз солей
- •Заняття 5. Основи титриметричного аналізу.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення молярної концентрації еквівалента натрій гідроксиду за титрованим розчином сульфатної кислоти
- •Заняття 6. Буферні системи, їх біологічна роль.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Приготування буферних розчинів і вивчення їх властивостей
- •Завдання:
- •Визначення буферної ємності ацетатного буферного розчину
- •Завдання:
- •Заняття 7. Колігативні властивості розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення теплот нейтралізації
- •Заняття 9. Кінетика біохімічних реакцій.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Дослідження залежності швидкості розкладу тіосульфатної кислоти від її молярної концентрції
- •Заняття 10. Хімічна рівновага. Добуток розчинності.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення нормального окисно-відновного потенціалу
- •Заняття 12. Сорбція біологічно-активних речовин. Іонний обмін. Хроматаграфія.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Адсорбція ацетатної кислоти на активованому вугіллі
- •Кількісне визначення іонів кальцію у розчині методом іонообмінної адсорбції
- •Розділення суміші барвників за допомогою методу тонкошарової хроматографії
- •Розділення суміші катіонів заліза(ііі) і купруму(іі) за допомогою адсорбційної колонкової хроматографії
- •Заняття 13. Одержання ,очистка та властивості колоїдних розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Одержання, очищення та властивості колоїдних розчинів
- •Заняття 14. Коагуляція колоїдних розчинів. Властивості розчинів біополімерів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення порогу коагуляції
- •Визначення ізоелектричної точки (іет) альбуміну сироватки крові
- •Довідкова інформація
- •Приклад письмової роботи (Модуль 1)
- •Письмова робота
- •Приклад письмової роботи (Модуль 2)
- •Письмов робота
Теоретичні питання:
Розчини електролітів. Електроліти в організмі людини. Ступінь та константа дисоціації слабких електролітів. Властивості розчинів сильних електролітів. Активність та коефіцієнт активності. Іонна сила розчину. Водно-електролітний баланс - необхідна умова гомеостазу.
Дисоціація води. Іонний добуток води. Водневий показник рН. Значення рН для різних рідин людського організму в нормі та патології.
Теорії кислот та основ. Типи протолітичних реакцій: реакції нейтралізації, гідролізу та іонізації. Гідроліз солей. Ступінь гідролізу, залежність його від концентрації та температури. Константа гідролізу. Роль гідролізу в біохімічних процесах.
Тести та вправи до самостійної роботи:
1. Електролітами називаються речовини, що:
а) добре розчиняються у воді;
б) погано розчиняються у воді;
в) розпадаються на іони під дією полярних молекул розчинника (води);
г) не розпадаються на іони при розчиненні у воді й при нагріванні;
д) в розчиненому вигляді не проводять електричний струм.
2. Електролітична дисоціація – це розпад на іони під дією молекул розчинника речовин, які мають тип зв’язку, притаманний речовинам:
а) СН4; б) О2, N2; в) NaCl, HCl; г) CO2; д) CO, H2.
3. Кількісними характеристиками сили електроліту є:
а) ступінь гідролізу;
б) константа гідролізу;
в) константа дисоціації та ступінь дисоціації;
г) іонна сила розчину електроліту;
д) густина розчину електроліту.
4. Ступінь дисоціації (α) слабкого електроліту залежить від природи електроліту та:
а) об’єму розчину;
б) не залежить від природи розчинника;
в) не залежить від температури;
г) природи розчинника, температури, концентрації електроліту;
д) маси розчину.
5. Константа дисоціації слабкого електроліту (Кд) - це відношення до рівноважної молярної концентрації молекул електроліту, що не розпалися на іони:
а) суми рівноважних молярних концентрацій іонів електроліту;
б) різниці рівноважних молярних концентрацій іонів електроліту;
в) іонної сили розчину;
г) суми рівноважних моляльностей іонів електроліту;
д) добутку рівноважних молярних концентрацій іонів електроліту.
6. Константа дисоціації слабкого електроліту (Кд) не залежить від :
а) природи електроліту; б) природи розчинника;
в) концентрації електроліту; г) температури.
7. Ступінь дисоціації (α) для слабких електролітів при с (електроліту) = 0,1моль/л за температури 250С має значення:
а) α = 0; б) α = 1; в) α < 1; г) α > 1; д) α << 1.
8. Вказати константу дисоціації ортофосфатної кислоти, що має найбільшу величину:
а) Кд1; б) Кд2; в) Кд3; г) Кд загальна; д) всі константи рівні між собою.
9. Молярна концентрація іонів у водних розчинах сильних електролітів, виміряна за допомогою деяких фізико-хімічних методів, менша за розрахункову, тому що іони:
а) гідратуються;
б) утворюють молекули;
в) зменшують свою рухливість завдяки їх електростатичній взаємодії;
г) збільшують свою рухливість завдяки їх електростатичній взаємодії; д) гідролізуються.
10. Активність іонів а(х) – це їх молярна концентрація у:
а) концентрованих розчинах сильних електролітів;
б) розбавлених розчинах сильних електролітів;
в) дуже розбавлених розчинах сильних електролітів;
г) будь-яких розчинах сильних електролітів;
д) дуже розбавлених розчинах неелектролітів.
11. Активність іонів сильного електроліту а(х) у водному розчині дорівнює їх молярній концентрації с(х) за умови, що:
а) f >1; б) f <1; в) f = 1; г) f <<1; д) с(х) = 1 моль/л.
12. Активність іонів сильного електроліту а(х) в розчині дорівнює їх молярній концентрації с(х), якщо с(х) має значення:
а) 1 моль/л; б) 0,1 моль/л; в) →0; г) > 1; д) < 1 моль/л.
13. За силою електроліту чиста (дистильована) вода належить до:
а) сильних електролітів;
б) слабких електролітів;
в) неелектролітів;
г) електролітів середньої сили;
д) дуже слабких електролітів.
14. Константа дисоціації води Кд(Н2О) за температури 250С дорівнює (моль/л):
а) 2∙10–18; б) 2∙10–17; в) 1,8∙10–16; г) 2,8∙10–16; д)2,8∙10–17.
15. Константа дисоціації води Кд(Н2О) залежить від:
а) присутності кислоти;
б) присутності лугу;
в) температури;
г) присутності солі;
д) присутності неелектроліту.
16. Іонний добуток води (Кв) дорівнює:
а) Кв = [Н+] + [ОН–]; б) Кв = [Н+] – [ОН–];
в) Кв
= [Н+]∙[ОН–];
г) Кв
= lg ; д)
Кв
= lg
; д)
Кв
= lg .
.
17. Величина іонного добутку води (Кв )вимірюється в одиницях:
а) моль/л; б) г/л; в) моль2/л2; г) кг/моль; д) кг/л.
18. Іонний добуток води за температури 250С в логарифмічній формі дорівнює:
а) - 12; б) - 14; в) - 13; г) - 15; д) - 16.
19. Гідроксидний показник рОН дорівнює:
а) lg [OH-]; б) –lg Kд; в) –lg [OH–]; г) –lg [Н2O]; д) –ln [OH–].
20. Згідно з теорією Бренстеда і Лоурі кислотами є речовини, які при перебігу даної реакції можуть бути:
а) донорами гідроксидних груп;
б) донорами протонів (іонів гідрогену);
в) акцепторами протонів;
г) акцепторами електронної пари;
д) донорами електронної пари.
21. Серед наведених реакцій вибрати протолітичну:
а) ZnO + 2NaOH + H2O = Na2[Zn(OH)4];
б) 3NaOH + Al(OH)3 = Na3[Al(OH)6];
в) H2O + CH3COOH = CH3COO– + H3O+;
г) CaO + Pb(OH)2 + H2O = Ca[Pb(OH)4];
д) CH4 + Cl2 = CH3Cl + HCl.
22. Константа гідролізу (Кг) солі, утвореної залишками слабкої кислоти і сильної основи або слабкої основи і сильної кислоти – це відношення іонного добутку води (Кв) до:
а) константи дисоціації слабкого електроліту;
б) суми молярних концентрацій іонів гідрогену та гідроксид-іонів;
в) добутку молярних концентрацій іонів гідрогену та гідроксид-іонів;
г) кількості речовини солі, що прогідролізувала;
д) кількості речовини солі, що продисоціювала.
23. Ступінь гідролізу солі (αг) – це відношення до загальної кількості речовини розчиненої солі:
а) молярної концентрації солі;
б) масової концентрації солі;
в) масової частки солі;
г) кількості речовини солі, що прогідролізувала;
д) кількості речовини солі, що продисоціювала.
24. Ступінь гідролізу солі (αг) не залежить від:
а) молярних концентрацій іонів солі;
б) природи солі;
в) додавання сильної кислоти (або лугу);
г) присутності у розчині солі, утвореної сильною кислотою та лугом.
25. Ступінь гідролізу солі (αг) зростає при:
а) збільшенні концентрації солі ;
б) зниженні температури;
в) зниженні температури та збільшенні концентрації солі;
г) зменшенні концентрації солі;
д) додаванні солі, утвореної сильною кислотою та лугом.
26. Посилення гідролізу солей при підвищенні температури пояснюється:
а) збільшенням швидкості ендотермічної реакції дисоціації води;
б) зменшенням швидкості ендотермічної реакції дисоціації води;
в) зменшенням швидкості екзотермічної реакції дисоціації води;
г) збільшенням швидкості екзотермічної реакції дисоціації води.
27. Яка реакція середовища сечі, якщо аналізи показали, що в ній містяться такі солі: NН4Сl, (NН4)3РО4, (NН4)2SО4:
а) кисла; б) лужна; в) нейтральна; г) слабколужна; д) слабкокисла?
28. Реакція
середовища при гідролізі солі, утвореної
слабкою основою та слабкою кислотою,
якщо
 (основи) <
(основи) <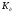 (кислоти), буде:
(кислоти), буде:
а) лужна; б) нейтральна; в) слабкокисла; г) слабколужна; д) кисла.
29. Яке
значення рН матиме розчин при гідролізі
солі, утвореної слабкою кислотою та
слабкою основою, якщо
 (основи) =
(основи) = (кислоти):
(кислоти):
а) рН < 7; б) рН ≈ 7; в) рН = 7; г) рН > 7; д) рН = 0?
30. Яка з кислот найсильніша, якщо:
а) рКСН3СOOH = 4,76; б) pKHNO2 = 3,29; в) pKHCOOH = 3,67;
г) pKHСlO = 7,30; д) pKHbrO = 8,60?
31. Якій солі
відповідає вираз для константи гідролізу
 :
:
а) (NH4)2SO4; б) Na2SO4; в) NaCN;
г) (NH4)3PO4; д) CH3COONH4?
32. В яких одиницях виражається Кг для солей, утворених слабкою кислотою та слабкою основою:
а) г/моль; б) г/л; в) моль2/л2; г) моль/л; д)безрозмірна величина ?
33. Водний розчин якої із солей має найменше значення рН, якщо Кд(NН3∙Н2О) = 1,8∙10‑5 моль/л, Кд2(Zn(ОН)2) = 10–11моль/л:
а) амоній хлорид;
б) амоній нітрат;
в) цинк нітрат;
г) амоній сульфат;
д) натрій нітрат.
34. Додавання лугу до розчину амоній хлориду призведе до:
а) пригнічення гідролізу;
б) підсилення гідролізу;
в) не вплине;
г) не відомо.
35. рН артеріальної крові здорової людини має значення:
а) 7,30; б) 7,40; в) 7,50; г) 7,60; д) 7,70.
36. Ацидоз – це відхилення рН до:
а) 8,3; б) 8,0; в) 7,7; г) 7,5; д) 7,1.
37. Алкалоз – це відхилення рН крові до:
а) 6,5; б) 6,8; в) 7,1; г) 7,0; д) 7,7.
38. Оптимальна дія ферменту травного каналу (шлунку) – пепсину проявляється при рН:
а) 1,5 – 2,5; б) 3 – 4; в) 4,5 – 5,0; г) 4,8 – 5,5; д)5,8 – 6,7.
|
39. Розрахувати
молярну концентрацію вільних іонів
H+
та OH-
при температурі
|
|
40. Обчислити
показники
|
|
41. Обчислити
показник
|
|
42. Розрахувати
значення
|
|
|
|
43. Обчислити
показник
|
|
|
|
44. Розрахувати
молярну концентрацію вільних іонів
H+
и OH-
в секреті підшлункової залози з
|
|
45. Обчислити
масу хлоридної кислоти,
яка міститься в 300мл розчину з
|
|
46. Обчислити
масову частку сульфатної кислоти в
розчині з
|
|
47. Розрахувати
масу барій гідроксиду, необхідну для
приготування 250мл розчину з
|
|
48. Розрахувати
масову частку амоніаку ( |
|
49. Водневий
показник розчину барій гідроксиду
дорівнює 12. Обчислити масову концентрацію
|
|
50. Написати
рівняння реакції першої стадії
гідролізу та обчислити константу
гідролізу для наступних солей: а)
|
ЛАБОРАТОРНА РОБОТА №4

 в розчині трихлороцтової кислоти(
в розчині трихлороцтової кислоти( )
з молярною концентрацією
)
з молярною концентрацією
 ,
якщо ступінь дисоціації електроліту
89%.
,
якщо ступінь дисоціації електроліту
89%.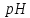 та
та для розчинів
з молярною концентрацією вільних
іонів H+
для розчинів
з молярною концентрацією вільних
іонів H+
 .
. для розчинів а) нітратної кислоти (
для розчинів а) нітратної кислоти ( )
з молярною концентрацією
)
з молярною концентрацією ;
б) барій гідроксиду (
;
б) барій гідроксиду ( )
з молярною концентрацією
)
з молярною концентрацією ,
якщо ступінь дисоціації електролітів
100%. Як зміниться
,
якщо ступінь дисоціації електролітів
100%. Як зміниться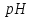 цих розчинів при розведенні в 100 разів?
цих розчинів при розведенні в 100 разів? 6%-го розчину оцтової кислоти, враховуючи
, що ступінь дисоціації кислоти 0,5% та
густина розчину 1
6%-го розчину оцтової кислоти, враховуючи
, що ступінь дисоціації кислоти 0,5% та
густина розчину 1 .
.

 розчину з масовою часткою барій
гідроксиду 0,02% враховуючи, що ступінь
дисоціації електроліту 100% та густина
розчину 1
розчину з масовою часткою барій
гідроксиду 0,02% враховуючи, що ступінь
дисоціації електроліту 100% та густина
розчину 1 .
.
 .
. 7,7.
7,7. ,
враховуючи, що ступінь дисоціації
електроліту 100%.
,
враховуючи, що ступінь дисоціації
електроліту 100%. .
. ,
якщо ступінь
дисоціації електроліту 100%. Густина
розчину 1
,
якщо ступінь
дисоціації електроліту 100%. Густина
розчину 1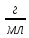 ;
;
 .
.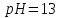 ,
враховуючи, що ступінь дисоціації
електроліту 100%.
,
враховуючи, що ступінь дисоціації
електроліту 100%. .
. )
в водному розчині, якщо значення
)
в водному розчині, якщо значення цього розчину 11,8. Ступінь дисоціації
цього розчину 11,8. Ступінь дисоціації 23%; густина розчину 0,998
23%; густина розчину 0,998 ;
;
 .
. в розчині, враховуючи, що ступінь
дисоціації електроліту 100%.
в розчині, враховуючи, що ступінь
дисоціації електроліту 100%. .
. ,
якщо
,
якщо
 ;
б)
;
б) ,
якщо
,
якщо
 ;
в)
;
в) ,
якщо
,
якщо
 ,
, .
.