
- •Техніка безпеки в хімічній лабораторії
- •Заняття 1. Біогенні елементи; біологічна роль, застосування в медицині.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Характерні реакції іонів деяких макро – та мікроелементів
- •Заняття 2. Комплексоутворення в біологічних системах.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •КомплексНі сполуки
- •Заняття 3. Величини, що характеризують кількісний склад розчинів. Приготування розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Приготування розчину кобальт (іі) нітрату розбавленням більш концентрованого розчину
- •Заняття 4. Кислотно-основна рівновага в організмі. Водневий показник біологічних рідин.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Гідроліз солей
- •Заняття 5. Основи титриметричного аналізу.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення молярної концентрації еквівалента натрій гідроксиду за титрованим розчином сульфатної кислоти
- •Заняття 6. Буферні системи, їх біологічна роль.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Приготування буферних розчинів і вивчення їх властивостей
- •Завдання:
- •Визначення буферної ємності ацетатного буферного розчину
- •Завдання:
- •Заняття 7. Колігативні властивості розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення теплот нейтралізації
- •Заняття 9. Кінетика біохімічних реакцій.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Дослідження залежності швидкості розкладу тіосульфатної кислоти від її молярної концентрції
- •Заняття 10. Хімічна рівновага. Добуток розчинності.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення нормального окисно-відновного потенціалу
- •Заняття 12. Сорбція біологічно-активних речовин. Іонний обмін. Хроматаграфія.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Адсорбція ацетатної кислоти на активованому вугіллі
- •Кількісне визначення іонів кальцію у розчині методом іонообмінної адсорбції
- •Розділення суміші барвників за допомогою методу тонкошарової хроматографії
- •Розділення суміші катіонів заліза(ііі) і купруму(іі) за допомогою адсорбційної колонкової хроматографії
- •Заняття 13. Одержання ,очистка та властивості колоїдних розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Одержання, очищення та властивості колоїдних розчинів
- •Заняття 14. Коагуляція колоїдних розчинів. Властивості розчинів біополімерів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення порогу коагуляції
- •Визначення ізоелектричної точки (іет) альбуміну сироватки крові
- •Довідкова інформація
- •Приклад письмової роботи (Модуль 1)
- •Письмова робота
- •Приклад письмової роботи (Модуль 2)
- •Письмов робота
Теоретичні питання:
Роль електрохімічних явищ в біологічних процесах.
Електродні потенціали та механізм їх виникнення. Рівняння Нернста. Нормальний (стандартний) електродний потенціал. Нормальний водневий електрод. Вимірювання електродних потенціалів. Електроди визначення та електроди порівняння. Хлорсрібний електрод. Іонселективні електроди. Скляний електрод.
Гальванічні елементи.
Дифузійний потенціал. Мембранний потенціал. Біологічна роль дифузійних та мембранних потенціалів. Потенціал пошкодження. Потенціал спокою. Потенціал дії.
Роль окисно-відновних реакцій в процесах життєдіяльності. Окисно-відновний потенціал як міра окисної та відновної здатності систем. Рівняння Петерса. Нормальний окисно-відновний потенціал.
Прогнозування напрямку окисно-відновних реакцій за величинами окисно-відновних потенціалів. Еквівалент окисника та відновника. Значення окисно-відновних потенціалів у механізмі процесів біологічного окиснення.
Потенціометрія. Потенціометричне визначення рН, активності іонів. Потенціометричне титрування.
Тести та вправи до самостійної роботи:
1. Провідником І роду є:
а) залізо; б) сірка; в) фосфор; г) розчин солі; д) розчин Н2О2.
2. Провідником ІІ роду є:
а) розчин солі; б) мідь; в) графіт; г) сірка; д) йод.
3. В яких одиницях вимірюється електродний потенціал :
а) В/м; б) В; в) Кл∙В; г) Дж; д) Кл?
4. Чому дорівнює потенціал хлорсрібного електрода як електрода порівняння при 298К:
а) 0,222В; б) 0,240В;
в) 0,201В; г) 0,0201В?
5. Який знак заряду виникає на цинковому електроді при зануренні його в розчин ZnSO4:
а) “+”; б) “-“; в) 0?
6. Яку пару електродів необхідно застосувати для визначення окисно-відновних потенціалів:
а) водневий та скляний; б) хлорсрібний та платиновий;
в) цинковий та мідний; г) золотий та скляний?
7. У розчин якої солі треба занурити цинкову пластину, щоб одержати цинковий електрод:
а) K2SO4; б) CuCl2; в)CuSO4; г)ZnSO4; д) Al(NO3)3?
8. Який метал треба занурити в розчин FeSO4, щоб звільнити цей розчин від домішків катіонів купруму (ІІ):
а) Fe; б) Ag; в) Au; г) Pt?
9. Чому
дорівнює
вираз
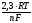 ,
при
розрахунках за
рівняннями
Нернста і Петерса,
якщо Т = 298К:
,
при
розрахунках за
рівняннями
Нернста і Петерса,
якщо Т = 298К:
а)
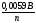 ; б)
; б)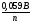 ;
;
в)
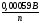 ; г)
; г)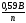 ?
?
10. Чому дорівнює універсальна газова стала (R) у рівняннях Нернста і Петерса при розрахунках:
а) 8,31∙ 103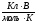 ; б)
8,31
; б)
8,31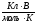 ;
;
в) 8,31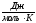 ; г)
8,31
; г)
8,31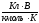 ?
?
11. У гальванічному елементі при його замиканні відбувається:
а) окисно-відновна реакція; б) реакція приєднання;
в) реакція розпаду; г) реакція іонного обміну.
12. Які електроди треба взяти для визначення молярної концентрації оцтової кислоти в розчині:
а) скляний та платиновий; б) мідний та цинковий;
в) хлорсрібний та скляний; г) платиновий та хлорсрібний?
13. Як змінюється потенціал Гіббса в гальванічних процесах:
а) ΔG>0; б) ΔG=0; в) ΔG<0?
14. Який із наведених електродів використовують як електрод порівняння:
а) скляний; б) цинковий; в) мідний; г) платиновий; д) хлорсрібний?
15. Як зміниться маса цинкової пластинки, зануреної в розчин CuSO4:
а) зменшиться; б) збільшиться; в) не зміниться?
16. Яка система має найбільшу окисну здатність:
а) E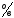 =
- 0,201В; б)E
=
- 0,201В; б)E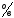 =0,201В;
=0,201В;
в) E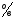 =0,340В; г)
E
=0,340В; г)
E =1,500В?
=1,500В?
17. При якій із наведених температур потенціал мідного електроду буде мати найбільше значення:
а) Т=273К; б) Т=283К;
в) Т=298К; г) Т=340К?
18. Написати рівняння Нернста для цинкового електрода (Zn/Zn2+).
19. Написати рівняння Петерса для електрода Pt/Fe3+, Fe2+.
20. Яка активність катіонів купруму (ІІ) в розчині, якщо потенціал мідного електроду дорівнює його стандартному значенню:
а) 0,1моль/л; б) 1моль/л; в) 2моль/л; г)0,2моль/л; д)10моль/л?
21. Який з гальванічних елементів є концентраційним:
а) Cu/c1(CuNO3)2//c2(AgNO3)/Ag; б) Cu/c1(CuSO4)//c2(CuSO4)/Cu;
в) Zn/ZnSO4//CuSO4/Cu; г) Zn/ZnSO4//KCl, AgCl/Ag?
22. Чому дорівнює окисно-відновний потенціал системи Fe3+/Fe2+,якщо співвідношення активностей цих іонів у розчині дорівнює 1 при температурі 298К:
а)
EFe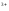 /Fe
/Fe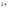 =E0Fe
=E0Fe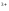 /Fe
/Fe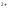 -0,059B; б)
EFe
-0,059B; б)
EFe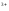 /Fe
/Fe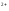 =E0Fe
=E0Fe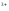 /Fe
/Fe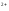 +
1B?
+
1B?
в)
EFe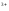 /Fe
/Fe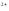 =E0Fe
=E0Fe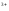 /Fe
/Fe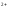 -1B;
г)
EFe
-1B;
г)
EFe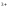 /Fe
/Fe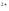 =E0Fe
=E0Fe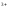 /Fe
/Fe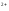 +
0,059B
+
0,059B
д)
EFe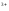 /Fe
/Fe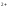 =E0Fe
=E0Fe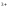 /Fe
/Fe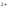 ?
?
|
23. Розрахувати ЕРС гальванічного елементу при 298К, складеного з двох срібних електродів з с1(Ag+)=10-3моль/л і с2(Ag+)=10-1моль/л. |
|
24. Розрахувати
ЕРС гальванічного елементу при 298К,
складеного з двох водневих електродів
з
|
|
25. Розрахувати
ЕРС гальванічного елементу при 298К
складеного з срібного електрода з
с(Ag+)
= 10-3моль/л
і цинкового електрода з с(Zn2+)
= 10-2моль/л.
|
ЛАБОРАТОРНА РОБОТА №11

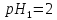 і
і .
.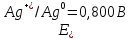 ,
,
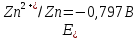 .
.