
- •Техніка безпеки в хімічній лабораторії
- •Заняття 1. Біогенні елементи; біологічна роль, застосування в медицині.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Характерні реакції іонів деяких макро – та мікроелементів
- •Заняття 2. Комплексоутворення в біологічних системах.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •КомплексНі сполуки
- •Заняття 3. Величини, що характеризують кількісний склад розчинів. Приготування розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Приготування розчину кобальт (іі) нітрату розбавленням більш концентрованого розчину
- •Заняття 4. Кислотно-основна рівновага в організмі. Водневий показник біологічних рідин.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Гідроліз солей
- •Заняття 5. Основи титриметричного аналізу.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення молярної концентрації еквівалента натрій гідроксиду за титрованим розчином сульфатної кислоти
- •Заняття 6. Буферні системи, їх біологічна роль.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Приготування буферних розчинів і вивчення їх властивостей
- •Завдання:
- •Визначення буферної ємності ацетатного буферного розчину
- •Завдання:
- •Заняття 7. Колігативні властивості розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення теплот нейтралізації
- •Заняття 9. Кінетика біохімічних реакцій.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Дослідження залежності швидкості розкладу тіосульфатної кислоти від її молярної концентрції
- •Заняття 10. Хімічна рівновага. Добуток розчинності.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення нормального окисно-відновного потенціалу
- •Заняття 12. Сорбція біологічно-активних речовин. Іонний обмін. Хроматаграфія.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Адсорбція ацетатної кислоти на активованому вугіллі
- •Кількісне визначення іонів кальцію у розчині методом іонообмінної адсорбції
- •Розділення суміші барвників за допомогою методу тонкошарової хроматографії
- •Розділення суміші катіонів заліза(ііі) і купруму(іі) за допомогою адсорбційної колонкової хроматографії
- •Заняття 13. Одержання ,очистка та властивості колоїдних розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Одержання, очищення та властивості колоїдних розчинів
- •Заняття 14. Коагуляція колоїдних розчинів. Властивості розчинів біополімерів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення порогу коагуляції
- •Визначення ізоелектричної точки (іет) альбуміну сироватки крові
- •Довідкова інформація
- •Приклад письмової роботи (Модуль 1)
- •Письмова робота
- •Приклад письмової роботи (Модуль 2)
- •Письмов робота
Приклад письмової роботи (Модуль 1)
1. Реакція нейтралізації – це:
а) процес розщеплення електролітів на іони під дією полярних розчинників;
б) обмінна взаємодія речовини з водою;
в) взаємодія кислоти з основою;
г) процес переходу речовини з однієї кристалічної форми в іншу.
2. При розчиненні у воді якої солі відбувається її гідроліз, але реакція середовища практично не змінюється:
а) нітрит цинку; б) купрум (ІІ) сульфат;
в) нітрат амонію; г) ферум (ІІ) сульфат?
3. Координаційне число – це:
а) кількість зв’язків, що безпосередньо з’єднують ліганди з комплексоутворявачем;
б) кількість місць, які ліганди займають у внутрішній координаційній сфері;
в) кількість реальних або умовних частинок, які відповідають 1 молю речовини;
г) сумарна кількість нуклонів в ядрі.
4. Який математичний вираз зв’язує молярна концентрація еквіваленту з молярною концентрацією розчиненої речовини:
|
а)
с( |
б)
|
|
в)
с( |
г)
|
5. Константа дисоціації слабкого електроліту (Кд.) не залежить від:
а) природи електроліту; б) природи розчинника;
в) концентрації електроліту; г) температури.
6. Яка реакція лежить в основі методу кислотно-основного титровання:
а) 2I–
– 2e
= I2; б)
MnO +
5e
+ 8H2O
= Mn2+
+
4H2O;
+
5e
+ 8H2O
= Mn2+
+
4H2O;
в) Ag+ + I– = AgI; г) H+ + OH– = H2O?
7. З приведених пар речовин вибрати компоненти ацетатного буферу:
а) CH3COONH4, CH3COOH; б) CH3COONa, CH3COOH;
в) CH3COOH, (CH3COO)2Mg; г) (CH3COO)2Zn, CH3COOH.
8. Дописати
пропущену формулу у рівнянні реакції:
SO + HOH
⇆
? + OH–.
+ HOH
⇆
? + OH–.
9. Назвати тип гібридизації атомних орбіталей комплексоутворювача в комплексному іоні [BeF4]2–:
а) sp; б) sp2; в) sp3; г) dsp2.
10. Вказати систему, для якої титрування неможливе:
а) Н2С2О4 – NaOH; б) CH3COOH–NH4OH;
в) HNO3–NaOH; г) NH3∙Н2O – HCl.
Письмова робота
11. Яку масу перманганату калію необхідно взяти для приготування 200 мл розчину з с(KMnO4) = 0,2 моль/л? М(KMnO4) = 158 г/моль.
12. Молярна концентрація іонів гідрогену артеріальної крові дорівнює 4,0∙10–8 моль/л. Чому дорівнює рН?
13. Розрахувати масу гідроксиду калію в розчині, якщо на титрування цього розчину витрачено 26,33 мл розчину сульфатної кислоти з молярною концентрацією еквіваленту 0,02 моль/л.
14. Визначити рН оцтового буферу, який складається з 75 мл розчину СН3СООН з с0(СН3СООН) = 0,2 моль/л та 150 мл розчину СН3СООNа з с0(СН3СООNа) = 0,1 моль/л. Кд(СН3СООН) = 1,8∙10-5.
15. Визначити
температуру замерзання розчину, який
містить на 100 г води 3,6 г глюкози. Тзам. =
=
= 273,15 К; Кк. = 1,86 кг·К/моль, М(С6Н12О6) = 180 г/моль.
Приклад письмової роботи (Модуль 2)
1. Вказати математичний вираз І закону термодинаміки:
а) ΔF = ΔU – TΔS; б) ΔG = ΔH – TΔS; в) Q = ΔU + А.
2. Записати кінетичне рівняння для елементарної реакції А+В=С+D:
а)
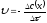 ;
б)v =
k [А]; в) v =
k [А] [В]; г) v
= k [А]2;
д) v =
k [В]2.
;
б)v =
k [А]; в) v =
k [А] [В]; г) v
= k [А]2;
д) v =
k [В]2.
3. При якому значені Кр оборотні реакції протікають з найбільш повним перетворенням вихідних речовин у продукти:
а) Кр = 1; б) Кр 1; в) Кр 1; г) Кр 1; д) Кр 1%?
4. Провідником І роду є:
а) залізо; б) сірка; в) фосфор; г) розчин солі; д) розчин Н2О2.
5. Як зміниться фізична адсорбція речовини з підвищенням температури:
а) не зміниться; б) збільшиться; в) спочатку збільшиться, а потім зменшиться;
г) зменшиться; д) спочатку зменшиться, а потім збільшиться?
6. Як зміниться адсорбція оцтової кислоти з водного розчину на активованому вугіллі при додаванні пропанової кислоти:
а) не зміниться; б) збільшиться; в) спочатку збільшиться, а потім зменшиться;
г) зменшиться; д) спочатку зменшиться, а потім збільшиться?
7. Коефіцієнт розподілу Rf для аспарагінової кислоти та аргініну між органічним розчинником та водою становить, відповідно, 0,07 и 0,41. Швидкість переміщення їх на папері буде:
а) у аргініну більша, ніж у аспарагінової кислоти;
б) у аспарагінової кислоти більша, ніж у аргініну; в) однакова для обох амінокислот.
8. У якій міцелі протийони дифузного шару рухаються до катоду:
а) {m[AgI] nAg+ (n–x)NO3–}x+ xNO3–; б) {m[BaSO4] nBa2+ (2n–x)Cl–}x+ xCl–;
в) {m[CuS] nCu2+ (n–x)SO42–}x+ xSO42–; г) {m[S] nS2O32– (2n–x)Na+}x– xNa+?
9. У фармацевтичній практиці широко використовують лікарські форми у вигляді колоїдно–дисперсних систем. До методів фізичної конденсації належить процес:
а) гідроліз солі; б) заміна розчиннику;
в) окисно–відновна реакція; г) обмінна реакція.
10. Рівняння
Доннана:
х
=
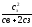 перетворюється у рівняння х
=
перетворюється у рівняння х
=
 за умови:
за умови:
а) сз св; б) сз св; в) сз св; г) сз св.

 x)
= c(x)z;
x)
= c(x)z; ;
; х)
=
х)
= ;
; ?
?