
- •Техніка безпеки в хімічній лабораторії
- •Заняття 1. Біогенні елементи; біологічна роль, застосування в медицині.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Характерні реакції іонів деяких макро – та мікроелементів
- •Заняття 2. Комплексоутворення в біологічних системах.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •КомплексНі сполуки
- •Заняття 3. Величини, що характеризують кількісний склад розчинів. Приготування розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Приготування розчину кобальт (іі) нітрату розбавленням більш концентрованого розчину
- •Заняття 4. Кислотно-основна рівновага в організмі. Водневий показник біологічних рідин.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Гідроліз солей
- •Заняття 5. Основи титриметричного аналізу.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення молярної концентрації еквівалента натрій гідроксиду за титрованим розчином сульфатної кислоти
- •Заняття 6. Буферні системи, їх біологічна роль.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Приготування буферних розчинів і вивчення їх властивостей
- •Завдання:
- •Визначення буферної ємності ацетатного буферного розчину
- •Завдання:
- •Заняття 7. Колігативні властивості розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення теплот нейтралізації
- •Заняття 9. Кінетика біохімічних реакцій.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Дослідження залежності швидкості розкладу тіосульфатної кислоти від її молярної концентрції
- •Заняття 10. Хімічна рівновага. Добуток розчинності.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення нормального окисно-відновного потенціалу
- •Заняття 12. Сорбція біологічно-активних речовин. Іонний обмін. Хроматаграфія.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Адсорбція ацетатної кислоти на активованому вугіллі
- •Кількісне визначення іонів кальцію у розчині методом іонообмінної адсорбції
- •Розділення суміші барвників за допомогою методу тонкошарової хроматографії
- •Розділення суміші катіонів заліза(ііі) і купруму(іі) за допомогою адсорбційної колонкової хроматографії
- •Заняття 13. Одержання ,очистка та властивості колоїдних розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Одержання, очищення та властивості колоїдних розчинів
- •Заняття 14. Коагуляція колоїдних розчинів. Властивості розчинів біополімерів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення порогу коагуляції
- •Визначення ізоелектричної точки (іет) альбуміну сироватки крові
- •Довідкова інформація
- •Приклад письмової роботи (Модуль 1)
- •Письмова робота
- •Приклад письмової роботи (Модуль 2)
- •Письмов робота
Теоретичні питання:
Хімічна рівновага. Константа хімічної рівноваги та способи її виразу. Зміщення хімічної рівноваги при зміні температури, тиску, концентрації речовин. Принцип Ле Шательє.
Реакції осадження та розчинення. Добуток розчинності. Умови випадання та розчинення осадів. Роль гетерогенної рівноваги за участю солей в загальному гомеостазі організму.
Тести та вправи до самостійної роботи:
1. У системі А(г)
+ В(г)
 С(г)
+D(тв);
∆H˚
< 0 встановилася рівновага. Зміною яких
умов можна досягти зміщення рівноваги
у бік утворення продукту С:
С(г)
+D(тв);
∆H˚
< 0 встановилася рівновага. Зміною яких
умов можна досягти зміщення рівноваги
у бік утворення продукту С:
а) підвищенням температури; б) зниженням тиску;
в) збільшенням концентрацій А та В; г) зменшенням концентрацій А та В;
д) пдодаванням каталізатора?
2. Який із записів
константи хімічної рівноваги для реакції
CaCO3
(тв)
 CaO
(тв)
+ CO2
(г) є
вірним:
CaO
(тв)
+ CO2
(г) є
вірним:
а) Kc
=
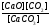 ;
в)Kc
=
;
в)Kc
=
 ;
;
б) Kc
= [СО2];
г). Kc
=
 ?
?
3. При якому значенні Кс оборотні реакції проходять з найбільш повним перетворенням вихідних речовин у продукти:
а) Кс = 1; б) Кс 1; в) Кс 1; г) Кс 1; д) Кс 1?
4. Як вплине додавання каталізатора на хімічну рівновагу в оборотній системі:
а) вливає лише на швидкість прямої реакції, причому рівновага порушується;
б) впливає лише на швидкість зворотної реакцій, причому рівновага порушується;
в) однаково впливає на швидкість прямої та зворотної реакцій, причому рівновага не порушиться;
г) впливає на швидкість прямої та зворотної реакцій не однаково, причому рівновага порушується?
5. Рівноважним називається такий стан системи, при якому:
а) концентрації реагуючих речовин рівні;
б) швидкості прямої і зворотної реакцій рівні, вільна енергія Гіббса досягає мінімального значення;
в) вільна енергія Гіббса дорівнює нулю;
г) вільна енергія Гіббса досягає максимального значення?
6. Відповідно до уявленнь про ДР умовою розчинення є:
а) ДК < ДР; б) ДК = ДР; в) ДК > ДР; г) ДК ≤ ДР; д) ДК ДР?
7. Яка з наведених солей найменше розчинна у воді, якщо:
а) ДР (CdS) =1,6.10-28 моль2/л2; б) ДР (CaCO3) = 4,8.10-9 моль2/л2;
в) ДР (AgI) =1,4.10-16моль2/ л2; г) ДР (CaSO4) =9,1.10-6 моль2/л2;
д) ДР (PbSO4) =1,6.10-27 моль2/л2?
8. Точним математичним виразом ДР аргентум (I) сульфату є рівняння:
а) ДР = [Ag+] [SO42-]; в) ДР= [Ag+]2 [SO42-];
б) ДР = 2[Ag+] [SO42-]; г) ДР= [Ag+]2 + [SO42-].
9. Якщо для розчину Ca3(PO4)2 виконується умова [Ca2+]3 [PO43-]2 ДР, то в такому випадку утвориться:
а) насичений розчин; б) ненасичений розчин; в) пересичений розчин.
10. Добуток розчинності малорозчинних електролітів залежить від:
а) температури; б) молярної концентрації іонів;
в) концентрації солі; г) присутності іншого електроліту.
11. Які зміни відбудуться, якщо до розчину СaSO4, який знаходиться в рівновазі з осадом, додати Na2SO4:
а) збільшиться ДР(СaSO4);
б) ДР(СaSO4) не зміниться, молярна концентрація іонів Сa2+ зменшиться, бо молярна концентрація іонів SO42- збільшиться;
в) збільшиться ДР(СaSO4) та молярна концентрація іонів Сa2+;
г) зменшиться ДР(СaSO4) та молярна концентрація іонів Сa2+?
12. Який осад утвориться першим при поступовому додаванні розчину Na2SO4 до розчину, в якому молярні концентрації іонів Ca2+, Sr2+, Ba2+, Pb2+ - однакові, якщо:
а) ДР (CaSO4) =1,3.10-4 моль2/л2; б) ДР (SrSO4) = 3,2.10-7 моль2/л2;
в) ДР (BaSO4) =1,1.10-10 моль2/л2; г) ДР (PbSO4) =1,6.10-8моль2/ л2?
|
13. Хвороба “камні нирок” - це осідання малорозчинних солей Са(II) різного складу (уратів, фосфатів та оксалатів). Чи призводить до утворення осаду СаС2О4 збільшення концентрації оксалат-іонів в плазмі крові до с(С2О42-) = 210-4 моль/л; щодо концентрації катіону кальцію у вільному стані, то вона, становить в плазмі крові с (Са2+) = 1,010-3 моль/л. | ||||||||||||||||||||||||||||||||||||
|
14. Чи
випаде осад CdC2O4
при підвищенні масової концентрації
CdC2O4
в розчині до
| ||||||||||||||||||||||||||||||||||||
|
15. Чи випаде осад при змішуванні рівних об’ємiв розчинів BaCl2 та Na2SO4, молярна концентрація яких 0,01 моль/л? | ||||||||||||||||||||||||||||||||||||
|
16. Обчислити масову концентрацію PbI2 в насиченому розчині. М(PbI2) = 461г/моль. | ||||||||||||||||||||||||||||||||||||
|
17. Обчислити масову концентрацію Ag2CO3 в насиченому розчині. М(Ag2CO3) = 276г/моль.
ЛАБОРАТОРНА РОБОТА №10 ДОБУТОК РОЗЧИННОСТІ, УМОВИ УТВОРЕННЯ ОСАДУ
Для насиченого розчину важкорозчинної сполуки AmBn, що здатна до дисоціації добуток рівноважних молярних концентрацій утворених йонів при даній температурі є сталою величиною і має назву добуток розчинності. ДРAmBn= [An+]m ∙ [Bm-]n, де ДРAmBn – добуток розчинності речовини AmBn, що дисоціює за рівнянням AmBn = mAn+ + nBm-; [An+]m та [Bm-]n – рівноважні молярні концентрації утворених йонів у ступенях відповідних стехіометричних коефіцієнтів рівняння хімічної реакції. У тому випадку, коли добуток рівноважних молярних концентрацій (ДК) іонів електроліту перевищує добуток розчинності ДКAmBn > ДРAmBn, утвориться осад.
Завдання:
Таблиця
Рівноважні молярні концентрації йонів розраховують виходячи з формули: с(Х)·V(X) = с0(Х)·V0(X).
с(Pb2+) = = моль/л
с(Cl‾) = = моль/л
с(I‾) = = моль/л
ДK(PbCl2)= [Pb2+] [Cl-]2 = = моль3/л3
ДK(PbI2)= [Pb2+] [I-]2 = = моль3/л3
____________________________________________________________________________________________________________________________________________________________________________________________________________ Заняття 11. Визначення окисно-відновного потенціалу.
Мета (знати, вміти): – пояснювати механізм утворення електродних потенціалів; – аналізувати принципи методу потенціометрії і робити висновки щодо його використання в медико-біологічних дослідженнях; – вимірювати окисно-відновні потенціали та прогнозувати спрямованість окисно-відновних процесів;
Основні поняття теми заняття: провідник, електрод, електродний потенціал, електродні процеси, гальванічний елемент, електрорушійна сила.
Література:
|

 .M(CdC2O4)
= 200 г/моль.
.M(CdC2O4)
= 200 г/моль.