
- •Техніка безпеки в хімічній лабораторії
- •Заняття 1. Біогенні елементи; біологічна роль, застосування в медицині.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Характерні реакції іонів деяких макро – та мікроелементів
- •Заняття 2. Комплексоутворення в біологічних системах.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •КомплексНі сполуки
- •Заняття 3. Величини, що характеризують кількісний склад розчинів. Приготування розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Приготування розчину кобальт (іі) нітрату розбавленням більш концентрованого розчину
- •Заняття 4. Кислотно-основна рівновага в організмі. Водневий показник біологічних рідин.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Гідроліз солей
- •Заняття 5. Основи титриметричного аналізу.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення молярної концентрації еквівалента натрій гідроксиду за титрованим розчином сульфатної кислоти
- •Заняття 6. Буферні системи, їх біологічна роль.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Приготування буферних розчинів і вивчення їх властивостей
- •Завдання:
- •Визначення буферної ємності ацетатного буферного розчину
- •Завдання:
- •Заняття 7. Колігативні властивості розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення теплот нейтралізації
- •Заняття 9. Кінетика біохімічних реакцій.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Дослідження залежності швидкості розкладу тіосульфатної кислоти від її молярної концентрції
- •Заняття 10. Хімічна рівновага. Добуток розчинності.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення нормального окисно-відновного потенціалу
- •Заняття 12. Сорбція біологічно-активних речовин. Іонний обмін. Хроматаграфія.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Адсорбція ацетатної кислоти на активованому вугіллі
- •Кількісне визначення іонів кальцію у розчині методом іонообмінної адсорбції
- •Розділення суміші барвників за допомогою методу тонкошарової хроматографії
- •Розділення суміші катіонів заліза(ііі) і купруму(іі) за допомогою адсорбційної колонкової хроматографії
- •Заняття 13. Одержання ,очистка та властивості колоїдних розчинів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Одержання, очищення та властивості колоїдних розчинів
- •Заняття 14. Коагуляція колоїдних розчинів. Властивості розчинів біополімерів.
- •Теоретичні питання:
- •Тести та вправи до самостійної роботи:
- •Визначення порогу коагуляції
- •Визначення ізоелектричної точки (іет) альбуміну сироватки крові
- •Довідкова інформація
- •Приклад письмової роботи (Модуль 1)
- •Письмова робота
- •Приклад письмової роботи (Модуль 2)
- •Письмов робота
Тести та вправи до самостійної роботи:
1. Буферний розчин – це система, що здатна зберігати постійне значення:
а) добутку молярних концентрацій компонентів буфера;
б) водневого показника рН;
в) константи дисоціації слабкого електроліту буфера Кд;
г) іонного добутку
води
 ;
;
д) константи дисоціації води Кд (Н2О).
2. Головними чинниками, що впливають на величину рН буферного розчину, є:
а) іонний добуток води Кв;
б) добуток молярних концентрацій компонентів буфера;
в) рКд слабкого електроліту та співвідношення молярних концентрацій компонентів буфера, температура;
г) концентрація буферного розчину
3. Із наведених пар речовин вибрати компоненти фосфатного буфера:
а) NaH2PO4, Na3PO4; б) Na2HPO4, NaH2PO4;
в) Na2HPO4, Na3PO4; г) Na3PO4, NaOH.
4. Із наведених пар речовин вибрати компоненти гемоглобінового буфера:
а) HHb, KHb; б) HHb, Mg(Hb)2;
в) KHb, NaHbO2; г) KHb, HHbO2.
5. Написати іонне рівняння реакції, що пояснює механізм дії амонійного буфера при додаванні до нього помірної кількості калій гідроксиду.
6. Написати іонне рівняння реакції, що пояснює механізм дії гідрокарбонатного буфера при додаванні до нього помірної кількості натрій гідроксиду.
7. Написати іонне рівняння реакції, що пояснює механізм дії ацетатного буфера при додаванні до нього помірної кількості хлоридної кислоти.
8. Користуючись величинами Кд слабких електролітів, вибрати оптимальний буфер для проведення дослідів при рН 7,40:
а) рКд (СН3СООН) = 4,76; б) рКд1 (СО2∙Н2О) = 6,35;
в) рКд (Н2РО4–) = 7,20; г) рКд (NH3∙H2O) = 4,74.
9. рН основного буфера дорівнює (формула Гендерсона-Гассельбаха):
а)
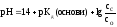 ; б)
; б) ;
;
в)
 ; г)
; г) .
.
10. Буферні розчини здатні:
а) підтримувати постійне значення рН при безмежному розведенні;
б) підтримувати постійне значення рН при додаванні будь-яких кількостей сильної кислоти або лугу;
в) підтримувати постійне значення рН тільки при додаванні порівнянню невеликих кількостей сильних кислот або лугів та обмеженому розведенні.
11. Буферна ємність залежить від:
а) об’єму буферного розчину;
б) кількості доданої сильної кислоти чи сильної основи;
в) співвідношення кількості компонентів кислотно–основної пари;
г) концентрації солі у розчині і не залежить від концентрації слабкої кислоти чи слабкої основи.
12. Чим більша концентрація кожного із компонентів кислотно–основної пари, тим буферна ємність такого розчину:
а) вища; б) нижча; в) не залежить від концентрації компонентів.
13. Буферна ємність розчину приймає найбільше значення, якщо:
а) співвідношення концентрацій компонентів буферної суміші більше 1;
б) співвідношення концентрацій компонентів буферної суміші менше 1;
в) співвідношення концентрацій компонентів буферної суміші =1;
г) співвідношення концентрацій компонентів буферної суміші не впливає на величину буферної ємності.
14. В міру поступового додавання до буферного розчину сильної кислоти або лугу стійкість розчину до зміни рН:
а) поступово зменшується; б) залишається постійною;
в) поступово збільшується; г) різко зменшується.
15. Буферні системи при поступовому додаванні значної кількості сильної кислоти або лугу змінюють рН:
а) негайно, практично миттєво;
б) не реагують на зміну рН;
в) поступово;
г) спочатку підвищують значення рН розчину на одиницю, а потім зменшують на одиницю.
16. Вкажіть область рН ефективної дії ацетатної буферної суміші:
a) рН = 3,7 – 5,7; б) рН = 8,2 – 10,2;
в) рН = 9,3 – 11,3; г) рН = 6,2 – 8,2.
17. Органами, що беруть участь в регуляції кислотно-основної рівноваги в організмі людини є:
а) легені, залози внутрішньої секреції, печінка, мозок, серце, нирки;
б) легені, шкіра, кишково- шлунковий тракт, мозок;
в) печінка, кишково- шлунковий тракт, легені, серце;
г) легені, нирки, кишково-шлунковий тракт, печінка, залози внутрішньої секреції, шкіра.
18. Співвідношення
молярних концентрацій компонентів
гідрогенкарбонатного буфера

 в плазмі крові при рН 7,4 має бути :
в плазмі крові при рН 7,4 має бути :
а) 18 : 2; б) 20 : 1; в) 15 : 1; г) 18 : 3.
19. Фосфатний буфер в організмі людини міститься в:
а) крові, сечі, травних соках;
б) крові, сечі, слині;
в) крові, слині, лімфі; г) крові, соках підшлункової залози та шлунку, мозку.
20. Найбільший вміст у крові людини буферу:
а) аміачного; б) фосфатного;
в) гідрогенкарбонатного; г) гемоглобінового.
21. Важкі форми цукрового діабету супроводжуються порушенням кислотно-основної рівноваги в організмі і виникненням ацидозу. Яке значення рН крові відповідає цьому захворюванню:
а) 7,7 – 7,9; б) 7,1 – 7,2; в) 7,35 – 7,65; г) 7,85 – 8,15; д) 8,65 – 8,85?
22. Відомо, що при ішемічній хворобі серця відбувається зміщення кислотно-основної рівноваги в кислу область. На скільки одиниць змінюється при цьому рН крові?
а) збільшується на 0,7 – 1,0; б) збільшується на 1,0 – 2,0;
в) зменшується на 1,5 – 2,0; г) зменшується на 0,2 – 0,3;
д) збільшується на 0,4 – 0,5?
23. Буферна ємність внутрішнього середовища еритроцитів зумовлена наявністю:
а) гідрогенкарбонатної (H2CO3/KHCO3) та фосфатної (KH2PO4/K2HPO4) буферних систем;
б) гідрогенкарбонатної (H2CO3/KHCO3), фосфатної (KH2PO4/K2HPO4) та білкової буферних систем;
в) гідрогенкарбонатної (H2CO3/KHCO3) буферної системи;
г) гідрогенкарбонатної (H2CO3/KHCO3) та білкової буферних систем.
24. Гідрокарбонатна буферна система більш ефективно компенсує дію речовин:
а) які збільшують основність крові, ніж речовин, які збільшують кислотність крові;
б) які зменшують кислотність крові;
в) які збільшують кислотність крові;
г) в однаковій мірі компенсує дію речовин, що призводять до зміни кислотно–основного стану крові.
25. Надлишок CO2 в атмосфері приводить до додаткового розчинення CO2 у крові (згідно з законом Генрі). Це, в свою чергу, викликає:
а) підвищення рН крові (алкалоз);
б) зниження рН крові (ацидоз);
в) не змінює рН крові.
26. Яка буферна система з перерахованих буферних систем крові має найбільшу буферну ємність:
а) гідрогенкарбонатна; б) гемоглобінова;
в) фосфатна; г) амінокислотна.
26. Яка буферна система з перерахованих буферних систем крові має найбільшу буферну ємність:
а) гідрогенкарбонатна; б) гемоглобінова; в) фосфатна; г) амінокислотна.
|
27. Обчислити
|
|
28. Обчислити
|
|
29. Обчислити
|
|
30. Обчислити
об’єми розчинів оцтової кислоти і
натрій ацетату з молярними концентраціями
|
|
31. Обчислити
об’єми розчинів натрій гідрогенфосфату
з
|
|
32. Обчислити
об’єми розчинів натрій гідрогенфосфату
та натрій дигидрогенфосфату з
концентраціями
|
|
33. Обчислити
об’єми розчину амоній хлориду і
розчину амоніаку з молярними
концентраціями
|
|
33. Розрахувати
ємність буферного розчину за кислотою,
якщо при титруванні 10,0мл розчину
витрачено 5,3мл розчину хлоридної
кислоти з молярною концентрацією
|
|
34. Розрахувати
буферну ємність розчину за лугом, якщо
при титруванні 20,0мл цього розчину для
зміни
|
ЛАБОРАТОРНА РОБОТА №6

 амонійного буферного розчину,
приготованого з 600мл розчину амоній
хлориду з
амонійного буферного розчину,
приготованого з 600мл розчину амоній
хлориду з і 800мл розчину амоніаку з
і 800мл розчину амоніаку з .
.
 фосфатного буферного розчину, що
складається з 150мл розчину натрій
дигідрогенфосфату з
фосфатного буферного розчину, що
складається з 150мл розчину натрій
дигідрогенфосфату з та 250мл розчину натрій гідрогенфосфату
з
та 250мл розчину натрій гідрогенфосфату
з .
. .
. ацетатного буферного розчину,
приготованого з 250мл розчину натрій
ацетату з
ацетатного буферного розчину,
приготованого з 250мл розчину натрій
ацетату з і 300мл розчину оцтової кислоти з
і 300мл розчину оцтової кислоти з .
.
 і
і ,
а також води, які необхідно змішати,
щоб отримати 1,4л ацетатного буферного
розчину з молярною концентрацією
,
а також води, які необхідно змішати,
щоб отримати 1,4л ацетатного буферного
розчину з молярною концентрацією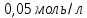 та
та .
. .
. та натрій дигідрогенфосфату з
та натрій дигідрогенфосфату з ,
а також води, які необхідно змішати,
щоб отримати 750мл фосфатного буферного
розчину з молярною концентрацією
,
а також води, які необхідно змішати,
щоб отримати 750мл фосфатного буферного
розчину з молярною концентрацією та
та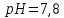 .
.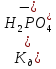 .
. і
і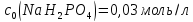 ,
необхідні для приготування 600мл
фосфатного буферного розчину з
,
необхідні для приготування 600мл
фосфатного буферного розчину з .
.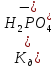
 і
і ,
які потрібно змішати, щоб приготувати
1500мл амонійного буферного розчину з
,
які потрібно змішати, щоб приготувати
1500мл амонійного буферного розчину з .
. .
.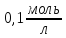 на зменшення
на зменшення від 4,1 до 3,3?
від 4,1 до 3,3? від 7,1 до 8,3 витрачено 7,4мл розчину
калій гідроксиду з молярною концентрацією
0,02 моль/л?
від 7,1 до 8,3 витрачено 7,4мл розчину
калій гідроксиду з молярною концентрацією
0,02 моль/л?