
- •Закон Стефана-Больцмана. Закони Віна.
- •Зв'язок між формулою Планка та законами Стефана-Больцмана і Віна.
- •Принцип Паулі та розподіл електронів у атомі.
- •30 Лазери.
- •Дефекти кристалічної структури та локальні енергетичні рівні в напівпровідниках.
- •Експериментальні методи реєстрації частинок.
- •49 Складові частини атомного ядра. Походження бета-випромінювання. Взаємоперетворення нуклонів.
- •Класифікація та взаємоперетворюваність елементарних частинок. Поняття про кварки.
-
Принцип Паулі та розподіл електронів у атомі.


 - закон Мозлі
(експериментальна залежність),
- частота, b=const,
- стала екранування, z
– порядковий номер елемента (антикатода)
- закон Мозлі
(експериментальна залежність),
- частота, b=const,
- стала екранування, z
– порядковий номер елемента (антикатода)
 - закон Мозлі виражений через квантові
числа рівнів електронів, що здійснюють
переходи при випусканні Х-променів
R
– стала Рідберга, n1,
n2
–цілі квантові числа.Лінії в
характеристичному спектрі об’єднуються
в серії, в кожній серії вони мають певний
порядок розташування. Якщо n1
надати постійного значення, а n2
змінювати, причому n2>
n1,
то отримаємо спектральну серію. Відповідно
для n1=1,2,3…
отримуємо серії характеристичного
випромінювання, що позначається буквами
K,
L,
M,
N
і т.д. Застосування рентгенівського
(Х-) випромінювання: медицина; кристалографія
і матеріалознавство, рентгено-структурний
аналіз; визначення якостей конструкцій
в промисловості і будівництві; біологічні
процеси та керування ними.
- закон Мозлі виражений через квантові
числа рівнів електронів, що здійснюють
переходи при випусканні Х-променів
R
– стала Рідберга, n1,
n2
–цілі квантові числа.Лінії в
характеристичному спектрі об’єднуються
в серії, в кожній серії вони мають певний
порядок розташування. Якщо n1
надати постійного значення, а n2
змінювати, причому n2>
n1,
то отримаємо спектральну серію. Відповідно
для n1=1,2,3…
отримуємо серії характеристичного
випромінювання, що позначається буквами
K,
L,
M,
N
і т.д. Застосування рентгенівського
(Х-) випромінювання: медицина; кристалографія
і матеріалознавство, рентгено-структурний
аналіз; визначення якостей конструкцій
в промисловості і будівництві; біологічні
процеси та керування ними.
-
Основні види міжатомних зв’язків. Поняття про обмінні сили. Для полегшення розуміння міжатомної взаємодії ми будемо розглядати типи хімічного зв'язку в трохи спрощеному виді, а саме, розглянемо: а) гомеополярний, або ковалентний зв'язок, б) гетерополярний, або іонний зв'язок, в) металевий зв'язок і г) поляризаційний зв'язок, або зв'язок Ван-Дер-Ваальса. Об'єднання атомів у молекули речовини, а також об'єднання атомів або іонів у тверде тіло відбувається під дією хімічних зв'язків. Об'єднання молекул у речовину, що перебуває в рідкому або газоподібному стані здійснюється під дією сил міжмолекулярної взаємодії, називаними силами Ван-Дер-Ваальса. Природа хімічних і молекулярних зв'язків єдина – електрична. Розрізняють кілька типів хімічного зв'язку, основні з них – це ковалентна й іонна. Інтеграл А( R ) має розмірність енергії і характеризує особливу квантово-механічну взаємодію, яка виникає між двома тотожними електронами, і яку умовно називають «обмінною взаємодією». «Обмінну взаємодію» електронів в молекулі водню розуміють так, що електрон кожного із її атомів періодично перебуває то біля одного атома, то біля іншого атома, здійснюючи тим самим зв’язок обох атомів. Сили, які проявляються при цьому, називають «обмінними». Розрахунки показують, що на великих відстанях R C(R) i A(R) мають зникаюче мале значення. На великих відстанях взаємодія між окремими атомами водню відсутня. На середніх відстанях, співрозмірних з борівським радіусом водневого атома, обидва інтеграли C(R) i A(R) є від’ємні, причому çA(R)ç>çC(R)ç. Тому енергія в формулі (2.3.2) матиме такі два значення:
 ;
;
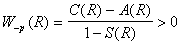 .
(2.3.3). Перше з них W+p(R) відповідає притяганню
і характеризує стійкий стан молекули
водню. Друге W-p(R) відповідає відштовхуванню
і визначає нестійкий стан молекули.
Для стійкого стану молекули, координатна
хвильова функція є симетричною, а спіни
електронів повинні бути антипаралельними.
Лише в такому випадку за принципом
Паулі повна хвильова функція буде
антисиметричною. У нестійкому стані
молекули водню координатні хвильові
функції є антисиметричними. Для
збереження антисиметричного характеру
повної хвильової функції необхідно
щоб спіни електронів в обох атомах
молекули були паралельними.
.
(2.3.3). Перше з них W+p(R) відповідає притяганню
і характеризує стійкий стан молекули
водню. Друге W-p(R) відповідає відштовхуванню
і визначає нестійкий стан молекули.
Для стійкого стану молекули, координатна
хвильова функція є симетричною, а спіни
електронів повинні бути антипаралельними.
Лише в такому випадку за принципом
Паулі повна хвильова функція буде
антисиметричною. У нестійкому стані
молекули водню координатні хвильові
функції є антисиметричними. Для
збереження антисиметричного характеру
повної хвильової функції необхідно
щоб спіни електронів в обох атомах
молекули були паралельними.
-
Розщеплення енергетичних рівнів електронів при утворенні молекул. Молекулярні спектри. Молекулярні спектри - спектри випромінювання і поглинання, а також комбінаційного розсіяння, що виникають внаслідок переходів між енергетичними станами молекул. М. с. мають складну структуру. Типові М. с. — смугасті, вони спостерігаються у випусканні і поглинанні і в комбінаційному розсіянні в вигляді сукупності більш менш вузьких смуг в ультрафіолетовій, видимій і близькій інфрачервоній областях, що розпадаються при достатній вирішуючій силі вживаних спектральних приладів на сукупність тісно розташованих ліній. Конкретна структура М. с. різна для різних молекул і, взагалі кажучи, ускладнюється із збільшенням числа атомів в молекулі.
-
Взаємодія молекул. Сили Ван-дер-Ваальса. Природа хімічних зв'язків в молекулі залишалася загадкою аж до створення квантової механіки - класична фізика не могла пояснити насичуваність і направленість валентних зв'язків. Основи теорії хімічного зв'язку були створені в 1927 році Гайтлером та Лондоном на прикладі найпростішої молекули Н2. Пізніше, теорія і методи розрахунків були значно вдосконалені. Хімічні зв'язки в молекулах переважної більшості органічних сполук є ковалентними. Серед неорганічних сполук існують іонні та донорно-акцепторні зв'язки, які реалізуються в результаті усуспільнення пари електронів атома. Енергія утворення молекули з атомів в багатьох рядах подібних сполук наближено адитивна. Тобто можна вважати, що енергія молекули - це сума енергій її зв'язків, що мають постійні значення таких рядах. Адитивність енергії молекули виконується не завжди. Прикладом порушення адитивності є пласкі молекули органічних сполук з так званими спряженими зв'язками, тобто з кратними зв'язками, які чергуються з одиничними. В таких випадках валентні електрони, які визначають кратність зв'язків, так звані p-електрони, стають спільними для всієї системи спряжених зв'язків, делокалізованими. Така делокалізація електронів призводить до стабілізації молекули. Вирівнювання електронної густини внаслідок колективізації p-електронів у зв'язках виражається в укороченні подвійних зв'язків та видовженні одинарних. В правильному шестикутнику міжвуглецевих зв'язків бензолу всі зв'язки однакові і мають довжину, середню між довжиною одинарного і подвійного зв'язку. Спряження зв'язків яскраво проявляється в молекулярних спектрах. Сучасна квантовомеханічна теорія хімічних зв'язків враховує часткову делокалізацію не тільки p-, але й s-електронів, яка спостерігається в будь-яких молекулах. У переважній більшості випадків сумарний спін валентних електронів в молекулі дорівнює нулю, тобто спіни електронів попарно насичені. Молекули, які містять неспарені електрони - вільні радикали, зазвичай нестійкі, оскільки при їх сполученні один з одним відбувається значне зниження енергії внаслідок утворення ковалентних зв'язків. Сили Ван дер Ваальса - сили міжмолекулярної взаємодії з енергією 0,8 — 8,16 кДж/моль, загальний термін для позначення сил взаємодії між нейтральними атомами на далекій у порівнянні з розмірами атомів віддалі. Сили Ван дер Ваальса задаються сферично симетричним потенціалом, обернено пропорційним віддалі у шостому степені:
 ,
де a - характерна для конкретних атомів
стала, r - віддаль між атомами. Знак мінус
свідчить про те, що сили ван дер Ваальса
зумовлюють притягання між атомами.
Існують три типи ван дер Ваальсових
сил, причому всі вони мають електростатичну
природу:орієнтаційні сили, дисперсійні
сили, індукційні сили. У випадку
нейтральних атомів без власного
дипольного моменту, сили ван дер Ваальса
зумовлені взаємодією наведених дипольних
моментів атомів. Заряджене ядро й
електрони одного атома поляризують
інший атом. Як наслідок, обидва атоми
отримують наведений дипольний момент.
Взаємодія цих моментів зумовлює
притягання між атомами, тобто ван дер
Ваальсові сили. Вона залежить від
поляризовності атомів. У випадку атомів,
які мають власний дипольний момент, у
ван дер Ваальсові сили вносять вклад
два додаткові ефекти: орієнтаційна
взаємодія й поляризаційна взаємодія.
Сили ван дер Ваальса слабкі в порівнянні
з іншими видами електромагнітної
взаємодії. Проте вони зумовлюють
утворення молекулярних кристалів.
,
де a - характерна для конкретних атомів
стала, r - віддаль між атомами. Знак мінус
свідчить про те, що сили ван дер Ваальса
зумовлюють притягання між атомами.
Існують три типи ван дер Ваальсових
сил, причому всі вони мають електростатичну
природу:орієнтаційні сили, дисперсійні
сили, індукційні сили. У випадку
нейтральних атомів без власного
дипольного моменту, сили ван дер Ваальса
зумовлені взаємодією наведених дипольних
моментів атомів. Заряджене ядро й
електрони одного атома поляризують
інший атом. Як наслідок, обидва атоми
отримують наведений дипольний момент.
Взаємодія цих моментів зумовлює
притягання між атомами, тобто ван дер
Ваальсові сили. Вона залежить від
поляризовності атомів. У випадку атомів,
які мають власний дипольний момент, у
ван дер Ваальсові сили вносять вклад
два додаткові ефекти: орієнтаційна
взаємодія й поляризаційна взаємодія.
Сили ван дер Ваальса слабкі в порівнянні
з іншими видами електромагнітної
взаємодії. Проте вони зумовлюють
утворення молекулярних кристалів. -
Комбінаційне розсіяння світла. Комбінаційне розсіяння – це ефект, який полягає у появі в спектрі розсіяння крім частоти падаючого випромінювання 0 ряду ліній, зміщенних по частоті на величину , яка дорівнює і-0 (рис. 3.15).
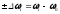 .
Додаткові лінії в спектрі розсіяння
називаються супутниками. Причина
виникнення супутників:
взаємодія фотонів падаючого випромінювання
з молекулами середовища. В результаті
обміну між ними енергією, внаслідок
непружної взаємодії, молекули поглинають
енергію і при переході в нормальний
стан випромінюють квант світла з іншою
частотою. Супутники із більшою довжиною
хвилі ніж падаюче випромінювання,
називаються червоними, а із меншою
довжиною хвилі – фіолетовими. Фіолетові
супутники зв’являються,
якщо молекули рідини знаходились в
збудженому стані до опромінення.
.
Додаткові лінії в спектрі розсіяння
називаються супутниками. Причина
виникнення супутників:
взаємодія фотонів падаючого випромінювання
з молекулами середовища. В результаті
обміну між ними енергією, внаслідок
непружної взаємодії, молекули поглинають
енергію і при переході в нормальний
стан випромінюють квант світла з іншою
частотою. Супутники із більшою довжиною
хвилі ніж падаюче випромінювання,
називаються червоними, а із меншою
довжиною хвилі – фіолетовими. Фіолетові
супутники зв’являються,
якщо молекули рідини знаходились в
збудженому стані до опромінення.

-
хемілюмінісценція;
-
радіолюмінесценція;
-
катодолюмінесценція;
-
біолюмінесценція.
Явище
люмінесценції описується законом
Стокса.
Із закону збереження енергії:
 ,
частота люмінесцентного випромінювання
,
частота люмінесцентного випромінювання
 ,
де з
– частота збуджуючого люмінесцентного
випромінювання, Wт
– втрата енергії на теплові процеси,
що супроводжують люмінесценцію. Оскільки
,
де з
– частота збуджуючого люмінесцентного
випромінювання, Wт
– втрата енергії на теплові процеси,
що супроводжують люмінесценцію. Оскільки
 ,
то
,
то .
.
Звідси
випливає закон Стокса:Максимум
випромінювання при люмінесценції
зсунутий в бік більших довжин хвиль в
порівнянні з довжиною хвилі збуджуючого
випромінювання:
Застосування люмінесценції:
-
перетворення спектра світлового випромінювання;
-
індикатори;
-
екрани;
-
перетворювачі світлової енергії в інші види енергії;
-
елементи зв’язку.
В ізольованій системі між тілом і випромінюванням існує рівновага.
