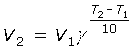- •«Российский государственный университет правосудия»
- •Цели и задачи курса
- •Глава 12. Химические реакции
- •Химические реакции
- •Как проходят реакции
- •Закон сохранения массы
- •Химические уравнения
- •Классификация химических реакций
- •2.По изменению степеней окисления реагентов
- •3.По тепловому эффекту реакции
- •4.По типу превращений реагирующих частиц
- •Скорость химической реакции
- •Вычисление скорости реакции вследствие изменения концентрации реагирующих веществ
- •Вычисление скорости реакции с газовыми компонентами вследствие изменения давления
- •Вычисление скорости реакции вследствие изменения температуры
- •Химическое равновесие
- •1. Вычисление константы химического равновесия
- •2. Вычисление равновесных концентраций по исходным концентрациям реагирующих веществ и наоборот
- •3. Смещение химического равновесия
- •Основная литература
- •Дополнительная литература
- •Интернет – источники
- •Приложение 1 Скорость химической реакции. Химическое равновесие
- •I вариант
- •II вариант
- •Приложение 2 Упражнения и задачи
- •Приложение 3 Задачи для самостоятельного решения
Скорость химической реакции
Скорость гомофазной реакции - отношение изменения концентрации реагента или продукта реакции ко времени протекания реакции.
|
|
Единица измерения скорости:
|
|
Скорость гетерофазной реакции - отношение изменения количества вещества реагента или продукта реакции ко времени протекания реакции и площади соприкосновения реагирующих веществ.
|
|
Единица измерения скорости:
|
|
Факторы, влияющие на скорость реакции. 1. Природа реагирующих веществ (состав, строение, энергия активации).


Энергия активации (Ea) - избыточная энергия (по сравнению со средней), необходимая для эффективного соударения реагирующих частиц. Чем меньше энергия активации, тем больше скорость реакции, и, чем больше энергия активации, тем меньше скорость реакции. Например, реакции обмена в водных растворах, приводящие к образованию осадка протекают очень быстро, так как у них очень маленькая энергия активации. Напротив, реакция получения аммиака из водорода и азота при комнатной температуре практически не идет, так как у нее очень большая энергия активации.
2. Температура. При увеличении температуры увеличивается скорость движения молекул и их кинетическая энергия, уменьшается прочность связей, все это приводит к возрастанию числа частиц с энергией, равной энергии активации, и увеличению скорости реакции.
Правило Вант-Гоффа. При увеличении температуры на 10oС скорость реакции возрастает в 2 ... 4 раза.
|
|
или |
|
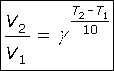
3. Концентрации реагентов. Чем больше концентрация реагирующих веществ, тем чаще их частицы соударяются, и тем больше скорость реакции. Для реакции aA + bB = dD, протекающей в одну стадию, скорость реакции v = k·(cA)a·(cB)b. Это выражение называется законом действующих масс для скорости реакции. Постоянная (при постоянной температуре) величина k называется константой скорости реакции. Она равна скорости реакции при единичных концентрациях реагентов.
4. Наличие катализатора. Катализатор — это вещество, влияющее на скорость химической реакции, но само при этом не изменяющееся. Одни катализаторы ускоряют ход реакции, другие — ингибиторы — замедляют реакцию. Катализаторы, ускоряющие реакции в живых организмах, называются ферментами. Паук впрыскивает в жертву ферменты. Ферменты ускоряют ход реакции и разлагают добычу паука. Действие катализатора основано на том, что он понижает энергию активации, т.е. минимальную энергию, необходимую для начала реакции. С катализатором реакция начинается легче. Катализатор — не какое-то особое вещество; это просто вещество, играющее определенную роль в реакции. Катализаторами часто бывают металлы. Каталитические нейтрализаторы, удаляющие ядовитые вещества из выхлопных газов, содержат два металла-катализатора — платину и родий. В каталитическом нейтрализаторе ядовитый угарный газ и углеводороды в присутствии металлов вступают в реакцию и образуют углекислый газ и воду.
Действие ферментов, как и других катализаторов, избирательно. Каждый фермент способствует только одному типу реакций. Разнообразные ферменты, имеющиеся в пищеварительной системе животных, ускоряют реакции, разлагающие пищу на составные части. Ученые считают, что дыра в озоновом слое атмосферырастет быстрее из-за хлора, действующего как катализатор и реакции разложения озона (О3) на кислород (О2). Хлор поступает в атмосферу при распаде хлорфторуглеродов.
5. Скорость гетерофазных реакций зависит также от состояния поверхности (например, чистая или загрязненная), характера образующихся продуктов (например, растворимы продукты или нет), условий подвода реагентов и отвода продуктов реакции (например, используется перемешивание, или нет). Если реакция протекает на границе газовой фазы и твёрдой (или жидкой) фазы, то на скорость реакции не влияют концентрации жидких и твердых веществ, а если на границе жидкой и твёрдой фазы, то - концентрации твердых веществ.