
- •«Российский государственный университет правосудия»
- •Цели и задачи курса
- •Глава 12. Химические реакции
- •Химические реакции
- •Как проходят реакции
- •Закон сохранения массы
- •Химические уравнения
- •Классификация химических реакций
- •2.По изменению степеней окисления реагентов
- •3.По тепловому эффекту реакции
- •4.По типу превращений реагирующих частиц
- •Скорость химической реакции
- •Вычисление скорости реакции вследствие изменения концентрации реагирующих веществ
- •Вычисление скорости реакции с газовыми компонентами вследствие изменения давления
- •Вычисление скорости реакции вследствие изменения температуры
- •Химическое равновесие
- •1. Вычисление константы химического равновесия
- •2. Вычисление равновесных концентраций по исходным концентрациям реагирующих веществ и наоборот
- •3. Смещение химического равновесия
- •Основная литература
- •Дополнительная литература
- •Интернет – источники
- •Приложение 1 Скорость химической реакции. Химическое равновесие
- •I вариант
- •II вариант
- •Приложение 2 Упражнения и задачи
- •Приложение 3 Задачи для самостоятельного решения
Вычисление скорости реакции вследствие изменения температуры
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
υ(t2) = υ(t1) · 0,1(t1 – t2)
где: υ(t2) – скорость реакции при температуре t2, до которой нагревалась или охлаждалась система; υ(t1) – скорость реакции при начальной температуре t1; – температурный коэффициент, который показывает во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10 °С (для большинства реакций = 2/4).
П р и м е р 1.
Во сколько раз увеличится скорость реакции при повышении температуры от 40 °С до 100 °С, принимая температурный коэффициент равным 2?
Дано:
t1= 40 °С
t2 = 100 °С
= 2
υ(t2) – ?
Решение:
В соответствии с правилом Вант-Гоффа находим, во сколько раз изменится скорость реакции при увеличении температуры:
υ(100°) = υ(40°) · 20,1(100 – 40) = υ(40°) · 26 = 64υ(40°).
При температуре 100 °С скорость реакции возрастает по сравнению со скоростью этой же реакции при 40 °С в 64 раза.
Ответ: Увеличится в 64 раза.
П р и м е р 2.
Реакция при температуре 50 °С протекает за 2 мин 15 с. За какой период времени закончится эта реакция при температуре:
а) 70 °С;
б) 30 °С, если температурный коэффициент реакции равен 3?
Дано:
t1= 2 мин 15 с =135 с
= 3
а) t2 = 70 °С
б) t2 = 30 °C
Решение:
а) Находим скорость реакции при 70 °С:
υ(70°) = υ(50°) · 30,1(70 – 50) = υ(50°) · 32 = 9υ(50°)
Скорость реакции при повышении температуры на 20 °С выше начальной возрастет в 9 раз.
С другой стороны, скорость реакции обратно пропорциональна времени протекания реакции, следовательно, при 70 °С время протекания реакции сократится в 9 раз.
t2 = t1/9 = 135 c/9 = 15 с.
б) Рассчитаем, во сколько раз скорость реакции при 50 °С превышает скорость той же реакции при 30 °С:
υ(50°) = υ(30°) · 30,1(50 – 30) = υ(30°) · 32 = 9υ(30°).
Скорость реакции при 30 °С в 9 раз меньше скорости реакции при 50 °С, следовательно, время ее протекания в 9 раз больше:
t2 = t1 · 9= 135 c · 9 = 1215 с = 20 мин 15 с.
Ответ: а) 15 с;
б) 20 мин 15 с.
П р и м е р 3.
При температуре 30 °С реакция протекает за 25 мин, при 50 °С – за 4 мин. Рассчитать температурный коэффициент реакции.
Дано:
t1 = 30 °С
t2 = 50 °С
t1 = 25 мин
t2 = 4 мин
– ?
Решение:
Исходим из соотношения (1.3):
υ(50°) = υ(30°) · 0,1(50 – 30) = υ(30°)2
=
 .
.
Поскольку скорость реакции есть обратная величина времени протекания реакции, рассчитываем температурный коэффициент реакции:
=
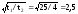
Ответ: = 2,5.
Химическое равновесие
Химические реакции, в результате которых исходные вещества полностью превращаются в продукты реакции, называют необратимыми. Реакции, продукты которых в тех же условиях способны реагировать друг с другом, образуя исходные вещества, называют обратимыми. Реакцию между исходными веществами называют прямой, ее скорость обозначается υ→. Реакцию между образовавшимися веществами называют о б р а т н о й, ее скорость обозначается υ←. В соответствии с законом сохранения масс в начальный момент времени величина скорости прямой реакции имеет максимальное значение, тогда как величина скорости обратной реакции равна нулю. Со временем концентрация исходных веществ уменьшается, а концентрация продуктов реакции, напротив, возрастает. Как следствие, уменьшается скорость прямой реакции и растет скорость обратной реакции. В тот момент, когда обе скорости становятся равными, система переходит в равновесное состояние. Молярные концентрации участвующих в реакции веществ перестают изменяться, их называют равновесными, обозначая [ ]р.
Например, для гомогенной реакции 2SO2 + О2 = 2SО3:
υ→ = k→[SО2]2[О2] и υ← = k←[SО3]2.
С наступлением химического равновесия: υ→ = υ←
k→[SO2]2р [O2]р = k←[SOз]2р
Кх·р = k→/k← = [SO3] 2p / [SO2]2p [O2]p,
где: Кх·р – константа химического равновесия;
[SO2]р, [O2]p, [SO3]р – молярное равновесие концентрации.
При величине Кх·р > 1 выход продуктов реакции большой; при Кх·р < 1 выход продуктов реакции незначителен.
