
- •Справочник работника газовой промышленности
- •1.2. Физические свойства газов Плотность газа
- •Удельный объем
- •Физические свойства углеводородных газов
- •Физические свойства некоторых неуглеводородных газов
- •Расход газа
- •Линейная и массовая скорость газа
- •Давление газа
- •Идеальные и реальные газы
- •Закон Бойля-Мариотта
- •Закон Гей-Люссака
- •Уравнение Клапейрона
- •Закон Авогадро
- •Критические параметры газов
- •Влажность газов
- •Смеси газов
- •Горение газов
- •Минимальное количество кислорода или воздуха, необходимое для полного сгорания газов, и продукты сгорания (в мна 1 м)
- •Наивысшая температура пламени различных газов
- •Концентрационные пределы взрываемости газов в смеси с воздухом при температуре окружающей среды 20 °с и 0,1013 мПа
- •Концентрация газа в газовоздушной смеси в зависимости от содержания кислорода
- •Теплота сгорания газов
- •Глава 2 показатели транспорта газа
- •Технические показатели магистральных газопроводов с кс, оснащенных различными газоперекачивающими агрегатами (гпа)
- •Удельные капитальные вложения (в тыс. Руб.) в строительство 1 км магистральных газопроводов
- •Капитальные вложения при сооружении кс
- •Глава 3 подготовка газа к транспорту
- •3.1. Очистка газа от механических примесей
- •Допустимые скорости газа в сепарационных узлах масляного пылеуловителя с жалюзийной скрубберной секцией
- •Техническая характеристика масляных пылеуловителей
- •Техническая характеристика пылеуловителя гп604
- •3.2. Осушка газа и борьба с гидратообразованием на магистральных газопроводах
- •3.3. Осушка газа твердыми поглотителями
- •3.4. Осушка газа жидкими поглотителями
- •Свойства химически чистых гликолей
- •Технические условия на товарные гликоли, выпускаемые отечественной промышленностью
- •Значения точек росы (в °с) влажных природных углеводородных газов
- •3.5. Низкотемпературная сепарация
- •Глава 4 транспорт газа
- •4.1. Основные понятия и формулы
- •Вспомогательные данные для гидравлического расчета газопровода
- •4.2. Упрощенный гидравлический расчет многониточного газопровода
- •Коэффициенты расхода для газопроводов разного диаметра по отношению к газопроводам с условным диаметром , равным 700, 1000 и 1200 мм
- •Практические формулы для гидравлического расчета магистральных газопроводов
- •Пропускная способность однониточных газопроводов разного диаметра
- •Коэффициент гидравлического сопротивления для газопроводов разных диаметров, эффективностии коэффициента
- •Прокладка лупинга
- •Пропускная способность магистрального газопровода при поэтапном сооружении кс
- •Значения коэффициента гидравлической эффективности при развитии газопровода
- •4.3. Гидравлический расчет многониточного магистрального газопровода с помощью номограмм
- •4.4. Расчет гидравлических потерь в местных сопротивлениях
- •Значения коэффициентов а и для наиболее распространенных на газопроводах местных сопротивлений (арматуры)
- •Коэффициент местного сопротивления гнутых труб 90°
- •Местные сопротивления тройников
- •4.5. Аккумулирующая способность и время опорожнения газопровода
- •Геометрический объем газопровода длиной 1 км
- •Определение времени опорожнения газопровода
- •4.6. Определение суточной потери газа при истечении его из отверстия в теле трубы
- •Молекулярная масса газов
- •4.7. Тепловой расчет магистрального газопровода Основные формулы и номограммы
- •Значения величины
- •Температура грунта (в °с) на различных глубинах в некоторых пунктах ссср
- •Температура воздуха (в °с) в различных пунктах ссср
- •Определение некоторых параметров, входящих в формулы теплового расчета
- •Расчетные значения теплофизических характеристик талых и мерзлых грунтов
- •4.8. Продувка и очистка полости газопровода
- •Конструктивные схемы очистных устройств
- •Глава 5 компрессорные станции
- •5.1. Электроприводные и газотурбинные кс
- •Техническая характеристика гпа с газотурбинным приводом
- •Техническая характеристика гпа с электроприводом
- •5.2. Расчет режима работы кс с центробежными нагнетателями
- •5.3. Определение основных параметров газотурбинных установок на основе обобщенных характеристик
- •5.4. Расчет располагаемой мощности гту при планировании режима работы кс
- •Параметры и коэффициенты для определения индивидуальных норм затрат топливного газа и поправочных коэффициентов к нормам
- •Расчетное давление воздуха является функцией расположения кс над уровнем моря:
- •5.5. Определение мощности на муфте нагнетатель - гту по параметрам сжимаемого газа
- •5.6. Определение расхода топливного газа для гту
- •5.7. Нормирование затрат природного газа на собственные нужды газотурбинных цехов
- •Индивидуальные нормы затрат топливного газа
- •Значения коэффициента , учитывающего влияние температуры атмосферного воздуха и загрузки гпа
- •Исходные индивидуальные нормы затрат топливного газа
- •Затраты природного газа на технологические нужды компрессорного цеха и потери
- •Потери газа в коммуникациях компрессорных цехов
- •Индивидуальные нормы затрат природного газа на технологические нужды и потери
- •Параметры расчета исходных индивидуальных норм затрат газа на технологические нужды и технические потери
- •Исходные индивидуальные нормы затрат (в м/(кВт·ч)) природного газа на технологические нужды и технические потери кц
- •5.8. Нормирование расхода энергоресурсов на кс при планировании режимов работы газопроводов с учетом коэффициентов эксплуатационных надбавок
- •Индивидуальная норма расхода топлива , кг у.Т/(кВт·ч)
- •Надбавки к нормируемому расходу энергетических ресурсов
- •Зависимость надбавки к нормируемому расходу топлива от среднемесячной температуры окружающего воздуха t
- •Эксплуатационные надбавки ,к индивидуальным нормам расхода топлива для газотурбинных гпа, %
- •Эксплуатационные надбавки для газомотокомпрессоров, %
- •Эксплуатационные надбавки ,к индивидуальным нормам расхода электроэнергии по типам электроприводных гпа, %
Закон Авогадро
Закон Авогадро сформулирован следующим образом: объем одного киломоля идеального газа не зависит от природы газа и определяется параметрами физического состояния газа (давление и температура).
Киломолем, или килограмм-молекулой,
называется число килограммов вещества,
численно равное его молекулярной массе
![]() .
.
Объем 1 киломоля идеальных
газов по уравнению Клапейрона
![]() .
По закону Авогадро правая часть этого
выражения не зависит от природы газа,
поэтому произведение молекулярной
массы
.
По закону Авогадро правая часть этого
выражения не зависит от природы газа,
поэтому произведение молекулярной
массы![]() ,
и газовой постоянной
,
и газовой постоянной![]() не зависит от природы газа и является
универсальной постоянной идеальных
газов:
не зависит от природы газа и является
универсальной постоянной идеальных
газов:![]() =
const.
=
const.
Уравнение состояния для 1
киломоля идеального газа
![]() .
.
В настоящее время принята
следующая расчетная величина -
универсальная постоянная идеальных
газов
![]() =
8,3144·10
=
8,3144·10![]() Дж/(кмоль·К).
Дж/(кмоль·К).
Молярный объем идеальных
газов в нормальных физических условиях
равен
![]() =
22,4 м
=
22,4 м![]() /кмоль.
/кмоль.
Расчетные значения удельных
газовых постоянных идеальных газов
определяют по универсальной газовой
постоянной. Для реальных газов составлено
большое число уравнений состояния.
Наиболее распространено уравнение
Клапейрона с поправочным коэффициентом
![]() ,
где
,
где![]() - коэффициент сжимаемости, учитывающий
отклонение реальных газов от законов
идеальных газов. Его определяют по
графикам (рис. 1.1) в зависимости от
приведенных параметров (температура и
давление) газа:
- коэффициент сжимаемости, учитывающий
отклонение реальных газов от законов
идеальных газов. Его определяют по
графикам (рис. 1.1) в зависимости от
приведенных параметров (температура и
давление) газа:![]() ,
,![]() ,
где
,
где![]() - приведенное давление;
- приведенное давление;![]() -
абсолютное давление газа;
-
абсолютное давление газа;![]() - критическое давление газа;
- критическое давление газа;![]() - приведенная температура;
- приведенная температура;![]() -
абсолютная температура газа;
-
абсолютная температура газа;![]() - критическая температура газа.
- критическая температура газа.
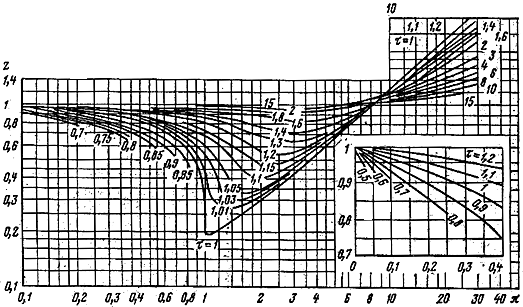
Рис. 1.1. Зависимость
коэффициента сжимаемости газов
![]() от приведенных давления
от приведенных давления![]() и температуры
и температуры![]()
Критическим давлением называется такое давление, при котором и выше которого повышением температуры нельзя испарить жидкость.
Критическая температура - это такая температура, при которой и выше которой при повышении давления нельзя сконденсировать пар (табл. 1.4).
Таблица 1.4
Критические параметры газов
|
#G0Газ |
|
|
|
|
Азот
|
126,05 |
3,39 |
311 |
|
Аммиак
|
405,55 |
11,3 |
235 |
|
Аргон
|
150,75
|
4,86
|
531
|
|
Ацетилен
|
309,15
|
6,24
|
231
|
|
Бензол
|
561,65
|
4,84
|
304
|
|
н-Бутан
|
425,95 |
3,6 |
225 |
|
изо-Бутан
|
407,15
|
3,7
|
234
|
|
изо-Бутилен
|
420,35 |
4,06 |
256 |
|
Водород
|
33,25
|
1,3
|
31
|
|
Водяной пар
|
647,3
|
21,77
|
324
|
|
Воздух
|
132,45
|
3,78
|
335
|
|
Гелий
|
5,25
|
0,23
|
69,3
|
|
Гексан
|
38,35
|
3,05
|
234
|
|
Гептан
|
6,35 |
2,68 |
234 |
|
Двуокись серы
|
430,35
|
8,05
|
524
|
|
Двуокись углерода
|
304,25 |
7,54 |
468 |
|
Закись азота
|
309,65 |
7,41 |
450 |
|
Кислород
|
154,35 |
5,14 |
430 |
|
Метан
|
190,65
|
4,74
|
162
|
|
Окись азота
|
179,15
|
6,72
|
520
|
|
Окись углерода
|
134,15 |
3,62 |
311 |
|
изо-Пентан
|
460,95 |
3,39 |
234 |
|
н-Пентан
|
470,35
|
3,41
|
232
|
|
Пропан
|
368,75
|
4,49
|
226
|
|
Пропилен
|
365,15
|
4,68
|
233
|
|
Сероводород
|
373,55
|
9,18
|
359
|
|
Этан
|
305,25 |
5,04 |
210 |
|
Этилен
|
282,85
|
5,26
|
220
|
