
часть 1
.pdf
m |
|
RT |
|
||
P |
|
P |
|
const . |
|
|
|
|
|
||
Перенесём постоянные m |
R |
|
|
|
|
|
|
||||||||||||||||
|
в правую часть, тогда получим: |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P 1 |
T |
|
const . |
|
|
|
|
|
|
|
||||||||||||
Распишем для нашей ситуации: |
|
|
|
|
|
||||||||||||||||||
|
P 1 |
T |
|
P 1 |
T , |
|
|
|
|
|
|
|
|||||||||||
|
|
1 |
|
|
|
1 |
|
|
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
найдём отношение температур: |
|
|
|
|
|
||||||||||||||||||
T |
2 |
|
|
|
|
P |
1 |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
||||||||||
T |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
1 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|||||
или известная формула: |
|
|
|
|
|
|
|
||||||||||||||||
T |
|
|
|
|
P |
|
|
|
1 |
|
|
|
|
|
|
|
|
||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
1 |
|
. |
|
|
|
|
|
|
|
|
|||||||||
|
T |
P |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
1 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Откуда конечная температура: |
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
P |
1 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
T |
|
|
T |
|
|
|
|
2 |
|
. |
|
|
|
|
|
|
|
||||||
2 |
|
P |
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
Подставим численные значения: |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 3 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
105 4 3 |
|
|
1/ 3 |
1 |
|
|
|
||||
T2 |
290 |
|
|
|
|
|
290 |
2 4 / 3 290 2 4 290 |
|
2 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
105 |
|
|
|
|
|
|
|
|
||||
290 1,1892 344,87 345(К) . |
|
|
|
|
|||||||||||||||||||
Ответ: T2 |
345K. |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Домашнее задание № 1 |
|
|
|
||||
Определить удельную теплоемкость cv |
смеси газов, содержащей V1 5л во- |
||||||||||||||||||||||
дорода и V2 |
3л гелия. Газы находятся при одинаковых условиях. |
||||||||||||||||||||||
61
|
|
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
СИ: |
|
|
|
|
|
|
|
|
|
|
|
|
Решение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
V1 |
5л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 10 3 м3 |
|
|
|
|
|
|
|
|
|
|
|
1й способ. Удельная теплоёмкость газа |
|||||||||||||||||||||||||||||||||||||||||||||||
V2 |
3л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 10 3 м3 |
|
|
|
|
связана с теплоёмкостью любой массы газа |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
1 |
2 10 3 |
|
|
|
кг |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
следующим соотношением: |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c m . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
4 10 3 |
|
|
|
кг |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таким образом, удельная теплоёмкость смеси: |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
2 |
|
|
|
моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ссм |
|
C1 C2 . |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
i1 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cсм |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
i2 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
mсм |
|
|
m1 m2 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Теплоёмкости |
газов |
|
водорода и гелия |
||||||||||||||||||||||||||||||||||||||
P1 |
P2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
при постоянном объёме: |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
T1 |
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
m i1 |
|
R |
|
|
и C |
|
|
m |
|
i2 |
|
R |
. |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
cv |
? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
1 |
2 |
|
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
2 |
2 |
|
2 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Подставим их: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m i1 |
|
|
|
R |
m |
|
i2 |
|
|
R |
|
|
|
|
|
|
i |
m1 i |
|
|
m2 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
2 |
|
|
|
|
|
|
|
R |
|
|
|
|
|
(1) |
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
|
|
|
|
2 |
|
2 |
|
|
|
|
1 |
|
|
1 |
|
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
cсм |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m1 m2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m1 m2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
Применим уравнение Менделеева – Клапейрона для водорода и гелия и |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
выразим из них массы газов m |
|
|
и m |
|
, а так же m1 и m2 |
: |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
m1 |
|
|
|
|
|
|
|
|
|
|
|
|
m1 |
|
|
|
P V |
|
|
|
|
|
|
|
|
|
|
|
m1 |
|
|
|
|
P V1 |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
P V1 |
|
|
|
|
|
|
|
|
|
|
R T |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
R T |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
m2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
P V |
|
|
|
|
|
R T |
|
|
|
|
m |
|
|
|
|
P V2 |
|
2 |
|
|
|
|
|
|
P V2 |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
T |
|
|
|
|
|
|
R |
|
|
|
2 |
|
|
|
|
R T |
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
Подставим их в формулу (1) и сократим на |
|
P |
|
: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
R T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
i |
|
P V1 |
i |
|
|
|
|
P V2 |
|
|
|
|
R |
|
|
|
|
i1 V1 i2 V2 |
|
|
|
|
|
R . |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
R T |
|
|
|
R T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
cсм |
|
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V V |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
P V1 |
|
|
|
|
P V2 |
|
2 |
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
R |
|
|
|
|
T |
|
|
|
R |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Подставим численные значения:
62

cv |
5 5 10 3 |
3 3 10 3 |
|
8,31 |
|
34 10 |
3 |
|
8,31 |
|
||
5 10 3 |
2 10 3 |
3 10 3 4 10 3 |
2 |
22 10 |
6 |
2 |
||||||
|
|
|
|
|
||||||||
6,42 103 6,42 кДж .
кг К
2й способ. Удельную теплоёмкость cv при постоянном объёме найдём следующим образом. Теплоту, необходимую для нагревания смеси на T , выразим двумя способами:
Q cv |
(m1 |
m2 ) T |
, |
|
m1 T cv 2 m2 T |
||
Q cv1 |
|
||
где cv – удельная теплоёмкость смеси, cv1 – удельная теплоёмкость водорода, cv 2 – удельная теплоёмкость гелия.
Приравняв правые части и разделив обе части полученного равенства на T , получим:
cv (m1 m2 ) cv1 m1 cv 2 m2 . Отсюда:
cv |
cv1 m1 cv 2 m2 |
. |
(2) |
|
|||
|
m1 m2 |
|
|
Удельные теплоёмкости при постоянном объёме водорода и гелия соотве т- ственно:
cv1 |
i1 |
|
R |
, |
cv2 |
i2 |
|
R |
. |
1 |
|
||||||||
|
2 |
|
|
|
2 |
|
2 |
||
Применим уравнение Менделеева – Клапейрона для водорода и гелия и выразим из них массы газов:
|
P V |
|
m1 |
|
|
|
|
|
|
||
|
1 |
|
|||
1 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
m2 |
|
P V2 |
|
|
|||
|
|
||||
|
|
|
|
2 |
|
|
|
|
|
|
|
R T |
|
|
P V1 |
|
|
1 |
|
|
|
||
|
m1 |
|
T |
|
|
R |
. |
||||
|
|
|
|
P V2 |
|
|
|
|
|||
R T |
|
|
|
|
|
|
2 |
|
|||
m2 |
|
|
|
|
|
|
|
|
|||
|
T |
|
|
R |
|||||||
|
|
|
|
|
|
|
|||||
Подставим m1 и m2 в формулу (2) и сократим на RPT :
63

|
|
cv1 |
P V1 |
|
1 |
cv 2 |
|
P V2 |
|
2 |
|
|
|
|
cv1 V1 1 cv 2 V2 2 |
|
|
||||||||||||||||||||
cv |
|
|
T |
R |
|
|
T |
R |
|
|
|
. |
|
||||||||||||||||||||||||
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
V1 1 V2 2 |
|
|
|
|
|
|
|
V1 1 V2 2 |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
R |
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Подставим cv1 и cv 2 : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
i1 |
|
R |
|
|
|
|
|
i2 |
|
R |
V2 2 |
|
i |
V1 R |
i |
|
|
|
|
|
|
|
|
|
|||||||||||
cv 2 |
1 V1 1 |
2 |
2 |
2 |
2 V2 R i1 V1 i2 V2 R . |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
||
|
|
|
|
|
|
|
|
V1 1 V2 2 |
|
|
|
|
|
|
|
|
|
V1 1 V2 2 |
|
|
|
V1 1 V2 2 |
|||||||||||||||
Подставим численные значения: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
cv |
|
|
|
|
|
5 5 10 3 |
3 3 10 3 |
|
|
|
|
|
|
|
8,31 |
|
34 10 |
3 |
|
8,31 |
|
||||||||||||||||
5 10 3 |
2 10 3 |
3 10 3 4 10 3 |
|
|
2 |
22 10 |
6 |
2 |
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
6,42 103 6,42 кДж .
кг К
Ответ: cv 6,42 кДж .
кг К
Домашнее задание № 2
Азот массой m 200г расширяется изотермически при температуре T 280К , причем объем газа увеличивается в два раза (рис.8). Найти: 1) изменение U внутренней энергии газа; 2) совершенную при расширении газа работу A; 3) количество теплоты Q , полученное газом.
|
Дано: |
|
СИ: |
|
Решение: |
|
|
|
V2 , TU |
||||
|
|
|
|
|
|
||||||||
m 200г |
|
0,2кг |
|
1. Изменение |
|
|
внутренней |
||||||
T 280К const |
|
|
|
энергии: |
|
|
|
|
|
A |
|||
V2 2V1 |
|
|
|
U m cv T 0 , так как |
|
|
|||||||
|
|
|
|
||||||||||
28 10 3 |
кг |
|
|
|
T const . |
|
|
|
|
|
|
|
|
моль |
|
|
|
2. Элементарная |
|
работа и |
|
||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
давление |
|
|
из |
уравнения |
Q |
|||
1. |
U ? |
|
|
|
|
|
|||||||
2. |
A ? |
|
|
|
Менделеева – Клапейрона:: |
рис.8 |
|||||||
3. |
Q ? |
|
|
|
dA P dV |
|
|
||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
m |
|
R |
T . |
|
||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
P |
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
64
Тогда элементарная работа: dA m R T dVV .
Проинтегрируем:
A |
m |
V2 |
dV |
|
m |
R T ln |
V2 |
. |
|
R T |
V |
|
V |
||||
|
V |
|
|
|
||||
|
|
1 |
|
|
|
|
1 |
|
Подставим численные значения:
A |
0,2 |
|
8,31 280 ln 2 16,62 103 |
0,693 11,52 103 ( Дж) . |
|
28 10 |
3 |
||||
|
|
|
3. Первое начало термодинамики для конечного состояния системы:
Q U A .
Учтём, что U 0 , тогда:
Q A 11,52 103 ( Дж).
Ответ: U 0, A 11,52кДж, Q 11,52кДж.
Домашнее задание № 3
Кислород массой m 2кг занимает объем V1 1м3 и находится под давлени-
ем P1 0,2МПа . Газ был нагрет сначала при постоянном давлении до объема |
|||||||||||||
V 3м3 , а затем при постоянном объеме до д авления P 0,5МПа . Найти: |
|||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
1)изменение U внутренней энергии газа; 2) совершенную им раб оту A; 3) |
|||||||||||||
количество теплоты Q , переданное газу. Построить график процесса. |
|||||||||||||
|
Дано: |
|
СИ: |
|
|
Решение: |
|
||||||
|
|
|
|
||||||||||
m 2кг |
|
|
|
1. |
Изменение внутренней энергии: |
||||||||
V 1м3 |
|
|
|
|
|
|
|
|
|
|
|
||
1 |
|
|
|
|
|
|
|
|
|
|
i |
m R T |
|
P1 0,2МПа |
|
2 105 Па |
|
|
U m cv T |
||||||||
|
|||||||||||||
P1 P2 |
|
|
|
|
|
|
|
|
2 |
|
|||
V 3м3 |
|
|
|
|
|
i |
|
m |
R T3 T1 , |
|
|||
2 |
V2 |
|
|
|
|
|
|
|
|||||
V3 |
|
5 105 Па |
|
|
|
2 |
|
|
|
|
|||
P 0,5МПа |
|
|
|
где i 5 число степеней свободы кислорода, |
|||||||||
3 |
|
|
|
|
|
||||||||
1. |
U ? |
|
|
|
2х атомный газ. |
|
|||||||
2. |
A ? |
|
|
|
|
Применим уравнение Менделеева – Клапей- |
|||||||
3. |
Q ? |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
65
рона. Выразим из него температуру для начального T1 и конечного состояний
T3 : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
P1 V1 |
|
, |
|
T |
|
|
P3 V3 |
, |
|
|
|
|
|
|
|
|||||
1 |
|
m R |
|
|
|
3 |
|
m R |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Подставим эти выражения, вынесем за скобки |
|
|
|
и сократим его, то- |
|||||||||||||||||
m R |
|
||||||||||||||||||||
гда изменение внутренней энергии процесса 1→2→3 (рис.9): |
|||||||||||||||||||||
U |
i |
|
R m |
P V |
|
P V |
|
|
|
i |
P V |
|
P V . |
||||||||
|
|
3 |
m R |
|
3 |
||||||||||||||||
|
|
2 |
|
3 |
|
1 |
1 |
2 |
3 |
|
1 |
1 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Подставим численные значения: |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
U |
5 |
5 105 |
3 2 105 1 32,5 105 ( Дж) . |
|
|
|
|
|
|||||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Работа газа процесса 1→2→3 состоит из суммы процессов 1→2 и 2→3:
A A1,2 A2,3 . |
|
|
|
1 |
|
|
2 P V |
|
|||||
Процесс 1→2 изобарный p const , работа равна: |
P |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
P V |
|
V 2 105 |
3 1 4 105 ( Дж) . |
|
PV |
|
2 |
|
2 |
|||
2 |
|
1 |
|
|
|
||||||||
1,2 |
1 |
|
1 |
|
|
|
1 |
|
|
|
|
||
Процесс 2→3 изохорный V const , работа равна: |
|
|
|
|
3 P3V3 |
||||||||
A2,3 |
P2 V3 |
V2 0 . |
|
|
|
Рис. 9 |
|
V |
|||||
Тогда полная работа процесса 1→2→3 равна: |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|||||||
A A |
A A |
4 105 |
( Дж) . |
|
|
|
|
|
|
|
|||
|
1,2 |
2,3 |
1,2 |
|
|
|
|
|
|
|
|
|
|
3. Первое начало термодинамики для конечного состояния системы при переходе из состояния 1 в состояние 2:
Q U A 2i p3 V3 p1 V1 p1 V2 V1 . Подставим численные значения:
Q 32,5 105 4 105 36,5 105 ( Дж) .
Ответ: U 3,25МДж, A 0,4МДж, Q 3,65МДж.
66

|
|
|
|
|
Домашнее задание № 4 |
|
||||
Азот, занимавший объем V1 10л под давлением P1 |
0,2МПа изотермически |
|||||||||
расширился до объема V2 |
28л . Определить работу A расширения газа. |
|||||||||
Дано: |
|
СИ: |
|
|
Решение: |
|
|
|||
|
|
|
|
|||||||
|
|
|
Элементарная работа и давление из урав- |
|||||||
V1 10л |
|
10 2 м3 |
|
|
||||||
P 0,2МПа |
|
2 105 Па |
|
|
нения Менделеева – Клапейрона:: |
|||||
1 |
|
|
|
|
dA P dV |
|
||||
T const |
|
|
|
|
|
|||||
|
|
|
|
|
m |
|
R T . |
|
||
V2 28л |
|
28 10 3 м3 |
|
|
|
|
|
|||
|
|
|
P |
|
|
V |
|
|||
|
|
|
|
|
|
|
|
|
||
A ? |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тогда элементарная работа: dA m R T dVV .
Проинтегрируем:
|
m |
V2 |
dV |
|
m |
|
V2 |
|
|
A |
|
R T |
|
|
|
R T ln |
|
. |
|
V |
V |
||||||||
|
V1 |
|
|
|
|||||
|
|
|
|
|
|
|
1 |
|
Применим уравнение Менделеева – Клапейрона для начального состояния:
P1 V1 m R T
и заменим правую часть, тогда работа:
A P1 V1 ln VV2 .
1
Подставим численные значения:
A 2 105 10 2 ln 2,8 2 103 1,0296 2,06 103 ( Дж) .
Ответ: A 2,06кДж.
67
Занятие № 4 «Круговые процессы. Термический КПД. Цикл Карно. Э н- тропия»
Рекомендуемое задание № 1
Совершая замкнутый процесс, газ получил от нагревателя количество тепл о-
ты Q1 4кДж . Определить работу |
A газа при протекании цикла, если его |
|||||||||
термический к.п.д. 0,1. |
|
|
|
|
|
|
||||
Дано: |
|
Си: |
|
|
Решение: |
|
|
|
||
|
|
|
|
|
||||||
Q1 4кДж |
|
4 103 Дж |
|
|
Термический |
КПД (коэффициент полезного |
||||
0,1 |
|
|
|
действия) определяется по формуле: |
||||||
|
|
|
|
|
|
Q1 Q2 |
|
A |
||
A ? |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
, |
||
|
|
|
|
|
|
Q |
Q |
|||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
1 |
|
1 |
|
откуда работа газа за цикл: |
|
|
|
|
|
|
||||
A Q 0,1 4 103 |
400( Дж) . |
|
|
|
||||||
|
1 |
|
|
|
|
|
|
|
|
|
Ответ: A 400 Дж.
Рекомендуемое задание № 2
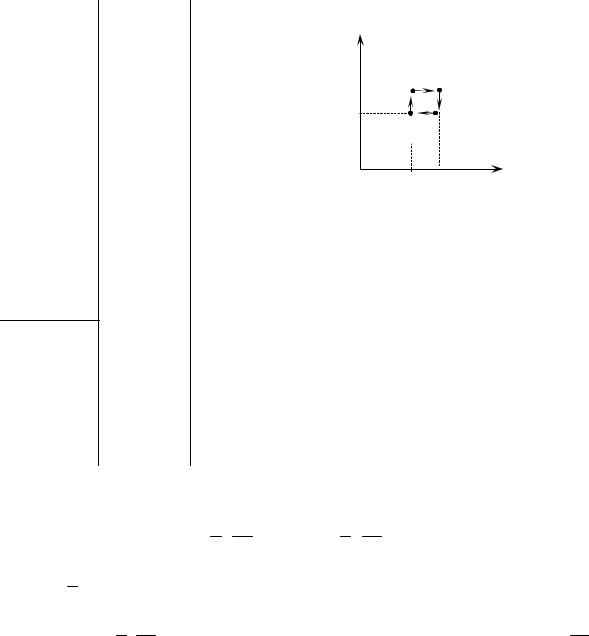
Идеальный двухатомный газ, содержащий количество вещества 1кмоль , совершает замкнутый цикл, график которого изображен на рис.1. Опред е- лить: 1) количество теплоты Q1 , полученное от нагревателя; 2) количество теплоты Q2 , переданное охладителю; 3) работу A, совершаемую газом за цикл; 4) термический к.п.д. цикла.
68
|
Дано: |
Си: |
1кмоль |
103 моль |
|
i 5 |
|
|
P1 |
12кПа |
12 103 Па |
P 16кПа |
16 103 Па |
|
2 |
|
|
V 2м3 |
|
|
1 |
|
|
V1 |
V2 |
|
V3 |
3м3 |
|
V3 |
V4 |
|
P1 P4 |
|
|
P2 |
P3 |
|
1.Q1 ?
2.Q2 ?
3.A ?
4.?
Решение:
P,кПа
20 |
| | |
2 |
|
|
|
3 |
|
16 |
|
|
|
|
|||
| |
|
|
|
|
|
|
|
12 |
| |
1 |
|
|
|
4 |
|
|
| |
|
|
|
|
||
5 |
| |
|
|
|
|
|
|
|
| |
| |
| |
| |
V , м3 |
||
|
1 |
2 |
3 |
4 |
|||
рис.1
1.Газ получает количество теплоты Q1 на 2х участках (рис.1): Q12 на участке 1→2 (изохорный процесс) и Q23 2→3 (изобарный процесс), т.е.:
Q1 Q12 Q23 .
Количество теплоты, полученное газом на участке1→2:
Q12 m cV Т m 2i MR T2 T1 2i Mm R T2 T12i R T2 T1 ,
где cV 2i MR - удельная теплоёмкость при постоянном объёме, Mm
- количество вещества. Начальную температуру найдём из уравнения Менделеева – Клапейрона:
P V R T T |
P1 V1 |
. |
|||
|
|||||
1 |
1 |
1 |
1 |
R |
|
|
|
|
|
||
Аналогично получим
Т 2 |
|
P2 |
V2 |
. |
(1) |
|
|
||||
|
|
R |
|
||
69

Тогда количество теплоты процесса 1 →2:
Q |
|
|
|
i |
R P P |
|
|
|
V2 |
|
|
i |
|
V |
|
P P . |
|
|
|
|
||||||||||||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
1,2 |
|
|
|
|
|
2 |
|
1 |
|
|
|
R |
2 |
|
|
|
|
2 |
2 |
1 |
|
|
|
|
|
|||||||||||||||
Подставим численные значения: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
Q |
|
|
|
5 2 (6 12) 103 |
|
20 103 ( Дж) , |
|
|
|
|
|
|
||||||||||||||||||||||||||||
1,2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
знак «+» подтверждает, что на этом участке газ получает количество |
||||||||||||||||||||||||||||||||||||||||
теплоты. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Количество теплоты, полученное газом на участке 2→3: |
|
|||||||||||||||||||||||||||||||||||||||
Q mc Т |
m |
i 2 R T T |
i 2 R T T , |
|
|
|
|
|
||||||||||||||||||||||||||||||||
23 |
|
|
P |
|
M 2 |
|
|
|
|
3 |
|
|
|
2 |
|
2 |
|
|
|
|
|
3 |
2 |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
где cP |
i 2 |
|
|
R |
|
- удельная теплоёмкость при постоянном давлении. |
||||||||||||||||||||||||||||||||||
|
M |
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Из закона Гей-Люссака найдём температуру T3 : |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
V3 |
T3 |
V3 |
T2 . |
|
|
|
|
|
(2) |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
T |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
2 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
С учётом формулы (1) температура T3 : |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
T3 |
V3 |
|
|
P2 |
V2 |
|
|
V3 P2 |
, |
|
|
|
|
(3) |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
|
|
R |
|
|
|
|
|
|
|||||||||||||||
т.е. количество теплоты, с учётом формулы (2): |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
Q |
|
|
i 2 |
|
R T |
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
23 |
|
|
|
|
|
|
3 |
|
1 , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
с учётом формулы (1) количество теплоты процес са 2→3: |
|
|||||||||||||||||||||||||||||||||||||||
|
|
i 2 R |
P V |
2 |
|
|
|
|
V |
3 |
|
|
|
i 2 P |
V |
|
|
|
. |
|||||||||||||||||||||
Q |
|
|
2 |
|
|
|
|
|
1 |
|
V |
|
||||||||||||||||||||||||||||
23 |
|
|
|
|
|
|
|
|
|
3 |
2 |
|||||||||||||||||||||||||||||
|
|
|
2 |
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
Подставим численные значения: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
Т3 3 16 103 |
|
5,78(К ) . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
103 8,31 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Q2,3 |
|
|
7 16 103 1 56 103 ( Дж) . |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70
