
Лекции Дет. модели. Часть 1
.pdf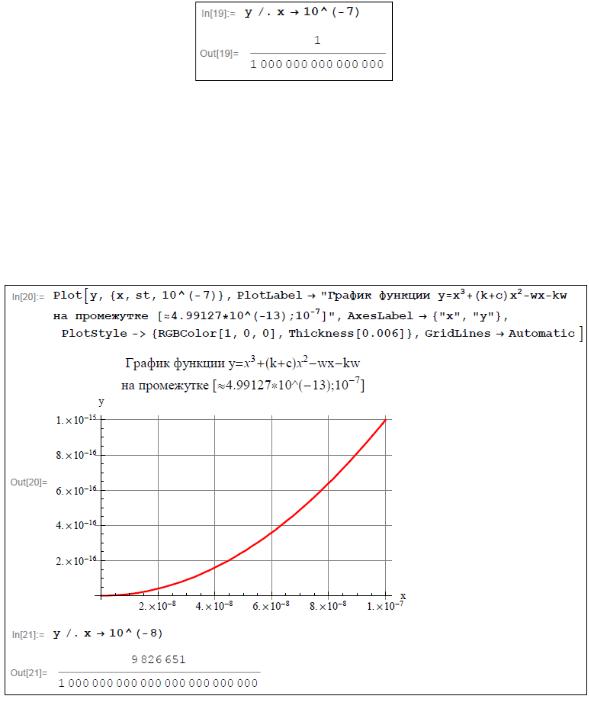
Значение функции в точке минимума является отрицательным. Вычислим значение функции в точке x=10-7. Этому значению аргумента соответствует ситуация, когда гидролиз отсутствует.
Получили положительное значение. Итак, принимая во внимание исследование функции при помощи ее первой производной, можно сделать
вывод, что на отрезке [10-14;1] уравнение x3 k c x2 wx wk 0 имеет единственный вещественный корень, который принадлежит отрезку [st; 10-7]. Процедура отделения корней уравнения, принадлежащих отрезку [10-14;1], завершена.
Построим график функции y x3 k c x2 wx wk на промежутке
[st; 10-7].
Из последнего графика ясно, что интересующий нас корень уравнения (2.3.6) находится на промежутке [st; 10-8]. Найдем его приближенное значение с недостатком и с избытком, так чтобы по модулю разность
этих значений была меньше указанной в задаче точности 2 10 9.
41

Применим такие методы приближенного решения конечных уравнений, как метод хорд и метод касательных (Ньютона). В компьютерной системе Mathematica эти методы реализуются посредством встроенной функции FindRoot. Чтобы задать аргументы этой встроенной функции, не-
обходимо провести исследование функции y x3 k c x2 wx wk при помощи ее второй производной.
График функции является вогнутым на промежутке [st; 10-8]. Следовательно, согласно исследованию функции при помощи ее первой и второй производных можно заключить, что на указанном отрезке метод хорд будет давать приближенное значение корня уравнения (2.3.6) с недостатком, а метод касательных – с избытком. Найдем эти значения и проверим, удовлетворяют ли они заданной в задаче точности.
Требуемая в задаче точность вычислений 2 10 9 не достигнута. Повторим вычисления, рассматривая теперь в качестве отрезка, на котором находится искомый корень уравнения, отрезок v1;v2 . Эту процедуру будем повторять до достижения указанной точности вычислений
2 10 9. В данном случае процедура повторится три раза (при боль-
42
шом количестве повторений описанный алгоритм рекомендуется организовать в виде цикла).
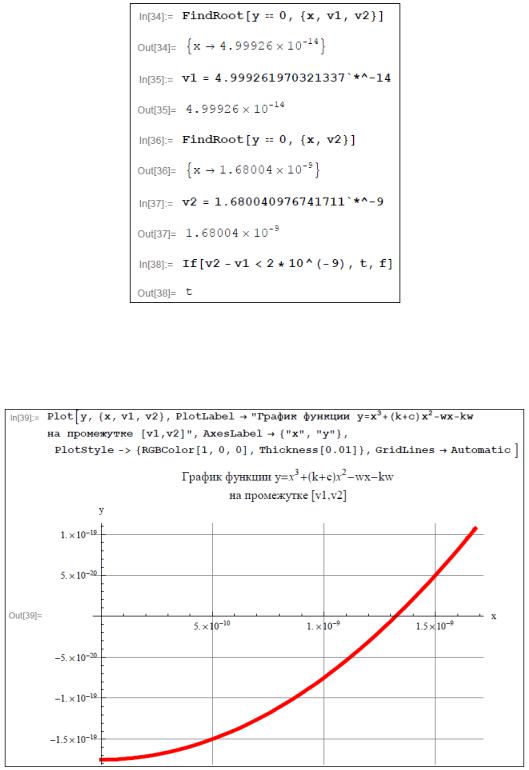
Итак, требуемая точность результатов достигнута. Изобразим график функции y x3 k c x2 wx wk на промежутке v1;v2 , где v1 и v2 – это приближенные значения искомого корня уравнения с недостатком и с избытком соответственно, удовлетворяющие заданной точности .
43
Единственный корень уравнения x3 k c x2 wx wk 0, принадлежащий отрезку [10-14;1], вычисленный с требуемой точностью , при-
ближенно равен 1,32 10 9. Тогда согласно формуле (2.3.2) pH водного раствора ацетата натрия вычислим так: pH lg1,32 10 9 8,88.
4. Анализ полученных результатов. Найдены приближенное решение с недостатком H 4,99926 10 14 и приближенное решение с избытком H 1,68004 10 9 уравнения (2.3.6), причем по модулю раз-
ность этих значений меньше требуемой точности 2 10 9 . Доказано, что существует единственное вещественное решение данного уравнения, принадлежащее интересующему нас в химическом смысле диапазону
значений переменной H – отрезку 10 14;1 . В соответствии с последним графиком можно указать следующее приближенное решение урав-
нения (2.3.6): H 1,32 10 9. По формуле (2.3.2) вычислено значение
pH водного раствора ацетата натрия: pH lg1,32 10 9 8,88. Итак, раствор ацетата натрия характеризуется слабощелочной реакцией, которая является результатом гидролиза слабой уксусной кислоты.
3.2.Определение рН водного раствора одноосновной кислоты
1.Постановка задачи. Концентрация одноосновной кислоты, которую условно обозначим HA, в водном растворе составляет CHA M .
При T 25°C определите pH этого раствора (считайте, что искомое значение pH принадлежит отрезку 0;7 ). Проанализируйте полученный результат с химической точки зрения. Константу диссоциации кислоты примите равной K . Используйте известную формулу для вычисления
ионного произведения воды: Kв H OH 10 14. Приведите возможную формулу кислоты. Конкретные значения CHA M и K укажите самостоятельно.
2. Математическая модель. Устанавливающиеся в водном растворе равновесные концентрации одноосновной кислоты в ионизированном и неионизированном состоянии, а также концентрации протонов водорода и ионов гидроксила связаны между собой константами равновесия K и Kв:
K H A ; Kв H OH . |
(2.3.7) |
HA
44
Чтобы решить задачу, необходимо найти концентрацию H ионов водорода и определить pH водного раствора кислоты, пользуясь известной формулой (2.3.2) : pH lg H .
Условие электронейтральности при рассматриваемом химическом
равновесии будет выглядеть следующим образом: |
|
H OH A . |
(2.3.8) |
Уравнение материального баланса будет иметь вид |
|
CHA A HA . |
(2.3.9) |
Подставим формулу (2.3.9), записанную в виде |
A CHA HA , в |
(2.3.8): |
|
H OH CHA HA . |
(2.3.10) |
Теперь необходимо с помощью констант, данных в условии, выразить концентрации HA и OH через концентрацию H . Это позволит по-
лучить уравнение относительно одной неизвестной переменной H , через которую и выразится по формуле (2.3.2) pH водного раствора.
Концентрации HA и OH выразим из формул (2.3.7). Используя условие электронейтральности (2.3.8) и данные в условии задачи константы, получим уравнение относительно одной неизвестной перемен-
ной H , которое после алгебраических преобразований примет вид
H 3 K H 2 K CHA Kв H KвK 0. (2.3.11)
В качестве упражнения самостоятельно проделайте все математические выкладки, необходимые для получения уравнения (2.3.11).
Уравнение (2.3.11) – кубическое с действительными коэффициентами. Следовательно, оно имеет три комплексных корня, из которых хотя бы один является вещественным. В условии сказано, что искомое значение pH принадлежит отрезку 0;7 . Следовательно, согласно формуле (2.3.2) интересующий нас в математическом смысле диапазон значений иско-
мой переменной – концентрации H ионов водорода – будет таким:
10 7;1 . Отметим, что ситуация, когда гидролиз отсутствует, соответст-
вует случаю H 10 7. Итак, математическая модель поставленной за-
дачи состоит из уравнения (2.3.11), где искомая переменная H при-
надлежит отрезку 10 7;1 , и формулы (2.3.2).
45

Упражнение. Решите построенную математическую модель при помощи системы Mathematica, учитывая конкретные значения CHA M и K . Найдите интересующее вас с химической точки зрения приближенное решение уравнения (2.3.11) с недостатком и с избытком, так чтобы по модулю разность этих значений была меньше (значение задайте самостоятельно в соответствии со значениями CHA M и K ). При этом используйте метод хорд и метод касательных. Проанализируйте полученные результаты с химической точки зрения.
Метод определения pHрастворов, который был описан в этом разделе, изложен, например, в [Скатецкий, Свиридов, Яшкин…]. Математически в обоих случаях (см. формулы (2.3.6), (2.3.11)) получились кубические уравнения с вещественными коэффициентами. Чаще в химических исследованиях используют формулы для определения pHрастворов, которые следуют из более простых уравнений, правда, это требует некоторых дополнительных ограничений на постановку задачи. Приведем здесь несколько таких случаев, касающихся определения pHрастворов слабых кислот.
Если кислота достаточно слабая, то можно принять, что количество кислоты, не вступившей в протолитическую реакцию, значительно больше количества кислоты, вступившей в нее, т. е. HA CHA . Кроме
того, если не учитывать автопротолиз воды, то H A . С учетом всего этого выражение для константы диссоциации кислоты будет иметь
вид K |
H A |
|
H |
2 |
|
|
|
|
|
HA |
|
|
. Отсюда получаем формулы |
|
|||||
|
|
CHA |
|
|
|
|
|||
|
H |
|
, |
pH |
1 |
pKα lgCHA . |
(2.3.12) |
||
|
K CHA |
||||||||
|
|
||||||||
|
|
|
|
|
|
2 |
|
|
|
Если кислота не является достаточно слабой для того, чтобы соблюдалось приближенное равенство HA CHA , то выражение для констан-
ты кислотности будет иметь вид K |
H |
A |
|
H 2 |
|
, откуда по- |
||||||
HA |
CHA H |
|||||||||||
|
|
|
|
|
|
|||||||
лучаем квадратное уравнение H 2 |
K H K CHA 0 и формулы |
|||||||||||
H |
K |
|
|
, |
pH lg H . |
|
||||||
K 2 4K CHA |
(2.3.13) |
|||||||||||
|
|
|
||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
46 |
|
|
|
|
|
|
|
|
|

Выбор формулы (2.3.12) или (2.3.13) для расчета pHрастворов слабых кислот зависит от трех условий: величины константы диссоциации кислоты, ее концентрации и допустимой погрешности расчета pH. Значение pH, вычисленное по упрощенной формуле (2.3.12), оказывается заниженным по сравнению с использованием (2.3.13). Как правило, упро-
щенную формулу используют, |
если степень протолиза |
|
K |
|
не |
||||||
|
|
||||||||||
|
|
|
|
|
|
|
|
|
CHA |
||
превосходит 5%, т. е. |
K |
|
|
0,05 |
или pK lgCHA 2,6. |
|
|
|
|||
CHA |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||
Если кислота |
очень слабая |
или |
концентрация ее |
слишком |
мала |
||||||
(CHA K 10 12), |
то уже нельзя считать, что H A , поскольку не- |
||||||||||
обходимо учитывать автопротолиз воды. Тогда из формулы для констан-
ты диссоциации кислоты следует, что H K CHA , где концентрацию
A
A можно выразить через концентрацию H из условия (2.3.8) и формулы ионного произведения воды. Проделав необходимые математические выкладки, получим формулы
H |
|
, |
pH lg H |
1 |
lg K CHA Kв . (2.3.14) |
|
K CHA Kв |
||||||
|
||||||
|
|
|
2 |
|
||
Можно также привести ряд специфических случаев, касающихся определения pHрастворов слабых оснований. Не останавливаясь здесь на этом подробно, отметим лишь, что pH раствора ацетата натрия (см. подраздел 3.1) можно при некоторых допущениях определить, не используя уравнение (2.3.6), а применяя более простые приближенные математические формулы (см., например, в [Жебентяев …, с. 227–228])
47
