
- •Вопросы к экзамену по физике (пгс) I часть
- •15. Удар абсолютно упругих и неупругих тел.
- •21. Постулаты специальной теории относительности.
- •28. Давление газа с точки зрения молекулярно-кинетической теории. Уравнение состояния идеального газа.
- •34. Средняя кинетическая энергия молекул. Молекулярно-кинетическое толкование абсолютной температуры.
- •Внутренняя энергия
- •35. Работа газа. Количество теплоты 37. Теплоемкость.
- •30. Закон Максвелла для распределения молекул идеального газа по скоростям и энергиям их теплового движения. Средние скорости теплового движения частиц.
- •33. Число степеней свободы. Закон равномерного распределения энергии по степеням свободы.
- •29. Барометрическая формула. Распределение Больцмана.
- •31. Принцип детального равновесия. Среднее число столкновений и средняя длина свободного пробега молекул. Вакуум.
- •32. Молекулярно-кинетическая теория явлений переноса в неравновесной системе.
- •35. Работа газа при изменении его объема. Внутренняя энергия термодинамической системы.
- •36. Количество теплоты. Первое начало термодинамики. Применение первого начала к изопроцессам.
- •37. Теплоемкость. Удельная и молярная теплоемкости. Зависимость теплоемкости идеального газа от вида процесса. Недостаточность классической теории теплоемкости.
- •40. Термодинамическая вероятность. Определение энтропии неравновесной системы через термодинамическую вероятность состояния.
- •41. Силы и потенциальная энергия межмолекулярного взаимодействия. Эффективный диаметр молекул.
- •42. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и их анализ.
- •42. Метастабильные состояния. Критическая точка.
- •43. Внутренняя энергия реальных газов.
- •44. Понятие фазы, фазового равновесия и превращения. Правило фаз Гиббса.
41. Силы и потенциальная энергия межмолекулярного взаимодействия. Эффективный диаметр молекул.
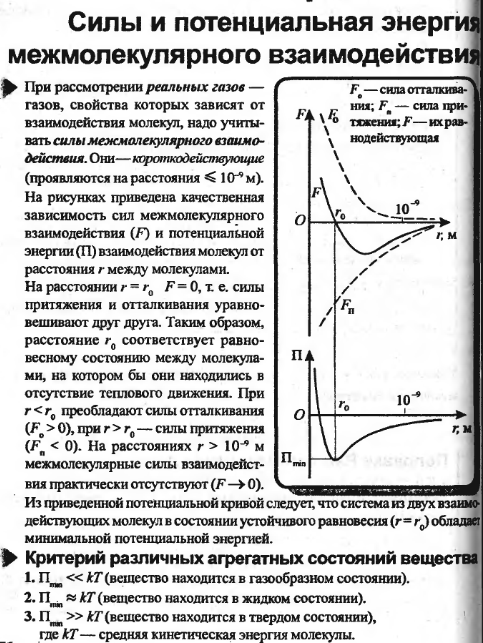
Эффективный диаметр молекулы – минимальное расстояние, на которое сближаются центры двух молекул при столкновении.
При столкновении молекулы сближаются до некоторого наименьшего расстояния, которое условно считается суммой радиусов взаимодействующих молекул. Столкновение между одинаковыми молекулами может произойти только в том случае, если их центры сблизятся на расстояние, меньшее или равное диаметру d - эффективному диаметру молекулы.
42. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и их анализ.


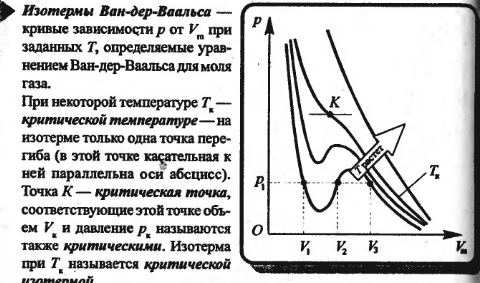
42. Метастабильные состояния. Критическая точка.
43. Внутренняя энергия реальных газов.
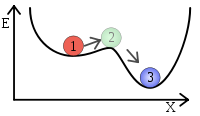
cостояние 1: метастабильное — состояние, стабильность которого сохраняется при не очень больших возмущениях;
cостояние 2: нестабильное — состояние, стабильность которого нарушается при сколь угодно малых возмущенииях;
cостояние 3: стабильное — состояние, стабильность которого сохраняется при больших возмущениях.
В критической точке плотность жидкости и её насыщенного пара становятся равны, а поверхностное натяжение жидкости падает до нуля, потому исчезает граница раздела фаз жидкость-пар
 .
.
44. Понятие фазы, фазового равновесия и превращения. Правило фаз Гиббса.

Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического ихимического равновесия.
Типы фазовых равновесий:
Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру.
Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Строго говоря, в реальных системах эти давления равны лишь приближенно, разность давлений создается поверхностным натяжением.
Химическое равновесие выражается в равенстве химических потенциалов всех фаз вещества.
Правило фаз записывается следующим образом:
![]()
где j — число фаз (например, агрегатных состояний вещества);
v — число степеней свободы, то есть независимых параметров (температура, давление, концентрация компонентов), которые полностью определяют состояние системы при равновесии и которые можно менять без изменения числа и природы фаз;
k — число компонентов системы — число входящих в систему индивидуальных веществ за вычетом числа химических уравнений, связывающих эти вещества. n — число переменных, характеризующих влияние внешних условий на равновесие системы.
44. Фазовые переходы первого и второго рода. Диаграммы состояния. Тройная точка.


