
- •Вопросы к экзамену по физике (пгс) I часть
- •15. Удар абсолютно упругих и неупругих тел.
- •21. Постулаты специальной теории относительности.
- •28. Давление газа с точки зрения молекулярно-кинетической теории. Уравнение состояния идеального газа.
- •34. Средняя кинетическая энергия молекул. Молекулярно-кинетическое толкование абсолютной температуры.
- •Внутренняя энергия
- •35. Работа газа. Количество теплоты 37. Теплоемкость.
- •30. Закон Максвелла для распределения молекул идеального газа по скоростям и энергиям их теплового движения. Средние скорости теплового движения частиц.
- •33. Число степеней свободы. Закон равномерного распределения энергии по степеням свободы.
- •29. Барометрическая формула. Распределение Больцмана.
- •31. Принцип детального равновесия. Среднее число столкновений и средняя длина свободного пробега молекул. Вакуум.
- •32. Молекулярно-кинетическая теория явлений переноса в неравновесной системе.
- •35. Работа газа при изменении его объема. Внутренняя энергия термодинамической системы.
- •36. Количество теплоты. Первое начало термодинамики. Применение первого начала к изопроцессам.
- •37. Теплоемкость. Удельная и молярная теплоемкости. Зависимость теплоемкости идеального газа от вида процесса. Недостаточность классической теории теплоемкости.
- •40. Термодинамическая вероятность. Определение энтропии неравновесной системы через термодинамическую вероятность состояния.
- •41. Силы и потенциальная энергия межмолекулярного взаимодействия. Эффективный диаметр молекул.
- •42. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и их анализ.
- •42. Метастабильные состояния. Критическая точка.
- •43. Внутренняя энергия реальных газов.
- •44. Понятие фазы, фазового равновесия и превращения. Правило фаз Гиббса.
32. Молекулярно-кинетическая теория явлений переноса в неравновесной системе.
35. Работа газа при изменении его объема. Внутренняя энергия термодинамической системы.
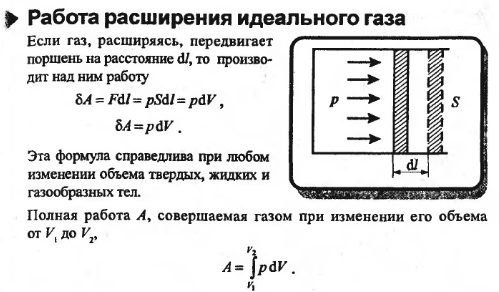


36. Количество теплоты. Первое начало термодинамики. Применение первого начала к изопроцессам.
Коли́чество
теплоты́ — энергия,
которую получает или теряет тело
при теплопередаче.
Количество теплоты является одной из
основныхтермодинамических
величин.
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление,объём или температура — остаются неизменными. Так, неизменному давлению соответствует изобарный процесс, объёму — изохорный, температуре —изотермический, энтропии — изоэнтропийный (например, обратимый адиабатический процесс).
Адиабатным называют такой процесс, в котором к системе не подво-дится тепло и от системы не отводится тепло. При адиабатном процессе должна быть обеспечена идеальная теплоизоляция от внешней среды, в отличие от изотермического процесса, требующего идеального теплового контакта со средой. В реальных условиях процесс является адиабатным, если система снабжена хорошей теплоизоляцией или если процесс протекает настолько быстро, что не происходит заметного теплообмена с внешней средой.
37. Теплоемкость. Удельная и молярная теплоемкости. Зависимость теплоемкости идеального газа от вида процесса. Недостаточность классической теории теплоемкости.


![]()
![]()
![]()
![]()
![]()

38. Адиабатный процесс. Уравнение Пуассона.

39. Обратимые и необратимые тепловые процессы. Круговые процессы (циклы).


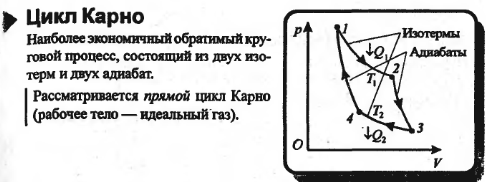
39. Цикл Карно и его КПД. Тепловые двигатели и холодильные машины.

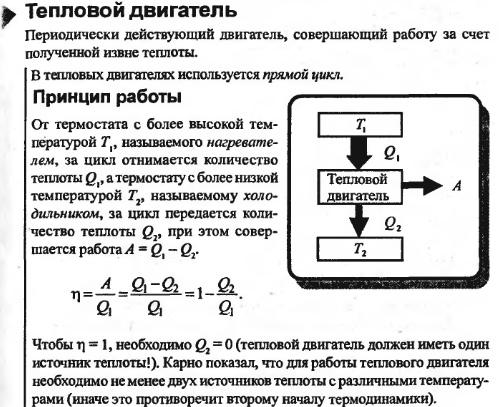
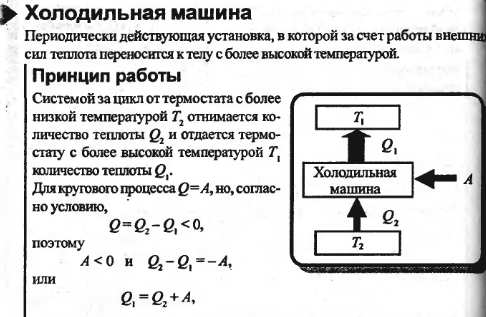
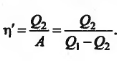
Второе начало термодинамики не отретцает переход от хол к гор
39. Второе начало термодинамики. Приведенная теплота.


40. Энтропия. Принцип возрастания энтропии. Энтропия идеального газа.



Третье начало термодинамики.
Третье начало термодинамики(теорема Нернста) — физический принцип, определяющий поведениеэнтропиипри абсолютном нулетемпературы. Является одним изпостулатовтермодинамики.
Третье начало термодинамики может быть сформулировано так:
«Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».
![]()
или
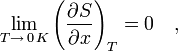
где x— любой термодинамический параметр.
Заметим, что третье начало термодинамики относится только к равновесным состояниям.
40. Термодинамическая вероятность. Определение энтропии неравновесной системы через термодинамическую вероятность состояния.

Термодинамические потенциалы. Химический потенциал системы.
Термодинами́ческиепотенциа́лы (термодинамические функции) — характеристическая функция в термодинамике, убыль которых в равновесных процессах, протекающих при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе.
Хими́ческийпотенциа́л ![]() —
один изтермодинамических параметров
системы, а именно энергия добавления
одной частицы в систему без совершения
работы. Определение химического
потенциала можно записать в виде:
—
один изтермодинамических параметров
системы, а именно энергия добавления
одной частицы в систему без совершения
работы. Определение химического
потенциала можно записать в виде:
![]()
где Е — энергия системы, S — её энтропия, N — количество частиц в системе.
Энтальпия. Свободная энергия Гельмгольца. Потенциал Гиббса.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV
![]()
dH![]()
Свобо́днаяэне́ргияГельмго́льца (или просто свобо́днаяэне́ргия) — термодинамический потенциал, убыль которого в квазистатическомизотермическом процессе равна работе, совершённой системой над внешними телами.
Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так:
![]() ,
где
,
где ![]() — внутренняя
энергия,
— внутренняя
энергия, ![]() —
абсолютная температура,
—
абсолютная температура, ![]() — энтропия.
— энтропия.
Отсюда дифференциал свободной
энергии равен:![]() .
.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции; это термодинамический потенциал следующего вида:
![]()
Дифференциал энергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных — через давление p и температуру T:
![]()
