
- •2.Строение и уровни структурной организации белков
- •3. Найти самой4. Определение общего белка в сыворотке крови по биуретовой реакции
- •Гипопротеинемия
- •Азотистые основания.
- •Нуклеозиды.
- •2. Оксокислоты
- •Химические свойства.
- •1.3. Биологически важные гидроксикислоты.
- •2. Оксокислоты
- •2.2. Химические свойства
- •1. Протеиногенные аминокислоты
- •1. "Альдегиды. Кетоны".
- •Осмотическое давление
- •Критерии ароматичности[править | править вики-текст]
- •4. Определение общего белка в сыворотке крови по биуретовой реакции
- •Гипопротеинемия
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •1. Специфические и неспецифические ингибиторы
- •Обратимое ингибирование
- •Неконкурентное ингибирование
- •Ингибирование субстратом[править | править вики-текст]
- •Аллостерическое ингибирование[править | править вики-текст]
- •Значения pH в растворах различной кислотности[править | править вики-текст]
- •Методы определения значения pH[править | править вики-текст]
- •3.Лекарственные препараты как конкурентные ингибиторы
- •2. Оксокислоты
- •Химические свойства.
- •1.3. Биологически важные гидроксикислоты.
- •2. Оксокислоты
- •2.2. Химические свойства
- •Причины ацидоза[править | править вики-текст]
- •Классификации ацидоза[править | править вики-текст]
- •Лечение[править | править вики-текст]
- •Классификация[править | править вики-текст]
- •Этиология[править | править вики-текст]
- •Газовый (респирато́рный) алкалоз[править | править вики-текст]
- •Негазовый алкалоз[править | править вики-текст]
- •Смешанный алкалоз[править | править вики-текст]
- •Патогенез[править | править вики-текст]
- •Лечение[править | править вики-текст]
- •1 Аксиома. Изменение рСо2 крови на 10 мм рт.Ст. Обусловливает реципрокное изменение pH на 0,08.
- •2 Аксиома. Изменение pH на 0,15 является результатом изменения концентрации буферных оснований на 10 ммоль/л.
- •1. 1. Протеиногенные аминокислоты
- •10) Запасная (резервная) функция
- •11) Моторная (двигательная) функция
- •Классификация по типу строения
- •Простые и сложные белки
Азотистые основания.
Вода составе нуклеозидов встречаются два вида азотистых оснований, которые являются производными двух типов гетероциклов: пуринов и пиримидинов. Наиболее просто устроены пиримидиновые основания.
урацил (У, U) в урациле добавляется две функциональных карбонильных групп в 4 и 2 положении.
т. к. в урациле присутствуют электроотрицательный кислород, то это приводит к смешению электронной плотности Од-, Нд+. Может реагировать с водой, образуя водородные связи.
тимин (Т).
цитозин (С, Ц).
Все пиримидиновые основания могут образовывать водородные связи с водой, т.к. они имеют электроотрицательные атомы, которые способно сдвигать электронную плотность на себя.
пиримидиновые азотистые основания образуются за счет присоединения к пиримидину О2, СН3и NH2 групп.
Пуриновые основания являются производными пурина, которое состоит из 2 гетероциклов.
аденин (А)
гуанин (Г, G).
Поскольку в азотистых основаниях присутствуют электроотрицательные атомы, то происходит смещение электронной плотности, в результате чего они могут реагировать с водой и образовывать водородные связи, а также реагировать друг с другом. Устойчивые соединения образуют пиримидиновые основания с пуриновыми. Специфичным взаимодействием между определенными пуринами и пиримидинами получило название правило комплементарности, по этому правилу аденин соединяется с тимином или урацилом двумя водородными связями, а гуанин с цитозином – тремя связями. Правило комплиментарности является ведущим правилом в матричных процессах. Азотистые основания выполняет в клетке метаболическую функцию, т.е. входят в состав нуклеозидов.
Нуклеозиды.
Нуклеозиды – это производные азотистых оснований, образуются за счет образования N-гликозидной связи между первым атомом углерода в пентозе и первым атомом азота в пиримидину или девятым атомом азота в пурине.
С точки зрения строения нуклеозиды делятся на:
пиримидиновые и имеют окончание – дин. В свою очередь, которые делятся на:
А) рибонуклеозиды, например: уридин, цитидин, тимидин.
В) дезоксирибонуклеозиды, например: дезокситимидин, дезоксицитидин, дезоксиурацидин.
пуриновые и имеют окончание –зин. Так же делятся на:
А) рибонуклеозиды, например: аденазин, гуанозин.
В) дезоксирибонуклеозиды, например: дезоксиаденазин, дезоксигуанозин.
Аденин, гуанин и цитозин встречаются как в дезокси- так и в рибонуклеозидах, а тимин образует устойчивые связи с дезоксирибонуклеозидами и урацил - с рибонуклеозидами.
Нуклеозиды выполняют только метаболическую функцию, входят в состав нуклеотидов.
ЛАКТИМ-ЛАКТАМНАЯ ТАУТОМЕРИЯ
|
|
Этот вид таутомерии характерен для азотсодержащих гетероциклов с фрагментом N=C—ОН.
Взаимопревращение таутомерных форм связано с переносом протона от гидроксильной группы, напоминающей фенольную ОН-группу, к основному центру — пиридиновому атому азота и наоборот. Обычно лактамная форма в равновесии преобладает.
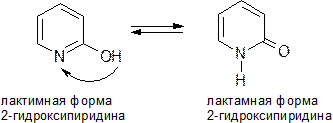
3. Производные пиримидина
Пиримидиновые нуклеиновые основания: тимин (2,4-дигидрокси-5-метилпиримидин), урацил (2,4-дигидроксипиримидин), цитозин (2-гидрокси –4-аминопиримидин). Входят в состав нуклеиновых кислот в лактамной форме.



3.
В УЧЕБНИКЕ
4.
зменение
показателей рН-баланса могут привести
к печальным последствиям:
А)
Повышенная кислотность в организме
(самый распространенный случай).
Из-за
неправильного питания и употребления
в пищу кислых продуктов, а также
недос-татка воды происходит закисление
организма. Большинство нынешних продуктов
пита-ния кислые (батоны, булочки,
газированные напитки, сахар и его
заменители и т.д.). При закисленности
организма ухудшается перенос кислорода
к органам и тканям, организм плохо
усваивает минералы, а некоторые минералы,
такие как Ca, Na, K, Mg выводятся
из организма. От недостатка минералов
страдают жизненно важные органы,
повышается риск сердечно сосудистых
заболеваний, снижается иммунитет,
появляется хрупкость костей и многое
другое. Если в организме находится
большое количество кислоты и на-рушены
механизмы ее вывода (с мочой и калом, с
дыханием, с потом и т.д.), организм
подвергается сильнейшей интоксикации.
Единственный выход – это ощелачивание
ор-ганизма.
Состояние повышенной
кислотности называется - Ацидоз. Не
выявленный вовремя аци-доз может вредить
организму незаметно, но постоянно в
течение нескольких месяцев и даже лет.
Злоупотребление алкоголем часто приводит
к ацидозу. Ацидоз
может возни-кать, как осложнение
диабета.
При
Ацидозе могут появиться следующие
проблемы:
Заболевания
сердечно-сосудистой системы, включая
стойкий спазм сосудов и уменьшение
концентрации кислорода в крови.
Прибавление в весе и диабет.
Заболевания
почек и мочевого пузыря, образование
камней.
Снижение
иммунитета. Общая слабость.
Увеличение
вредного воздействия свободных радикалов,
которые могут способ-ствовать онкогенезу.
Хрупкость костей вплоть, до перелома
шейки бедра, а также других нарушениях
опорно-двигательного аппарата, как
например, образование остеофитов (шпор).
Появление суставных болей и болевых
ощущений в мышцах, связанных с нако-плением
молочной кислоты.
В
течение 7 лет, проводилось исследование
в Калифорнийском Университете (штат
Сан-Франциско), где были обследованы 9
тыс. женщин. Результаты показали, что
при постоянном повышенном уровне
кислотности кости становятся ломкими.
Специалисты, проводившие этот эксперимент,
уверены, что большинство проблем женщин
среднего возраста связано с излишним
употреблением мясной и недостатком
употребления овощной пищи. Поэтому
организму ничего не остается, как
забирать кальций из соб-ственных костей,
и с его помощью регулировать уровень
рН.
Б)
Повышенное содержание щёлочи в
организме.
При
повышенном содержании щелочи в организме,
а это состояние называется Алкалоз,
также как при ацидозе, нарушается
усвоение минералов. Пища усваивается
гораздо медленнее, что позволяет токсинам
проникать из желудочно-кишечного тракта
в кровь. Повышенное содержание щелочи
в организме опасно и трудно поддается
корректиров-ке, но случается это довольно
редко. Как правило, алкалоз является
результатом упот-ребления лекарств,
содержащих щелочь.
Повышенное
содержание щелочи может
спровоцировать:
• Проблемы
с кожей и печенью.
• Сильный
и неприятный запах изо рта и
тела.
• Активизацию
жизнедеятельности паразитов.
• Разнообразные
аллергические проявления, в том числе
связанные с пищей и загрязнением
окружающей среды.
• Обострение
хронических заболеваний.
• Запоры
и другие проблемы с кишечником.
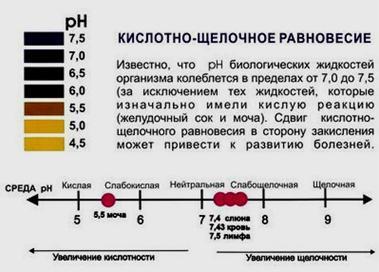
Значение
рН мочи Результаты
рН тестов мочи показывают, насколько
хорошо организм усваивает минералы,
такие как кальций, натрий, калий и магний.
Эти минералы называ-ют "кислотными
демпферами", так как они регулируют
уровень кислотности в организме. Если
кислотность слишком высокая, организм
не продуцирует кислоту. Он должен
ней-трализовать кислоту. Для этого
организм начинает заимствовать минералы
из различ-ных органов, костей, мышц и
проч. для того, чтобы нейтрализовать
излишки кислоты, которая начинает
накапливаться в тканях. Таким образом,
происходит регулирование уровня
кислотности.
Значение
рН слюны Рационально
также знать уровень рН слюны. Результаты
тестиро-вания показывают активность
ферментов пищеварительного тракта,
особенно печени и желудка. Этот показатель
дает представление о работе как всего
организма в целом так и отдельных его
систем. Некоторые люди могут иметь
повышенную кислотность, как мо-чи, так
и слюны - в таком случае мы имеем дело с
"двойной кислотностью".
Значение
рН крови рН крови одна из самых жестких
физиологических констант орга-низма.
В норме этот показатель может меняться
в пределах 7,3б - 7,42. Сдвиг этого по-казателя
хотя бы на 0,1 может привести к тяжелой
патологии. Заметьте, в экстренных случаях
врачи первым делом делают укол
слабо-щелочного раствора (физраствор)
в кровь.
При
сдвиге рН крови на 0,2 развивается
коматозное состояние, на 0,3 - человек
погибает.
Поддерживайте
правильный рН баланс для сохранения
крепкого здоровья
Организм способен
правильно усваивать и накапливать
минералы и питательные веще-ства только
при надлежащем уровне кислотно-щелочного
равновесия. В ваших силах помочь своему
организму получать, а не терять полезные
вещества. Например, железо может
усваиваться организмом при рН 6,0-7,0, а
йод - при рН 6,3-6,6. Наш организм ис-пользует
соляную кислоту для расщепления пищи.
В процессе жизнедеятельности орга-низма
требуются как кислые, так и щелочные
продукты распада, причем первых
образу-ется в 20 раз больше, нежели вторых.
Поэтому защитные системы организма,
обеспечи-вающие неизменность его КЩР,
"настроены" прежде всего на
нейтрализацию и выведе-ние прежде всего
кислых продуктов распада.
Основными
механизмами поддержания этого равновесия
являются: буферные системы крови
(карбонатная, фосфатная, белковая,
гемоглобиновая), респираторная (легочная)
система регуляции, почечная (выделительная
система).
Как организм управляет
уровнем кислотности:
• Выделяет
кислоты - через желудочно-кишечный
тракт, почки, легкие, кожу;
• Нейтрализует
кислоты - с помощью минералов: кальций,
магний, калий, натрий;
• Накапливает
кислоты - в тканях, прежде всего в
мышцах.
Отто Варбург потратил 24 года
своей жизни на то, чтобы доказать тот
факт, что в среде, насыщенной кислородом,
при pH 7,43
и выше (слабощелочная среда), ра-ковые
клетки не размножаются. В 1932 году он
получил за это Нобелевскую пре-мию по
химии. А его ученики позже доказали, что
в этой среде не развиваются па-разиты,
вирусы, бактерии и грибки.
БИЛЕТ 1
1. Гибридизация – процесс смешения разных, но близких по энергии, орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по форме и энергии.
В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном их трёх состояний гибридизации: sp3, sp2, sp.
sp3 – гибридизация: происходит смешение одной s и трёх p орбиталей. Образуются четыре одинаковые гибридные орбитали, расположенные относительно друг друга под тетраэдрическим углом 109˚28`. Образуются 4 ковалентные σ – связи.
Объяснение
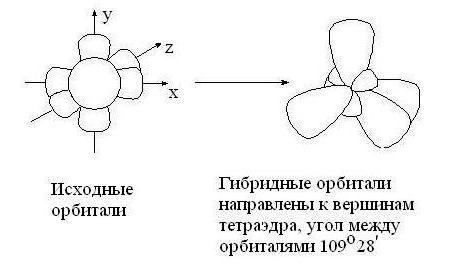
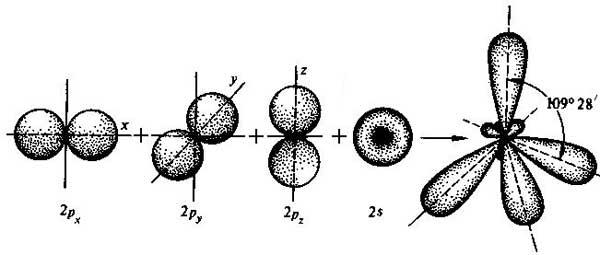
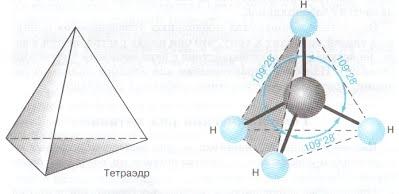
рис. Строение молекулы метана СН4 (тетраэдрическое)
sp2 – гибридизация: происходит смешение одной s и двух p орбиталей. Образуются три одинаковые гибридные орбитали, они расположены относительно друг друга под углом 120˚, лежат в одной плоскости и стремятся к вершинам треугольника. Образуются 3 ковалентные σ – связи.
Объяснение
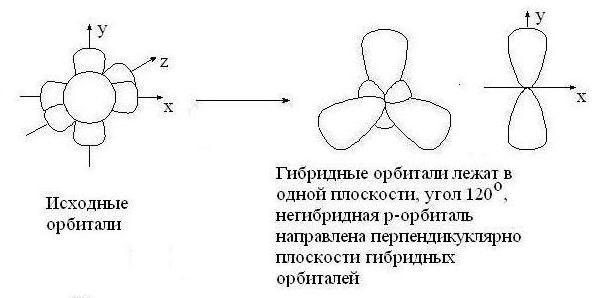
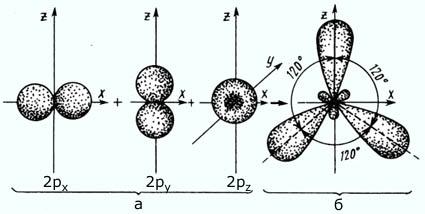
Оставшаяся одна негибридизованная орбиталь расположена перпендикулярно плоскости образования σ – связей и участвует в образовании П - связи.

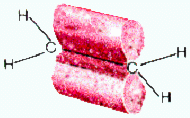
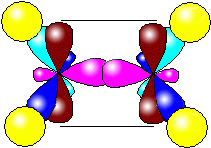
рис. Строение молекулы этилена С2Н4 (плоское тригональное)
sp – гибридизация: происходит смешение одной s и одной p орбитали. Образуются две одинаковые гибридные орбитали, они расположены относительно друг друга под углом 180˚, лежат на одной линии. Образуются 2 ковалентные σ – связи.
Объяснение
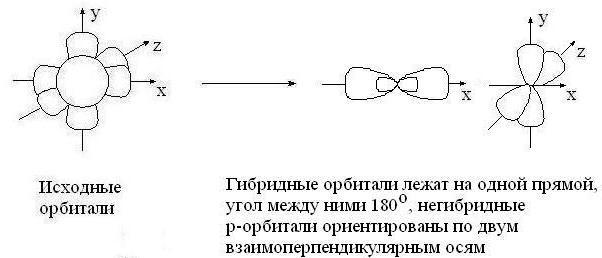
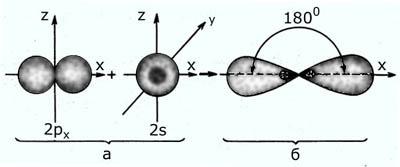
Оставшиеся две негибридизованные орбитали расположены во взаимно перпендикулярных плоскостях и образуют две П - связи.

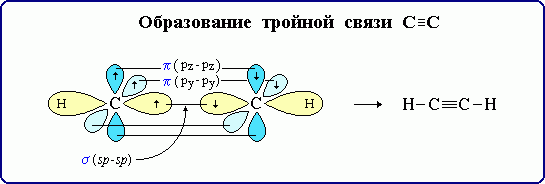
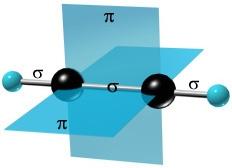

рис. Строение молекулы ацетилена С2Н2 (линейное)
Направленность гибридных орбиталей в пространстве, а следовательно, и геометрическое строение молекул зависят от типа гибридизации. На форму молекулы в пространстве влияет направленность только σ – связей.
Сигма и пи-связь в аминокислотах – в уч
дщ
САМА ИЗ УЧЕБНИКА
3.Ката́лиз (греч. κατάλυσις восходит к καταλύειν — разрушение) — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
Ферме́нты, или энзи́мы — обычно белковые молекулы или молекулы РНК или их комплексы, ускоряющие химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам.
Общие св-ва -
К ферментам применимы три основных критерия, характерных и для неорганических катализаторов. В частности, они остаются неизмененными после реакции, т.е. освобождаясь, могут вновь реагировать с новыми молекуламисубстрата (хотя нельзя исключить побочных влияний условий среды на активность фермента). Ферменты способны оказывать действие в ничтожно малых концентрациях (например, одна молекула фермента реннина, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул казеиногена молока за 10 мин притемпературе 37°С). Наличие либо отсутствие фермента или любого другого катализатора не оказывает влияния на величину константы равновесия и свободной энергии (ΔG). Катализаторы лишь повышают скорость, с которой система приближается к термодинамическому равновесию, не сдвигая точки равновесия. Химические реакции с высокой константой равновесия и отрицательной величиной ΔG принято называть экзергоническими. Реакции с низкой константой равновесия и соответственно положительной величиной ΔG (они обычно не протекают спонтанно) называются эндерго-ническими. Для начала и завершения этих реакций необходим приток энергии извне. В живых системах экзергонические процессы обычно сопряжены с эндергоническими реакциями, обеспечивая последние необходимым количеством энергии.
1. Не расходуются в процессе реакции. 2. Оказывают свое действие при малых концентрациях. 3. Не оказывают влияния на величину константы равновесия реакции. 4. Их действие подчиняется закону действующих масс. 5. Не ускоряют термодинамически невозможных реакций.
4. ––
БИЛЕТ 4.
1
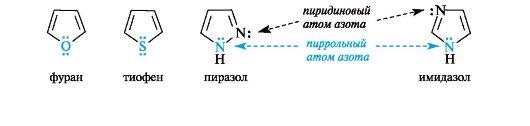
Ароматические гетероциклические соединения
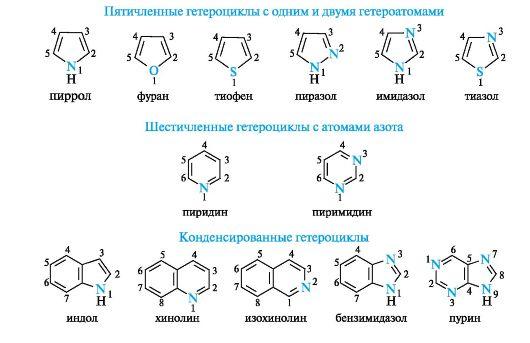
На примере пиримидина, имидазола, пурина.
Ароматичностью обладает также пурин, представляющий собой конденсированную систему двух гетероциклов - пиримидина и имидазола.
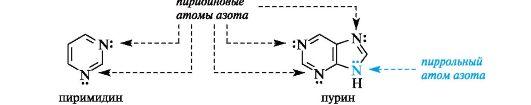
Делокализованное электронное облако в пурине включает 8 π-электронов двойных связей и неподеленную пару электронов атома N-9. Общее число электронов в сопряжении, равное десяти, соответствует формуле Хюккеля (4n + 2, где п = 2).
Гетероциклические ароматические соединения обладают высокой термодинамической устойчивостью. Неудивительно, что именно они служат структурными единицами важнейших биополимеров - нуклеиновых кислот.
В имидазоле и пиразоле два атома азота вносят разный вклад в образование делокализованного электронного облака: пиррольный атом азота поставляет пару и-электронов, а пиридиновый - один p-электрон.
2.Втори́чная структу́ра белка́ — пространственная структура, образующаяся в результате взаимодействия между функциональными группами пептидного остова
Регулярными называются вторичные структуры, образованные аминокислотными остатками с одинаковой конформацией главной цепи (углы φ и ψ), при разнообразии конформаций боковых групп.
К регулярным вторичным структурам относят:
спирали, которые могут быть левозакрученными и правозакрученными с разным периодом и шагом. Большинство спиральных структур в полипептидных цепях поддерживается внутримолекулярными водородными связями. Водородная связь при этом образуется между карбонильной группой одного аминокислотного остатка иаминогруппой другого, лежащего ближе к N-концу полипептида[2]. Разные типы спиралей описываются цифровой записью вида ab, где a — номер по цепи аминокислотного остатка, который предоставляет аминогруппу для формирования водородной связи, b — количество атомов в цикле, замкнутом водородной связью. К спиральным структурам, которые встречаются в белках, относятся:
α-спираль, или спираль 413, — самая распространённая в белках вторичная структура. Данная спираль характеризуется плотными витками вокруг длинной оси молекулы, один виток составляет 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[3] (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали.
310-спираль — очень «тугая» спираль, в сечении имеет форму треугольника, в белках встречается в основном её правая форма, и то только в виде 1-2 витков[2].
π-спираль, или спираль 516, — спираль с широкими витками, в результате в центре спирали остаётся пустое пространство. В белках встречается редко, обычно не более одного витка.
β-листы (β-структура, складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток[3]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Полипептидные цепи в составе β-листов могут быть направлены N-концами в противоположные стороны (антипараллельная β-структура), в одну сторону (параллельная β-структура), также возможно существование смешанной β-структуры (состоит из параллельной и антипараллельной β-структуры)[2]. Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин иаланин. β-структура является второй по частоте встречаемости в белках после α-спирали.
полипролиновая спираль — плотная левая спираль, которая стабилизирована Ван-дер-Ваальсовыми взаимодействиями, а не системой водородных связей. Такая структура формируется в полипептидных цепях богатых пролином, где формирование насыщенной системы водородных связей по этой причине невозможно. Полипролиновая спираль типа poly(Pro)II реализуется в коллагене, при этом три левых полипролиновых спирали перевиваются в правую суперспираль, которая стабилизируется водородными связями между отдельными цепями[2].
В формировании вторичной структуры ДНК участвуют следующие типы взаимодействий:
водородные связи между комплементарными основаниями (две между аденином и тимином, три — между гуанином и цитозином);
стэкинг-взаимодействия;
электростатические взаимодействия;
Ван-дер-Ваальсовы взаимодействия.
Вторичной структурой называют пространственное расположение атомов главной цепи молекулы белка на отдельных ее участках (любой участок белка имеет вторичную структуру). Если Вы забыли о том, какие бывают вторичные структуры, о силах, стабилизирующих эти структуры, загляните в любой учебник по биохимии. Выделяют надвторичные структуры - термодинамически или кинетически стабильные комплексы альфа-спиралей и бета-структур, формирующиеся за счет межрадикальных взаимодействий. Определенные характерные сочетания альфа-спиралей и бета-структур часто обозначают как «структурные мотивы». В глобулярных белках обнаружены, например, складка Россмана (βαβαβ-элемент, т. е. 2 сегмента α-спирали, вставленные между тремя параллельными β-цепями), β-меандр (слой из трех антипараллельных β-цепей, «Меандр» - название очень извилистой реки в Греции). Например триозофосфатизомераза и один домен пируваткиназы имеют супервторичную структуру в виде β-бочонка. Структурный мотив «α-спираль-поворот-α-спираль» обнаружен во многих ДНК-связывающих белках. Более длинная α-спираль располагается в большой бороздке ДНК, а более короткая α-спираль поперек бороздки. Супервторичная структура в виде «цинкового пальца», где атом цинка связан с радикалами четырех аминокислот, также часто отмечают в ДНК-связывающих белках. Молекулы гистонов объединяются в комплексы с помощью «лейциновых застежек», в которых лейциновые остатки α-спирали одного белка взаимодействуют с помощью гидрофобных взаимодействий с лейциновыми остатками другого белка.Здесь мы рассмотрим подробнее следующие два уровня пространственной организации.
По учебнику
4. в кислом виде
?
Эти вещества еще называют тканевыми гормонами, и синтезируются они именно из эссенциальных жирных кислот.
БИЛЕТ 5
1. КЛАССИФИКАЦИЯ ОРГ СОЕД…. ПО УЧ
2. ТРЕТИЧНАЯ СТР-РА БЕЛКА
3.Необратимые ингибиторы ферментов как лекарственные препараты
Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, - широко используемый препарат аспирин. Противовоспалительный нестероидный препарат аспирин обеспечивает фармакологическое действие за счёт ингибирования фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты. В результате химической реакции ацетильный остаток аспирина присоединяется к свободной концевой NH2-группе одной из субъединиц циклооксигеназы (см. схему ниже).
Это вызывает снижение образования продуктов реакции простагландинов (см. раздел 8), которые обладают широким спектром биологических функций, в том числе являются медиаторами воспаления.
Этапы ферментативного катализа:
I - этап сближения и ориентации субстрата в активном центре фермента; II - образование фермент-субстратного комплекса (Ев); III - образование нестабильного комплекса фермент-продукт (ЕР); IV - высвобождение продуктов реакции из активного центра фермента
Фермент понижает энергию активации Еа, т.е. снижает высоту энергетического барьера; в результате возрастает доля реакционно-способных молекул и повышается скорость реакции
4в нейтр. виде
БИЛЕТ 6
1. 1. Гидроксикислоты
Гидроксикислоты – гетерофункциональные соединения, содержащие карбоксильную и гидроксильную группы. По взаимному расположению функциональных групп различают -, -, - и т.д. гидроксикислоты.
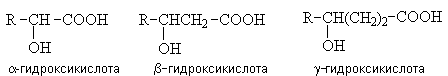
В природе широко распространены полигидроксикарбоновые кислоты (содержат нескольно гидроксильных групп) и гидроксиполикарбоновые кислоты (содержат несколько карбоксильных групп).
