
- •2.Строение и уровни структурной организации белков
- •3. Найти самой4. Определение общего белка в сыворотке крови по биуретовой реакции
- •Гипопротеинемия
- •Азотистые основания.
- •Нуклеозиды.
- •2. Оксокислоты
- •Химические свойства.
- •1.3. Биологически важные гидроксикислоты.
- •2. Оксокислоты
- •2.2. Химические свойства
- •1. Протеиногенные аминокислоты
- •1. "Альдегиды. Кетоны".
- •Осмотическое давление
- •Критерии ароматичности[править | править вики-текст]
- •4. Определение общего белка в сыворотке крови по биуретовой реакции
- •Гипопротеинемия
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •1. Специфические и неспецифические ингибиторы
- •Обратимое ингибирование
- •Неконкурентное ингибирование
- •Ингибирование субстратом[править | править вики-текст]
- •Аллостерическое ингибирование[править | править вики-текст]
- •Значения pH в растворах различной кислотности[править | править вики-текст]
- •Методы определения значения pH[править | править вики-текст]
- •3.Лекарственные препараты как конкурентные ингибиторы
- •2. Оксокислоты
- •Химические свойства.
- •1.3. Биологически важные гидроксикислоты.
- •2. Оксокислоты
- •2.2. Химические свойства
- •Причины ацидоза[править | править вики-текст]
- •Классификации ацидоза[править | править вики-текст]
- •Лечение[править | править вики-текст]
- •Классификация[править | править вики-текст]
- •Этиология[править | править вики-текст]
- •Газовый (респирато́рный) алкалоз[править | править вики-текст]
- •Негазовый алкалоз[править | править вики-текст]
- •Смешанный алкалоз[править | править вики-текст]
- •Патогенез[править | править вики-текст]
- •Лечение[править | править вики-текст]
- •1 Аксиома. Изменение рСо2 крови на 10 мм рт.Ст. Обусловливает реципрокное изменение pH на 0,08.
- •2 Аксиома. Изменение pH на 0,15 является результатом изменения концентрации буферных оснований на 10 ммоль/л.
- •1. 1. Протеиногенные аминокислоты
- •10) Запасная (резервная) функция
- •11) Моторная (двигательная) функция
- •Классификация по типу строения
- •Простые и сложные белки
тяжелые ожоги;
генерализованный перитонит;
непроходимость кишечника;
неукротимая рвота;
профузный понос;
несахарный диабет;
хронический нефрит;
усиленное потоотделение;
диабетический кетоацидоз.
Гипопротеинемия
Снижение концентрации общего белка в сыворотке крови также может быть относительным и абсолютным.
Абсолютная гипопротеинемия, как правило, связана с гипоальбуминемией. При этом уменьшение концентрации общего белка в сыворотке крови возникает при:
недостаточном поступлении белка в организм (голодание, недоедание, сужение пищевода, нарушение функции желудочно-кишечного тракта, например, воспалительного характера — энтериты, энтероколиты и др.);
БИЛЕТ 12
1.
КАРБОНОВЫЕ КИСЛОТЫ,
орг. соед., содержащие карбоксильную
группу СООН.
По кол-ву этих групп различают одно-,
двух- и многоосновные к-ты (см.
также Дикарбоновые
кислоты).
Могут содержать Hal, а также группы NH2,
С=О, ОН (соотв. галогенкарбоновые
кислоты, аминокислоты,
альдегидо- и кетокислоты, оксикислоты).
Алифатич. к-ты, у к-рых число атомов С
вмолекуле больше
6, относят к высшим
жирным кислотам. По
номенклатуре ИЮПАК,
к-ты называют, выбирая за основу наиб.
длинную цепь, содержащую группу СООН,
и добавляя к назв. соединения-основы
окончание "овая" и слово
"к-та"; атому С карбоксильной
группы приписывают
номер 1, напр. СН3(СН2)4СН(СН3)СООН
- 2-метилгептановая к-та. Часто к назв.
соединения-основы добавляют слова
"карбоновая к-та", напр. С6Н11СООН
- циклогексанкарбоновая к-та. При
использовании этого способа наименования
в алифатич. ряду атом Скарбоксильной
группы в
нумерацию цепи не включается. Мн. к-ты
имеют тривиальные названия (см. табл.). В
своб. состоянии к-ты находятся
в плодах нек-рых
растений, крови,
выделениях животных; они входят в
состав жиров,
эфирных и растит. масел, восков.
Важную роль карбоновые кислоты играют
в обмене
веществ. Свойства. Карбоксильная
группа имеет
строение, промежуточное между двумя
предельными структурами:  Группа
планарна; длина связи С=О в разл. к-тах
составляет 0,118-0,126 нм, связи С=О - 0,121-0,137
нм; угол ОСО 118-125,5°; 5,4.1030 Кл.м. В
твердом и жидком состоянии к-ты в
результате возникновения водородных
связей образуют
устойчивые циклические димеры (ф-ла
I).
Группа
планарна; длина связи С=О в разл. к-тах
составляет 0,118-0,126 нм, связи С=О - 0,121-0,137
нм; угол ОСО 118-125,5°; 5,4.1030 Кл.м. В
твердом и жидком состоянии к-ты в
результате возникновения водородных
связей образуют
устойчивые циклические димеры (ф-ла
I). 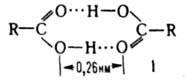 Атомы,
образующие цикл, лежат практически в
одной плоскости, а водородные
связи (энергия
29 кДж/моль)
почти линейны.
Атомы,
образующие цикл, лежат практически в
одной плоскости, а водородные
связи (энергия
29 кДж/моль)
почти линейны. 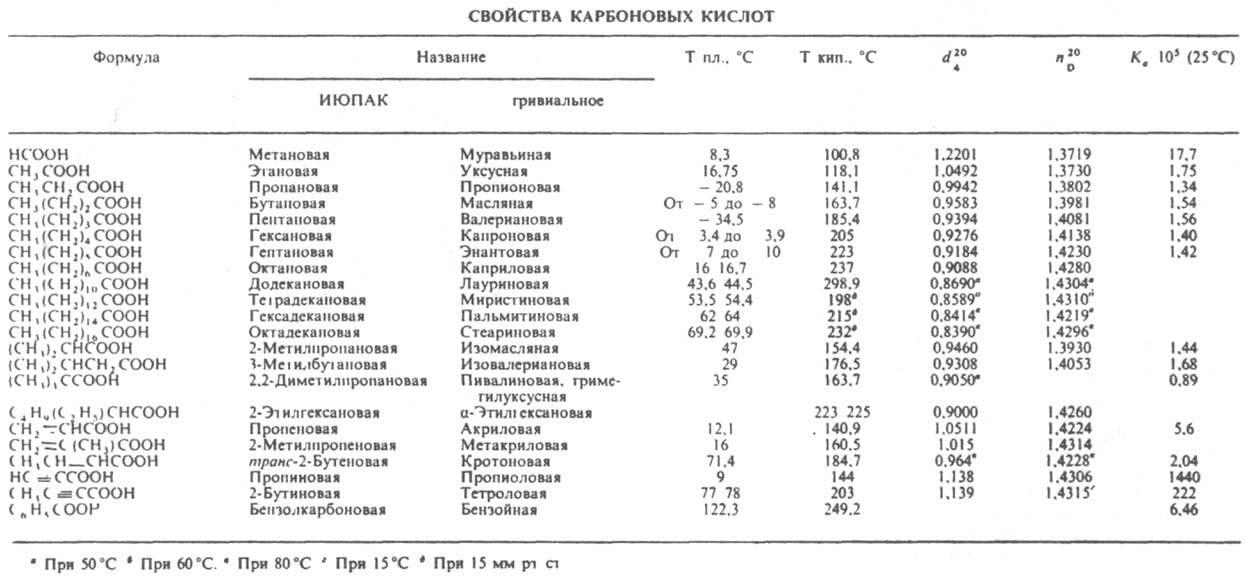 В
р-рах к-т в инертных р-рителях
существует равновесие между
мономером и димером. В водных р-рах к-ты
образуют ациклич. димеры. Насыщ.
неразветвленные к-ты до С9 и
разветвленные до С13 - жидкости,
высшие - твердые в-ва. Т-ры плавления четных
гомологов выше, чем ближайших нечетных.
Высокие т-ры кипения и плавления к-т
по сравнению с соед. с близкой мол.
массой, но не содержащими группы СООН,
обусловлены их димеризацией.
Для неразветвленных насыщ. к-т, начиная
с С5, H0обр линейно
связана с числом атомовуглерода:
- H0обр =
458,8 + 25,5n кДж/моль,
где n - число СН2-групп
в молекуле к-ты.
Расчетная H0обр группы
СООН - 149,6 кДж/моль. Важнейшее
св-во к-т - их способность
кдиссоциации (ионизации)
в водном р-ре с образованием стабилизир.
карбоксилатного аниона и катиона гидроксония:
В
р-рах к-т в инертных р-рителях
существует равновесие между
мономером и димером. В водных р-рах к-ты
образуют ациклич. димеры. Насыщ.
неразветвленные к-ты до С9 и
разветвленные до С13 - жидкости,
высшие - твердые в-ва. Т-ры плавления четных
гомологов выше, чем ближайших нечетных.
Высокие т-ры кипения и плавления к-т
по сравнению с соед. с близкой мол.
массой, но не содержащими группы СООН,
обусловлены их димеризацией.
Для неразветвленных насыщ. к-т, начиная
с С5, H0обр линейно
связана с числом атомовуглерода:
- H0обр =
458,8 + 25,5n кДж/моль,
где n - число СН2-групп
в молекуле к-ты.
Расчетная H0обр группы
СООН - 149,6 кДж/моль. Важнейшее
св-во к-т - их способность
кдиссоциации (ионизации)
в водном р-ре с образованием стабилизир.
карбоксилатного аниона и катиона гидроксония: 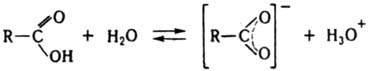 Величина
рКа большинства
алифатич. к-т ок. 4,8. Электроноакцепторные
заместители, в т. ч. кратные
связи,
стабилизирующие карбоксилатный анион,
увеличивают кислотность, электронодонорные
снижают ее, однако в значительно меньшей
степени. Влияние заместителя быстро
падает по мере его отдаления от группы
СОО.
К-ты C1-С3 смешиваются
с водойво
всех соотношениях, с ростом цепи р-римость
падает. ИК спектры к-т характеризуются
след. полосами поглощения (в
см):
Величина
рКа большинства
алифатич. к-т ок. 4,8. Электроноакцепторные
заместители, в т. ч. кратные
связи,
стабилизирующие карбоксилатный анион,
увеличивают кислотность, электронодонорные
снижают ее, однако в значительно меньшей
степени. Влияние заместителя быстро
падает по мере его отдаления от группы
СОО.
К-ты C1-С3 смешиваются
с водойво
всех соотношениях, с ростом цепи р-римость
падает. ИК спектры к-т характеризуются
след. полосами поглощения (в
см): 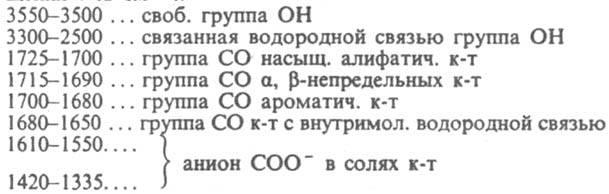 В
УФ спектре к-т имеются слабые полосы
п : *-перехода
при 200-210 нм и более сильные
полосы : *-перехода
при 210-220 нм в случае -ненасыщ.
к-т. Спектры ЯМРхарактеризуются
хим. сдвигом протона карбоксильной
группы при 10,5-12
м.д. Карбоновые кислоты образуют
твердые соли RCOOM.
Na- и К-соли хорошо раств. в воде и
хуже, чем исходные к-ты, в
орг. р-рителях. Соли к-т
от С11 и
выше наз. мылами.
При действии галогенангидридов неорг.
к-т (РОСl3,
РСl5,
РСl3,
SOCl2)
К к. образуют галогенангидриды,
придегидратации - ангидриды. Атака
нуклеоф. агента на атом С карбоксильной
группы лежит
в основе превращ. к-т во мн. производные
(эфиры, амиды, тиоэфиры,
гидразиды и др.), а также р-ций с металлоорг.
соед. и процессов восстановления,
напр.:
В
УФ спектре к-т имеются слабые полосы
п : *-перехода
при 200-210 нм и более сильные
полосы : *-перехода
при 210-220 нм в случае -ненасыщ.
к-т. Спектры ЯМРхарактеризуются
хим. сдвигом протона карбоксильной
группы при 10,5-12
м.д. Карбоновые кислоты образуют
твердые соли RCOOM.
Na- и К-соли хорошо раств. в воде и
хуже, чем исходные к-ты, в
орг. р-рителях. Соли к-т
от С11 и
выше наз. мылами.
При действии галогенангидридов неорг.
к-т (РОСl3,
РСl5,
РСl3,
SOCl2)
К к. образуют галогенангидриды,
придегидратации - ангидриды. Атака
нуклеоф. агента на атом С карбоксильной
группы лежит
в основе превращ. к-т во мн. производные
(эфиры, амиды, тиоэфиры,
гидразиды и др.), а также р-ций с металлоорг.
соед. и процессов восстановления,
напр.: 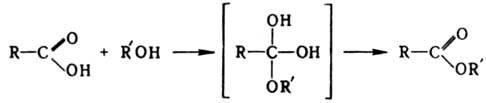 При
образовании эфиров увеличение
электрофильности карбонильного атома С
достигается катализом ионами Н+ или
предварит. превращением к-т в производные.
Кислотный катализосуществляется
неорг. к-тами, сульфокислотами, катионитами,
BF3 и
др. В качестве производных
используют галогенангидриды и ангидриды к-т,
а также реакционноспособные промежуточные
соед., получаемые in situ: О-ацилизомочевины
(при действии на к-ты карбодиимидов),
ацилимидазолиды (при действии
N,N'-карбонилдиимидазола), N-ацилтиопиридины
(при действии дипиридилсульфида
и трифенилфосфина),
N-ацилпиридиниевые соли (при
действии N-галогенпиридиниевых солей)
и др. Металлоорг. соед. реагируют с к-тами
с образованием на первой стадии солей.
Р-ция Li-соли с литийорг. соед. важный
метод синтеза кетонов:
При
образовании эфиров увеличение
электрофильности карбонильного атома С
достигается катализом ионами Н+ или
предварит. превращением к-т в производные.
Кислотный катализосуществляется
неорг. к-тами, сульфокислотами, катионитами,
BF3 и
др. В качестве производных
используют галогенангидриды и ангидриды к-т,
а также реакционноспособные промежуточные
соед., получаемые in situ: О-ацилизомочевины
(при действии на к-ты карбодиимидов),
ацилимидазолиды (при действии
N,N'-карбонилдиимидазола), N-ацилтиопиридины
(при действии дипиридилсульфида
и трифенилфосфина),
N-ацилпиридиниевые соли (при
действии N-галогенпиридиниевых солей)
и др. Металлоорг. соед. реагируют с к-тами
с образованием на первой стадии солей.
Р-ция Li-соли с литийорг. соед. важный
метод синтеза кетонов: 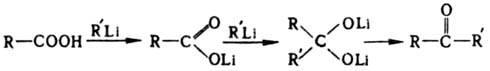 Магнийорг.
соед. реагируют с солями только
в жестких условиях, образуя, как правило,
третичные спирты. Восстановление к-т
приводит к альдегидам и
далее к первичным спиртам.
Избират. превращение к-т в альдегиды достигается
действием Li в метиламине,
где образующийся альдегид защищается
р-рителем в виде азометина:
Магнийорг.
соед. реагируют с солями только
в жестких условиях, образуя, как правило,
третичные спирты. Восстановление к-т
приводит к альдегидам и
далее к первичным спиртам.
Избират. превращение к-т в альдегиды достигается
действием Li в метиламине,
где образующийся альдегид защищается
р-рителем в виде азометина: ![]() Др.
методы восстановления до альдегида требуют
превращ. к-т в их производные.
Так, хлорангидриды восстанавливаются
до альдегидов на
Pd-катализаторах (Розенмунда
реакция),хлорангидриды и ангидриды,
в т.ч. смешанные, действием Na2Fe(CO)4,
иминохлориды - хлористым оловом,
арилсульфонилгидразиды ароматич. к-т
- термич. разложением в присут. Na2CO3,
разл. гетероциклич. производные к-т,
напр., иодалкилаты оксазолинов,
действием NaBH4. Борогидриды не
восстанавливают к-ты, a LiAlH4 восстанавливают
их в спирты. При
одноэлектронном окислении к-т
происходит их декарбоксилирование,
приводящее к радикалам и далее
к карбкатионам:
Др.
методы восстановления до альдегида требуют
превращ. к-т в их производные.
Так, хлорангидриды восстанавливаются
до альдегидов на
Pd-катализаторах (Розенмунда
реакция),хлорангидриды и ангидриды,
в т.ч. смешанные, действием Na2Fe(CO)4,
иминохлориды - хлористым оловом,
арилсульфонилгидразиды ароматич. к-т
- термич. разложением в присут. Na2CO3,
разл. гетероциклич. производные к-т,
напр., иодалкилаты оксазолинов,
действием NaBH4. Борогидриды не
восстанавливают к-ты, a LiAlH4 восстанавливают
их в спирты. При
одноэлектронном окислении к-т
происходит их декарбоксилирование,
приводящее к радикалам и далее
к карбкатионам: 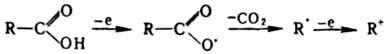 В
зависимости от условий при превращ.
радикалов и карбкатионов образуются
разл. продукты: алканы, алкены,
алкилгалогениды
(см. Декарбоксилирование, Бородина-Хунсдиккера
реакция, Кольбе
реакции). Электроноакцепторные
св-ва группы СООН (константа Тафта *
= 2,1) проявляются в избират. -галогенировании
насыщ. к-т:
В
зависимости от условий при превращ.
радикалов и карбкатионов образуются
разл. продукты: алканы, алкены,
алкилгалогениды
(см. Декарбоксилирование, Бородина-Хунсдиккера
реакция, Кольбе
реакции). Электроноакцепторные
св-ва группы СООН (константа Тафта *
= 2,1) проявляются в избират. -галогенировании
насыщ. к-т: 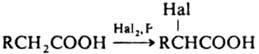 Наряду
с прямым галогенированием в
присут фосфора и
его производных
(Гелля-Фольгарда-Зелинского реакция), используется
также взаимод. с N-хлор- и N-бромсукцинимидами
и иодирование в присут. SOCl2.
При свободнорадикальном хлорировании в
сильнокислой среде к-т от С4 и
выше образуются преим.
продукты хлорирования по атому С-4. Отрицат.мезомерный
эффект группы
СООН (константы Гаммета м =
0,37, n =
0,45) дезактивирует бензольное кольцо
ароматич. к-т, вследствие чего не удается
провести
их алкилирование иацилирование. Галогенирование ароматич.
к-т приводит к мета-производным. Ароматич.
к-ты легко восстанавливаются металлами в
жидком NH3,
образуя дианион, протонируемый и
алкилируемый по -положению,
напр.:
Наряду
с прямым галогенированием в
присут фосфора и
его производных
(Гелля-Фольгарда-Зелинского реакция), используется
также взаимод. с N-хлор- и N-бромсукцинимидами
и иодирование в присут. SOCl2.
При свободнорадикальном хлорировании в
сильнокислой среде к-т от С4 и
выше образуются преим.
продукты хлорирования по атому С-4. Отрицат.мезомерный
эффект группы
СООН (константы Гаммета м =
0,37, n =
0,45) дезактивирует бензольное кольцо
ароматич. к-т, вследствие чего не удается
провести
их алкилирование иацилирование. Галогенирование ароматич.
к-т приводит к мета-производным. Ароматич.
к-ты легко восстанавливаются металлами в
жидком NH3,
образуя дианион, протонируемый и
алкилируемый по -положению,
напр.: 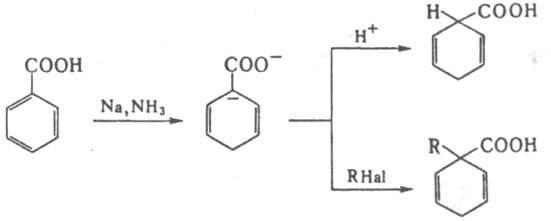 В
аналогичных условиях восстанавливаются двойные
связи -непредельных
к-т. Карбоновые кислоты с
несопряженными двойными
связями восстанавливаются
каталитически. Особая р-ция , -
и -ненасыщ.
к-т - галолактонизация, т.е. образование
галогензамещенных лактонов:
В
аналогичных условиях восстанавливаются двойные
связи -непредельных
к-т. Карбоновые кислоты с
несопряженными двойными
связями восстанавливаются
каталитически. Особая р-ция , -
и -ненасыщ.
к-т - галолактонизация, т.е. образование
галогензамещенных лактонов: 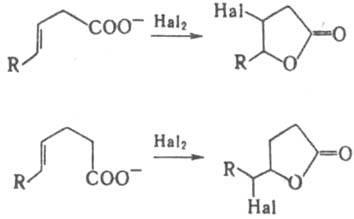 Получение. В
пром-сти наиб. распространены окислительные
и гидролитич. методы, а также
гидрокарбонилирование. Окисление в
присут. солей Со,
Mn, Fe, Ni, Се применяют, напр., при получении
к-т из альдегидов,
уксусной к-ты из бутана,
бензойной к-ты из толуола.
Гидрокарбонилирование (гидрокарбоксилирование)
проводят присоединением СО и Н2О
к алкенам,алкинам, арил(алкил)галогенидам и тозилатам ароматич.
и алифатич. спиртов под давлением в
присут. катализаторов -
комплексов Ph3P
с солями Pd, -аллильных
комплексов Ni либо действием карбонилов
Ni или Со, напр.
Получение. В
пром-сти наиб. распространены окислительные
и гидролитич. методы, а также
гидрокарбонилирование. Окисление в
присут. солей Со,
Mn, Fe, Ni, Се применяют, напр., при получении
к-т из альдегидов,
уксусной к-ты из бутана,
бензойной к-ты из толуола.
Гидрокарбонилирование (гидрокарбоксилирование)
проводят присоединением СО и Н2О
к алкенам,алкинам, арил(алкил)галогенидам и тозилатам ароматич.
и алифатич. спиртов под давлением в
присут. катализаторов -
комплексов Ph3P
с солями Pd, -аллильных
комплексов Ni либо действием карбонилов
Ni или Со, напр. 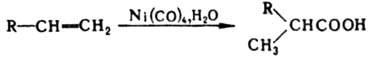 См.
также Карбонилирование, Коха-Хаафа
реакция. Для
получения высших жирных к-т
используют гидролиз животных
жиров и
растит масел,
для получения -галогенкарбоновых
к-тгидролиз трихлорметильной
группы продуктов теломеризации олефинов и
ССl4.
Применяется также щелочное плавление спиртов,
получаемых оксосинтезом (до
С10):
См.
также Карбонилирование, Коха-Хаафа
реакция. Для
получения высших жирных к-т
используют гидролиз животных
жиров и
растит масел,
для получения -галогенкарбоновых
к-тгидролиз трихлорметильной
группы продуктов теломеризации олефинов и
ССl4.
Применяется также щелочное плавление спиртов,
получаемых оксосинтезом (до
С10): ![]() Уксусную
и масляную к-ты получают брожением. Для
препаративного синтеза к-т
используют окисление первичных спиртов и альдегидов. Окислители -
соед. Сr, Мn, в т.ч. солюбилизированный
краун-6-эфиром
КМnО4 в бензоле "пурпурный бензол", кислород в
присут. катализаторов (соли Со,
Fe, Се) или без них, НIO4 и
ее соли,
NaClO4,
система RuO2 +
КIO4,
а также электрохим. окисление. Карбоновые кислоты могут
быть получены
также окислением арилметилкетонов, алкенов, алкинов,
напр.:
Уксусную
и масляную к-ты получают брожением. Для
препаративного синтеза к-т
используют окисление первичных спиртов и альдегидов. Окислители -
соед. Сr, Мn, в т.ч. солюбилизированный
краун-6-эфиром
КМnО4 в бензоле "пурпурный бензол", кислород в
присут. катализаторов (соли Со,
Fe, Се) или без них, НIO4 и
ее соли,
NaClO4,
система RuO2 +
КIO4,
а также электрохим. окисление. Карбоновые кислоты могут
быть получены
также окислением арилметилкетонов, алкенов, алкинов,
напр.: 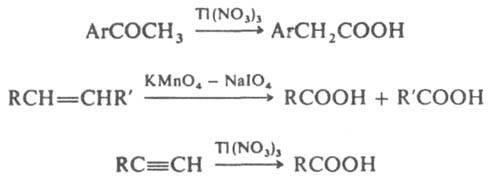 Их
также синтезируют карбоксилированием металлоорг.
соед. или действием СО2 на алкилиденфосфораны (илиды
фосфора):
Их
также синтезируют карбоксилированием металлоорг.
соед. или действием СО2 на алкилиденфосфораны (илиды
фосфора): ![]() Гидролиз эфиров,
амидов, нитрилов и
др. производных к-т является как самостоят.
методом получения к-т, так и составной
частью мн. методов их синтеза, в т.ч.
синтезов с эфирами
малоновой и
ацетоуксусной к-т, р-ции Реформатского.
Классич. гидролиз эфиров
включает разрыв О-ацильной связи под
действием щелочи или
к-ты. Более мягкие и избират
методыгидролиза эфиров
- О-алкильное расщепление их метиловых
эфиров с
помощью Li в ДМФА, этантиолята Li, NaCN в
гексаметаполе, BF3 в
СН2Сl2 и
др. Амиды более устойчивы кгидролизу,
чем эфиры, но легко гидролизуются с
помощью Н2О2 в
щелочной среде или нитрит-иона в
кислой. Карбоновые кислоты получают
также введением в орг. молекулу -карбоксиалкильной
СН2СООН
или карбоксиалкилиденовой =СНСООН
групп. К этим методам относятся классич.
синтезы на основе производных малоновой
и ацетоуксусной к-т и р-ции производных
уксусной к-ты. Превращ. диэтилового
эфира малоновой
к-ты в анион под
действием оснований и
его алкилирование галогеналкилами
приводит к эфирам замещенных малоновой
к-ты, деалкоксикарбонилирование
и гидролиз к-рых
дает к-ты:
Гидролиз эфиров,
амидов, нитрилов и
др. производных к-т является как самостоят.
методом получения к-т, так и составной
частью мн. методов их синтеза, в т.ч.
синтезов с эфирами
малоновой и
ацетоуксусной к-т, р-ции Реформатского.
Классич. гидролиз эфиров
включает разрыв О-ацильной связи под
действием щелочи или
к-ты. Более мягкие и избират
методыгидролиза эфиров
- О-алкильное расщепление их метиловых
эфиров с
помощью Li в ДМФА, этантиолята Li, NaCN в
гексаметаполе, BF3 в
СН2Сl2 и
др. Амиды более устойчивы кгидролизу,
чем эфиры, но легко гидролизуются с
помощью Н2О2 в
щелочной среде или нитрит-иона в
кислой. Карбоновые кислоты получают
также введением в орг. молекулу -карбоксиалкильной
СН2СООН
или карбоксиалкилиденовой =СНСООН
групп. К этим методам относятся классич.
синтезы на основе производных малоновой
и ацетоуксусной к-т и р-ции производных
уксусной к-ты. Превращ. диэтилового
эфира малоновой
к-ты в анион под
действием оснований и
его алкилирование галогеналкилами
приводит к эфирам замещенных малоновой
к-ты, деалкоксикарбонилирование
и гидролиз к-рых
дает к-ты: 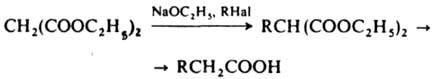 Применение
диизопропиламида лития и
др. аналогичных амидов позволило получать
устойчивые дианионы монокарбоновых
к-т и непосредственно вводить группу
—СН2СООН:
Применение
диизопропиламида лития и
др. аналогичных амидов позволило получать
устойчивые дианионы монокарбоновых
к-т и непосредственно вводить группу
—СН2СООН: ![]() Др.
способ введения этой группы р-ции
эфиров -галогенкарбоновых
к-т с карбонильными соед. в присут. Zn или
с алкилиденфосфораном и
послед. гидролиз (см. Реформатского
реакция, Виттига
реакция).
Используют также радикальное присоединение
эфиров к-т к алкенам или аренам в
присут. пероксидов,
напр.:
Др.
способ введения этой группы р-ции
эфиров -галогенкарбоновых
к-т с карбонильными соед. в присут. Zn или
с алкилиденфосфораном и
послед. гидролиз (см. Реформатского
реакция, Виттига
реакция).
Используют также радикальное присоединение
эфиров к-т к алкенам или аренам в
присут. пероксидов,
напр.: 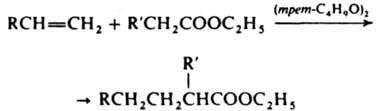 Для
получения к-т из кетонов
используют Байера-Виллигера
реакцию. Галоформную
реакцию,
из альдегидов Канниццаро
реакцию К-ты
синтезируются с помощью перегруппировок
и р-ций конденсации (см. Дарзана
реакция,
Кнёвенагеля реакция, Михаэля
реакция, Перкина
реакция, Фаворского
реакции). Имеется
неск. методов, применяемых только для
синтеза ароматич. карбоновых кислот,
напр., карбоксилирование фенолятов металлов (Кольбе-Шмитта
реакция)и
р-ция Фриделя - Крафтса с
использованием фосгена:
Для
получения к-т из кетонов
используют Байера-Виллигера
реакцию. Галоформную
реакцию,
из альдегидов Канниццаро
реакцию К-ты
синтезируются с помощью перегруппировок
и р-ций конденсации (см. Дарзана
реакция,
Кнёвенагеля реакция, Михаэля
реакция, Перкина
реакция, Фаворского
реакции). Имеется
неск. методов, применяемых только для
синтеза ароматич. карбоновых кислот,
напр., карбоксилирование фенолятов металлов (Кольбе-Шмитта
реакция)и
р-ция Фриделя - Крафтса с
использованием фосгена: 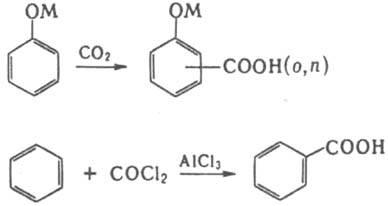 Разработаны
спец. методы превращ. к-т в высшие
гомологи, напр. Арндта- Айстерта реакция,
и перевод в низший гомолог:
Разработаны
спец. методы превращ. к-т в высшие
гомологи, напр. Арндта- Айстерта реакция,
и перевод в низший гомолог: 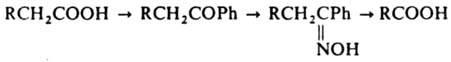 Определение. Качеств.
анализ основан на определении рН водных
или водно-спиртовых р-ров, выделении
к-тами СО2 из
р-ров NaHCO3,
образовании нерастворимых солей Рb
и Ag. Цветная р-ция - превращ. карбоновых кислот в
гидроксамовые к-ты и образование
окрашенных гидроксаматов Fe. К-ты образуют
ряд производных с четкой т-рой плавления,
применяемых для их идентификации (анилиды,
фенациловые эфиры, уреиды, соли S-бензилизотиурония,
гидразиды). Методы количеств. анализа
включают водное и неводноетитрование,
определение активного водорода,
напр., методом
Церевитинова,
превращ. в гидроксамовые к-ты и их
колориметрич. определение, этерификацию метанолом и
определение кол-ва выделившейся воды реактивом
Фишера, декарбоксилирование и
определение выделившегося СО2.
Широко используются тонкослойная и
газожидкостная хроматографии. Применение. К-ты
исходные соед. для получения промежут.
продуктов орг. синтеза, в
частности кетенов, галогенангидридов, виниловых
эфиров,
галогенкислот. Соли карбоновых кислоти щелочных
металлов применяют
как мыла, эмульгаторы, смазочные
масла; соли тяжелых металлов - сиккативы, инсектициды и фунгициды, катализаторы.
Эфиры к-т - пищ. добавки,
р-рители; моно- и диэфиры гликолей и
полигликолей пластификаторы,
компоненты лаков и алкидных
смол; эфиры
целлюлозы -
компоненты лаков и пластмассы.
Амиды к-т эмульгаторы и
флотоагенты. Об индивидуальных к-тах
см., напр., в ст. Акриловая
кислота, Бензойная
кислота. Масляная
кислота, Муравьиная
кислота, Уксусная
кислота.
===
Определение. Качеств.
анализ основан на определении рН водных
или водно-спиртовых р-ров, выделении
к-тами СО2 из
р-ров NaHCO3,
образовании нерастворимых солей Рb
и Ag. Цветная р-ция - превращ. карбоновых кислот в
гидроксамовые к-ты и образование
окрашенных гидроксаматов Fe. К-ты образуют
ряд производных с четкой т-рой плавления,
применяемых для их идентификации (анилиды,
фенациловые эфиры, уреиды, соли S-бензилизотиурония,
гидразиды). Методы количеств. анализа
включают водное и неводноетитрование,
определение активного водорода,
напр., методом
Церевитинова,
превращ. в гидроксамовые к-ты и их
колориметрич. определение, этерификацию метанолом и
определение кол-ва выделившейся воды реактивом
Фишера, декарбоксилирование и
определение выделившегося СО2.
Широко используются тонкослойная и
газожидкостная хроматографии. Применение. К-ты
исходные соед. для получения промежут.
продуктов орг. синтеза, в
частности кетенов, галогенангидридов, виниловых
эфиров,
галогенкислот. Соли карбоновых кислоти щелочных
металлов применяют
как мыла, эмульгаторы, смазочные
масла; соли тяжелых металлов - сиккативы, инсектициды и фунгициды, катализаторы.
Эфиры к-т - пищ. добавки,
р-рители; моно- и диэфиры гликолей и
полигликолей пластификаторы,
компоненты лаков и алкидных
смол; эфиры
целлюлозы -
компоненты лаков и пластмассы.
Амиды к-т эмульгаторы и
флотоагенты. Об индивидуальных к-тах
см., напр., в ст. Акриловая
кислота, Бензойная
кислота. Масляная
кислота, Муравьиная
кислота, Уксусная
кислота.
===
2. Онкотическое давление плазмы обусловлено белками. Величина онкотического давления колеблется в пределах от 3,325 кПа до 3,99 кПа (25—30 мм рт. ст.). За счет него жидкость (вода) удерживается в сосудистом русле. Из белков плазмы наибольшее участие в обеспечении величины онкотического давления принимаютальбумины; вследствие малых размеров и высокой гидрофильности они обладают выраженной способностью притягивать к себе воду.
Постоянство коллоидно-осмотического давления крови у высокоорганизованных животных является общим законом, без которого невозможно их нормальное существование.
Представляет собой часть осмотического давления крови, создаваемую белками плазмы. Его величина колеблется в пределах 25—30 мм рт. ст. и на 80 определяется альбуминами вследствие их малых размеров и наибольшего содержания в плазме крови. Онкотическое давление играет важную роль в регуляции обмена воды в организме, а именно в ее удержании в кровеносном сосудистом русле. Онкотическое давление влияет на образование тканевой жидкости, лимфы, мочи, всасывание воды из кишечника. При понижении онкотического давления плазмы (например, при болезнях печени, когда снижено образование альбуминов, или болезнях почек, когда повышено выделение белков с мочой) развиваются отеки, так как вода плохо удерживается в сосудах и переходит в ткани.
СМ В УЧ
3.А. Обратимое ингибирование
Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными.
