
- •2.Строение и уровни структурной организации белков
- •3. Найти самой4. Определение общего белка в сыворотке крови по биуретовой реакции
- •Гипопротеинемия
- •Азотистые основания.
- •Нуклеозиды.
- •2. Оксокислоты
- •Химические свойства.
- •1.3. Биологически важные гидроксикислоты.
- •2. Оксокислоты
- •2.2. Химические свойства
- •1. Протеиногенные аминокислоты
- •1. "Альдегиды. Кетоны".
- •Осмотическое давление
- •Критерии ароматичности[править | править вики-текст]
- •4. Определение общего белка в сыворотке крови по биуретовой реакции
- •Гипопротеинемия
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •1. Специфические и неспецифические ингибиторы
- •Обратимое ингибирование
- •Неконкурентное ингибирование
- •Ингибирование субстратом[править | править вики-текст]
- •Аллостерическое ингибирование[править | править вики-текст]
- •Значения pH в растворах различной кислотности[править | править вики-текст]
- •Методы определения значения pH[править | править вики-текст]
- •3.Лекарственные препараты как конкурентные ингибиторы
- •2. Оксокислоты
- •Химические свойства.
- •1.3. Биологически важные гидроксикислоты.
- •2. Оксокислоты
- •2.2. Химические свойства
- •Причины ацидоза[править | править вики-текст]
- •Классификации ацидоза[править | править вики-текст]
- •Лечение[править | править вики-текст]
- •Классификация[править | править вики-текст]
- •Этиология[править | править вики-текст]
- •Газовый (респирато́рный) алкалоз[править | править вики-текст]
- •Негазовый алкалоз[править | править вики-текст]
- •Смешанный алкалоз[править | править вики-текст]
- •Патогенез[править | править вики-текст]
- •Лечение[править | править вики-текст]
- •1 Аксиома. Изменение рСо2 крови на 10 мм рт.Ст. Обусловливает реципрокное изменение pH на 0,08.
- •2 Аксиома. Изменение pH на 0,15 является результатом изменения концентрации буферных оснований на 10 ммоль/л.
- •1. 1. Протеиногенные аминокислоты
- •10) Запасная (резервная) функция
- •11) Моторная (двигательная) функция
- •Классификация по типу строения
- •Простые и сложные белки
1. 1. Протеиногенные аминокислоты
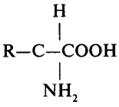
Структурными блоками или мономерами белков служат α-аминокислоты L-ряда (см. табл. 4). Общая формула α-аминокислот имеет следующий вид:
14
Выделенное звено формулы α-аминокислоты является неизменным для всех протеиногенных аминокислот, его можно назватьаминокислотным блоком. Аминокислоты различаются по структуре бокового радикала (R), а следовательно, и по физико-химическим свойствам, присущим этим радикалам.
По кислотно-основным свойствам аминокислоты делят в зависимости от физико-химических свойств бокового радикала на три группы: кислые, основные и нейтральные.
К кислым относятся аминокислоты с карбоксильными группами в боковом радикале: аспарагиновая и глутаминовая кислоты. Косновным относятся аминокислоты лизин, аргинин и гистидин, имеющие в боковом радикале группировку с основными свойствами: аминогруппу, гуанидиновую и имидазольную группы. Все остальные аминокислоты - нейтральные, так как их боковой радикал не проявляет ни кислых, ни основных свойств.
Следовательно, аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд, зависящий от рН-среды. Значение рН-среды, при котором заряд аминокислоты равен нулю, называется изоэлектрической точкой. Изоэлектрическая точка отражает кислотно-основные свойства разных групп в аминокислотах и является одной из важных констант, характеризующих аминокислоту.
По биологическому значению аминокислоты подразделяются на заменимые, полузаменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека в достаточном количестве. К ним относятся глицин, аланин, серин, цистеин, тирозин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин.
Полузаменимые аминокислоты образуются в организме, но в недостаточном количестве, поэтому их недостаток должен восполняться белковой пищей. Для организма человека такими аминокислотами являются тирозин, аргинин, гистидин.
Незаменимые аминокислоты в организме человека не синтезируются, поэтому они должны поступать с пищей. Незаменимых аминокислот восемь: валин, лейцин, изолейцин, треонин, лизин, метионин, фенилаланин, триптофан.
Аминокислотный состав белков определяется не доступностью или незаменимостью той или иной аминокислоты, а назначением белка, его биологической функцией. В настоящее время определен аминокислотный состав многих сотен белков.
Примерами олигомерных белков могут служить эритроцитарный белок гемоглобин, фермент фосфофруктокиназа и многие другие.
Более подробно структурная организация и функционирование олигомерных белков будут рассмотрены в следующей теме на примере гемоглобина (рисунок 2.3).
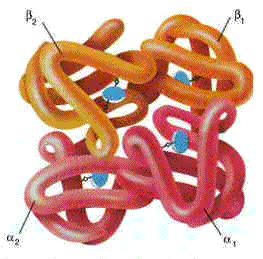
Рисунок 2.3. Пространственное строение гемоглобина. В состав его молекулы входят четыре попарно одинаковые субъединицы, обозначаемые буквами α и β. Небелковая часть гемоглобина — гем — показана синим цветом.
2. Буферные системы, буферные растворы, буферные смеси, системы, поддерживающие определённуюконцентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним некоторых количеств кислот или оснований.
|
| |
|
|
|
СОСТАВ БУФФЕРНЫХ СИСТЕМ
Буферные системы, буферные растворы, буферные смеси, системы, поддерживающие определённуюконцентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним некоторых количеств кислот или оснований.
|
| |
|
|
|
Определение рН и буферной емкости ацетатной буферной системы Например, ацетатный буферный раствор (CH3COO-, CH3COOH) или гидрокарбонатный буферный раствор (HCO3-, H2CO3). рН кислотной буферной системы можно рассчитать по уравнению: pH = - lg H + [ ] C кислоты , С соли C = - lg K A - lg кислоты C соли [H ] = K + A × (2.11) где КА – константа диссоциации слабой кислоты. Изучение влияния разбавления и добавления сильных кислот и щелочей на рН этих систем.
СМ В УЧЕБНИКЕ
3. Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров Протеинкиназы - группа ферментов, катализирующих перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (вызывают фосфорилирование белков). Механизмы активации различных протеинкиназ неодинаковы. В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно привести регуляцию активности фермента Протеинкиназы А.
Протеинкиназа А (цАМФ-зависимая) состоит из 4 субъединиц 2 типов: 2 регуляторных (R) и 2 каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3',5'-АМФ (цАМФ), по 2 на каждую субъединицу. Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конфор-мации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы (рис. 2-32). Такой механизм регуляции обратим. Отщепление молекул цАМФ от регуляторных субъединиц приведёт к ассоциации регуляторных и каталитических субъединиц Протеинкиназы А с образованием неактивного комплекса.
115
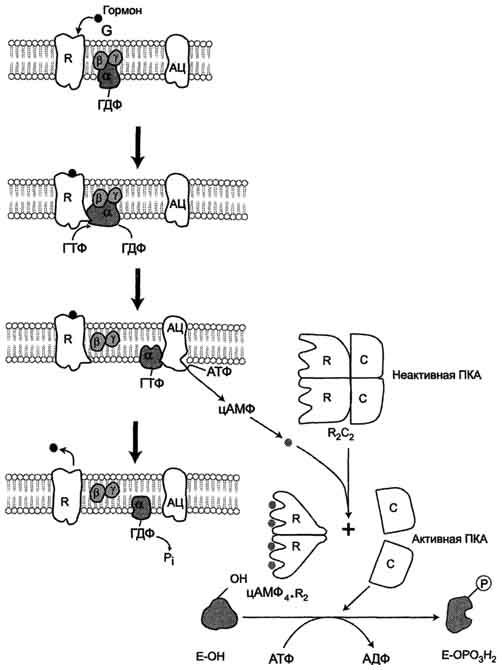
Рис. 2-32. Регуляция активности аденилатциклазы. Гормон (Г), взаимодействуя с рецептором (R) на поверхности клеток, приводит к уменьшению сродства ГТФ-связывающего белка (G-белка, состоящего из протомеров α, β, γ) к ГТФ и увеличению сродства к ГТФ. Присоединение молекулы ГТФ к активному центру G-белка вызывает диссоциацию комплекса на субъединицы α-ГТФ и димер βγ. Комплекс α-ГТФ активирует аденилатциклазу, что способствует синтезу из АТФ внутриклеточных регуляторных молекул цАМФ. АЦ - аденилатциклаза, ПКА - протеинкиназа А, Рi - Н3РО4.
4.
БИЛЕТ 16
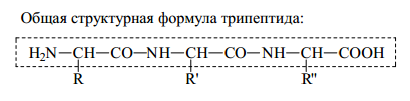
1.Белки – это высокомолекулярные биополимеры, состоящие из остатков аминокислотФункции белков.
1) структурная (пластическая, опорная) – определяет структуру тела человека, растений, животных, вирусов, микроорганизмов, входят в состав различных биологических мембран. Имеется целая группа белков, для которых эта функция является основной – коллагены, эластины, кератины.
мономеры актина и тубулина — это глобулярные, растворимые белки, но после полимеризации они формируют длинные нити, из которых состоит цитоскелет, позволяющий клетке поддерживать форму[70]. Коллаген и эластин — основные компоненты межклеточного вещества соединительной ткани (например, хряща), а из другого структурного белка кератина состоят волосы, ногти, перья птиц и некоторые раковины.
2) Каталитическая – белки обладают свойствами биокатализаторов (ферментов), ускоряя течение биологических процессов в организме.
КФ 1: Оксидоредуктазы, катализирующие окислительно-восстановительные реакции;
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую;
КФ 3: Гидролазы, катализирующие гидролиз химических связей;
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов;
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата;
КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счёт гидролиза дифосфатной связи АТФ или сходного трифосфата.
3) Энергетическая – за счет части аминокислот. На долю белка приходится 10-20% энергопотребления у человека.
4) Транспортная – белки переносят с кровью и другими биологическими жидкостями вещества, нерастворимые в воде (витамины, металлы, липиды, газы) и способствуют транспорту этих веществ через мембраны.
5) Защитная – а) белки стоят на страже химической индивидуальности вида (при поступлении чужеродного белка – антигена, несущего «чужую» генетическую или химическую информацию в организме вырабатываются антитела, образуется комплекс антиген-антитело и он исключается из метаболического круга путем осаждения, лизиса и т.д. б) защита организма при ранении путем свертывания крови (только у млекопитающих). Для выполнения этой функции в организме образовался целый комплекс белков, главным из них является фибриноген. Плазмин – белок плазмы крови, ускоряющий расщепление фибрина. Это обеспечивает восстановление проходимости сосудов, закупоренных фибриновым сгустком. В) связывание токсических веществ, поступивших извне или образовавшихся в результате метаболических реакций (например, альбумины плазмы крови связывают билирубин, СЖК, лекарства). Г) антитела – гамма-глобулины, или иммуноглобулины – защищают от антигенов (чужеродных белков и высокомолекулярных углеводов). Д) интерфероны – блокируют синтез вирусных белков путем индукции синтеза ряда внутриклеточных ферментов.
Существует несколько видов защитных функций белков:
Физическая защита. Физическую защиту организма обеспечивают коллаген — белок, образующий основу межклеточного вещества соединительных тканей (в том числе костей, хряща, сухожилий и глубоких слоёв кожи (дермы)); кератин, составляющий основу роговых щитков, волос, перьев, рогов и др. производныхэпидермиса. Обычно такие белки рассматривают как белки со структурной функцией. Примерами белков этой группы служат фибриногены и тромбины[71], участвующие в свёртывании крови.
Химическая защита. Связывание токсинов белковыми молекулами может обеспечивать их детоксикацию. Особенно важную роль в детоксикации у человека играют ферменты печени, расщепляющие яды или переводящие их в растворимую форму, что способствует их быстрому выведению из организма[72].
Иммунная защита. Белки, входящие в состав кров и других биологических жидкостей, участвуют в защитном ответе организма как на повреждение, так и на атаку патогенов. Белкисистемы комплемента и антитела (иммуноглобулины) относятся к белкам второй группы; они нейтрализуютбактерии, вирусы или чужеродные белки. Антитела, входящие в состав адаптативной иммунной системы, присоединяются к чужеродным для данного организма веществам, антигенам, и тем самым нейтрализуют их, направляя к местам уничтожения. Антитела могут секретироваться в межклеточное пространство или закрепляться в мембранах специализированных В-лимфоцитов, которые называются плазмоцитами[73].
6) Сократительная – обеспечивает способность к перемещению тела в пространстве, сокращение сердца, дыхание, перистальтику кишечника и др.
7) Регуляторная – белки играют важную роль в обменных процессах, осуществляют связь внутренней среды организма с внешней средой. Это гормоны, ферменты, БАВ, пептиды и т.д.). Рецепторы, через которые осуществляются регуляторные процессы также являются белками.
Регуляторную функцию белки осуществляют либо за счёт ферментативной активности (например, протеинкиназы), либо за счёт специфичного связывания с другими молекулами. Так, факторы транскрипции, белки-активаторы и белки-репрессоры, могут регулировать интенсивность транскрипции генов, связываясь с их регуляторными последовательностями. На уровне трансляции считывание многих мРНК также регулируется присоединением белковых факторов[74].
Важнейшую роль в регуляции внутриклеточных процессов играют протеинкиназы и протеинфосфатазы — ферменты, которые активируют или подавляют активность других белков путём присоединения к ним или отщепления фосфатных групп.
Сигнальную функцию выполняют белки-гормоны, цитокины, факторы роста и др.
Гормоны переносятся кровью. Большинство гормонов животных — это белки или пептиды. Связывание гормона с его рецептором является сигналом, запускающим ответную реакцию клетки. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Примером таких белков служит инсулин, который регулирует концентрацию глюкозы в крови.
Клетки взаимодействуют друг с другом с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся, например, цитокины и факторы роста.
Цитокины — пептидные сигнальные молекулы. Они регулируют взаимодействия между клетками, определяют их выживаемость, стимулируют или подавляют рост, дифференцировку, функциональную активность и апоптоз, обеспечивают согласованность действий иммунной, эндокринной и нервной систем. Примером цитокинов может служить фактор некроза опухоли, который передаёт сигналы воспаления между клетками организма[
8) Трансформирующая – белки участвуют в превращении электрической и осмотической энергии в химическую энергию АТФ.
Некоторые мембранные белки участвуют в транспорте малых молекул через мембрану клетки, изменяя её проницаемость. Липидный компонент мембраны водонепроницаем (гидрофобен), что предотвращает диффузию полярных или заряженных (ионы) молекул.
Белки-переносчики связывают, подобно ферментам, каждую переносимую молекулу или ион и, в отличие от каналов, могут осуществлять активный транспорт с использованием энергии АТФ. «Электростанция клетки» — АТФ-синтаза, которая осуществляет синтез АТФ за счёт протонного градиента, также может быть отнесена к мембранным транспортным белкам
9) Передача наследственных признаков. Белки «запускают» процесс передачи наследственной информации и контролируют его на всем протяжении.
Кроме того, белки способствуют поддержанию стабильного онкотического давления, входят в состав буферных систем, поддерживающих рН внутренней среды и т.д.
