
- •Молекулярна фізика та термодинаміка
- •6. Молекулярна фізика
- •6.1. Вступ
- •6.2. Імовірність та флуктуації
- •6.3. Ідеальний газ та його характеристики
- •6.3.1. Температура
- •2).Шкала Фаренгейта
- •3).Шкала температури Кельвіна
- •6.4. Енергія частинки ідеального газу
- •6.4.1.Теорема Больцмана про рівнорозподіл енергії. Енергія частинки
- •6.5. Внутрішня енергія ідеального газу
- •6.6. Молекулярно кінетична теорія для тиску
- •6.7. Ефективний діаметр та ефективний переріз розсіювання
- •6.8. Кінематичні характеристики ідеального газу
- •6.8.1. Статистичний розподіл частинок за напрямком руху
- •6.8.2. Число зіткнень частинки за одиницю часу
- •6.8.3. Середня довжина вільного пробігу
- •6.9. Розподіл Максвелла для частинок за швидкостями
- •6.9.1. Закон розподілу
- •6.9.2. Максимум густини розподілу
- •6.9.3. Середня арифметична швидкість
- •6.9. 4. Середня квадратична швидкість визначається як
- •6.9.5. Експериментальна перевірка розподілу Максвелла
- •6.10. Барометрична формула та розподіл Больцмана
- •6.10.1. Барометрична формула
- •6.10.2. Розподіл Больцмана
- •6.11. Розподіл Максвелла - Больцмана
- •6.11.1. Розподіл Максвелла за значеннями кінетичної енергії
- •6.11.2. Розподіл Максвелла - Больцмана
- •6.12. Явища переносу
- •6.13. Дифузія
- •6.14. Теплопровідність
- •6.15. Внутрішнє тертя
- •6.16. Контрольні питання
6.5. Внутрішня енергія ідеального газу
Внутрішня теплова енергія
ідеального газу.
Якщо частинка має масу m0,
а газ має - m, то він має
![]() частинок, а його внутрішня енергія
теплового руху дорівнює
частинок, а його внутрішня енергія
теплового руху дорівнює
![]() ,
,
де
![]() молярна
маса, або
молярна
маса, або
U =
![]() .
(4)
.
(4)
Якщо врахувати, що стан ідеального газу визначається рівнянням Клапейрона-Менделєєва
![]() ,
,
то вираз для внутрішньої енергії прийме вид
![]() .
(5)
.
(5)
6.6. Молекулярно кінетична теорія для тиску
Якщо на плоску поверхню
площею S
з нормаллю
![]() діє сила
діє сила![]() ,
то під тиском Р розуміють
границю відношення величини нормальної
складової сили
,
то під тиском Р розуміють
границю відношення величини нормальної
складової сили
![]() доS
доS
![]() .
.
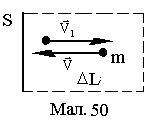 Співударяючись
із стінками посудини, в якій знаходиться
ідеальний газ, частинки створюють
середню силу <F>
дії на одиницю поверхні, тобто створюють
тиск Р. Як показав Максвел, цей тиск
не залежить від того,
що співударяння з стінками пружні чи
не пружні. Знайдемо тиск газу у наближенні
абсолютно пружного співударяння частинок
із стінкою. Для цього покладемо, що
частинка перед ударом має швидкість
Співударяючись
із стінками посудини, в якій знаходиться
ідеальний газ, частинки створюють
середню силу <F>
дії на одиницю поверхні, тобто створюють
тиск Р. Як показав Максвел, цей тиск
не залежить від того,
що співударяння з стінками пружні чи
не пружні. Знайдемо тиск газу у наближенні
абсолютно пружного співударяння частинок
із стінкою. Для цього покладемо, що
частинка перед ударом має швидкість
![]() ,
котра направлена перпендикулярно
поверхні стінки (див.Мал.50).
Після абсолютно пружного співударяння,
частинка змінить напрямок швидкості
на протилежний і її приріст імпульсу
складатиме
,
котра направлена перпендикулярно
поверхні стінки (див.Мал.50).
Після абсолютно пружного співударяння,
частинка змінить напрямок швидкості
на протилежний і її приріст імпульсу
складатиме
![]()
Якщо концентрація частинок дорівнює n, то у поперечному напрямку до стінки буде рухатися n/6 частинок (маємо один з 6 напрямків декартових координат). За час t стінки досягнуть усі частинки, котрі знаходяться на відстані від неї L=Vt. Якщо розглянути одиничну поверхню S, то за цей час із стінкою співударяться
N=nSL/6. (1)
частинок і стінці буде передано імпульс
P=Np=2mVnSVt/6=nmV2t/3. (2)
За другим законом Ньютона на стінку буде діяти сила
![]() .
.
Знайдемо
середню силу <F>=n<mV2>/3,
що діє
![]() на стінку одиничної площі
на стінку одиничної площі
S і фактично є тиском Р, який створюється частинками газу, тобто
Р=n<mV2>/3.
Величина <mV2>/2 є середньою кінетичною енергією теплового руху частинки. Якщо газ одноатомний з і=3, то, враховуючи 6.4.2. (3), одержимо
<mV2>=3kT
і тоді
P=nkT. (3)
6.7. Ефективний діаметр та ефективний переріз розсіювання
Знаходячись у неперервному тепловому русі частинки газу співударяються, змінюючи напрямок руху і швидкість. У цьому питанні важливим для розгляду розсіювання є оцінка динамічного розміру частинки.
Ефективним діаметром
![]() частинок ідеального
газу є найменша відстань між центрами
двох частинок, які здійснюють центральний
пружний удар. За порядком величини
частинок ідеального
газу є найменша відстань між центрами
двох частинок, які здійснюють центральний
пружний удар. За порядком величини
![]() .
.
Нижче в Таблиці 1 наведені значення ефективного діаметра для деяких газів.
Таблиця 1. Значення ефективного діаметра деяких молекул
|
Газ |
Азот |
Аргон |
Кисень |
Водень |
Гелій |
|
d·1010 м |
3,75 |
3,64 |
3,61 |
2,74 |
2,18 |
Ефективний газокінетичний
поперечний переріз
еф
дорівнює площі круга з радіусом
![]()
![]() .
.
Властивістю ефективного
перерізу є те, що дві частинки, які
одночасно проходять через
![]() ,
обов'язково співударяються.
,
обов'язково співударяються.
6.8. Кінематичні характеристики ідеального газу
6.8.1. Статистичний розподіл частинок за напрямком руху
Хаотичність теплового руху n частинок ідеального газу означає їх рівнорозподіл руху за напрямками швидкостей, а саме: усі напрямки теплового руху рівно ймовірні. Якщо в простір частинок увести декартову систему координат із 3-ма осями x, y, z і 6-ма напрямками по ним (), то в кожному з них рухається
![]()
частинок. Наприклад, якщо частинки мають середню швидкість теплового руху V, то в додатному напрямку осі ОХ через перпендикулярну до неї площину S за час dt пройдуть всі частинки, що знаходяться на відстані dL = V·dt в об'ємі dLS, а їх загальне число становить
![]() .
.
