
- •Молекулярна фізика та термодинаміка
- •6. Молекулярна фізика
- •6.1. Вступ
- •6.2. Імовірність та флуктуації
- •6.3. Ідеальний газ та його характеристики
- •6.3.1. Температура
- •2).Шкала Фаренгейта
- •3).Шкала температури Кельвіна
- •6.4. Енергія частинки ідеального газу
- •6.4.1.Теорема Больцмана про рівнорозподіл енергії. Енергія частинки
- •6.5. Внутрішня енергія ідеального газу
- •6.6. Молекулярно кінетична теорія для тиску
- •6.7. Ефективний діаметр та ефективний переріз розсіювання
- •6.8. Кінематичні характеристики ідеального газу
- •6.8.1. Статистичний розподіл частинок за напрямком руху
- •6.8.2. Число зіткнень частинки за одиницю часу
- •6.8.3. Середня довжина вільного пробігу
- •6.9. Розподіл Максвелла для частинок за швидкостями
- •6.9.1. Закон розподілу
- •6.9.2. Максимум густини розподілу
- •6.9.3. Середня арифметична швидкість
- •6.9. 4. Середня квадратична швидкість визначається як
- •6.9.5. Експериментальна перевірка розподілу Максвелла
- •6.10. Барометрична формула та розподіл Больцмана
- •6.10.1. Барометрична формула
- •6.10.2. Розподіл Больцмана
- •6.11. Розподіл Максвелла - Больцмана
- •6.11.1. Розподіл Максвелла за значеннями кінетичної енергії
- •6.11.2. Розподіл Максвелла - Больцмана
- •6.12. Явища переносу
- •6.13. Дифузія
- •6.14. Теплопровідність
- •6.15. Внутрішнє тертя
- •6.16. Контрольні питання
Молекулярна фізика та термодинаміка
6. Молекулярна фізика
6.1. Вступ
Молекулярна фізика наука, що вивчає фізичні властивості та агрегатні стани речовини в залежності від її молекулярної будови, сил взаємодії між структурними частинками - атомами чи молекулами та характеру теплового руху цих частинок. Молекули складаються з атомів. У складі атомів є однакове число електронів і протонів, та нейтрони. Протони та нейтрони утворюють ядро атома. Іон являє собою заряджений атом.
На малих відстанях між
частинками речовини (r~10-9
м) виникає сила притягання
![]() ,
а при ще менших відстанях
виникає сила відштовхування
,
а при ще менших відстанях
виникає сила відштовхування ![]() .
Ці сили прикладені до частинки, лежать
на одній прямій і протилежно направлені.
На відстані
.
Ці сили прикладені до частинки, лежать
на одній прямій і протилежно направлені.
На відстані
![]() рівнодійна сил
рівнодійна сил
![]() і точка з координатою
і точка з координатою
![]() є точкою рівноваги. При малих відхиленнях
від положення рівноваги, рівнодійна
сила лінійно залежить від г і може
створювати коливальний рух. На Mал.49
наведена залежність рівнодійної сили
в залежності від відстані між частинками.
є точкою рівноваги. При малих відхиленнях
від положення рівноваги, рівнодійна
сила лінійно залежить від г і може
створювати коливальний рух. На Mал.49
наведена залежність рівнодійної сили
в залежності від відстані між частинками.
В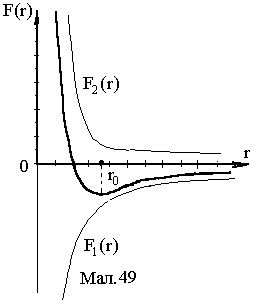 елике
число частинок речовини досліджується
статистичним методом.Статистичний
метод -
метод, що вивчає властивості макроскопічних
систем на підставі ймовірнісного та
статистичного аналізу закономірностей
теплового руху великого числа
мікрочастинок, що складають ці системи.
За допомогою молекулярно-кінетичної
теорії визначаються такі властивості
термодинамічних систем
елике
число частинок речовини досліджується
статистичним методом.Статистичний
метод -
метод, що вивчає властивості макроскопічних
систем на підставі ймовірнісного та
статистичного аналізу закономірностей
теплового руху великого числа
мікрочастинок, що складають ці системи.
За допомогою молекулярно-кінетичної
теорії визначаються такі властивості
термодинамічних систем
тиск,
температура,
енергія,
теплоємність,
явища переносу та інше.
В основі молекулярно-кінетичної теорії лежать три положення:
усі фізичні тіла складаються з великого числа частинок молекул, атомів або іонів, розміри яких складають
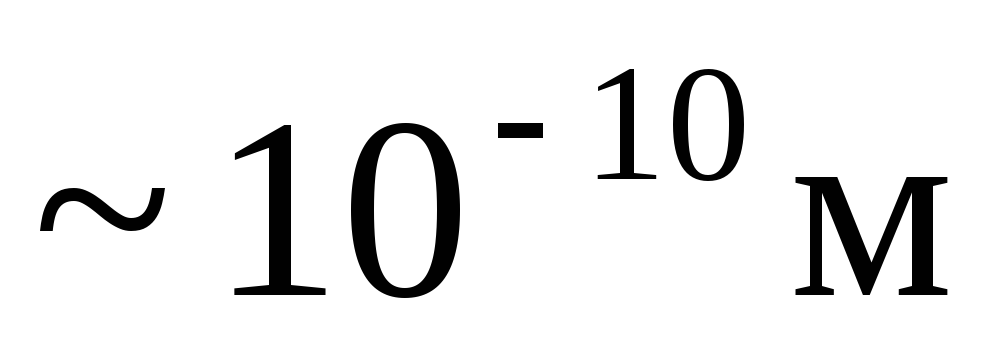 ,
,частинки речовини постійно знаходяться в тепловому хаотичному русі, а їх середня кінетична енергія визначає температуру тіла,
між частинками речовини діють сили взаємодії, які, в залежності від відстані між частинками, будуть силами тяжіння або силами відштовхування.
6.2. Імовірність та флуктуації
Наведемо деякі визначення поняття ймовірності.
1. Імовірність wі деякого і-го стану системи визначається границею відношення часу tі, на протязі якого система знаходиться в даному стані, до повного часу Т спостереження за системою при необмеженому збільшенні Т
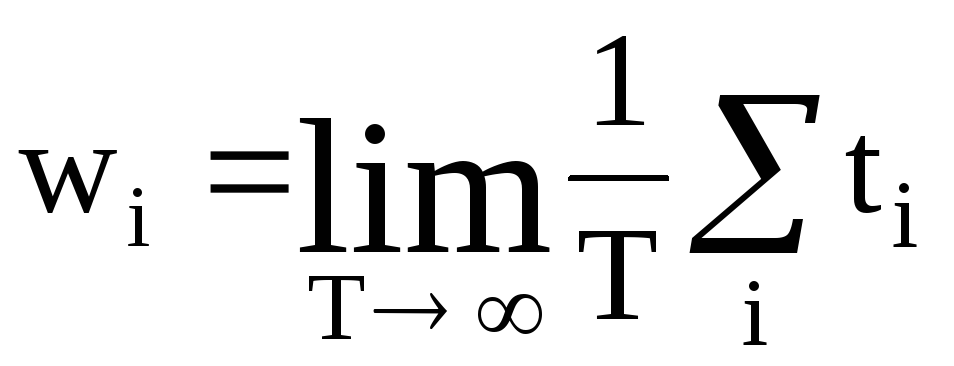 .
(1)
.
(1)
2. Якщо фізична величина А при N вимірюваннях мала Ni число значень Аі, то ймовірність wi того, що величина А має значення Аі дорівнює границі відношення Ni/N при необмеженому зростанні N і вона співпадає з імовірністю wі і - го стану системи
![]() .
(2)
.
(2)
3. Імовірність dw(A) того, що фізична величина має значення в інтервалі (A; A + dA) пропорційна dA
dw(A) = f(A)dA, (3)
де f(A) - називається густиною ймовірності або функцією розподілу ймовірності.
Умова нормування ймовірності для дискретних станів
![]() (4)
(4)
сума ймовірності по всім можливим станам є ймовірність достовірної величини і вона дорівнює 1, а для неперервної зміни стану сума замінюється інтегралом
![]() (5)
(5)
сума ймовірностей для всіх елементарних значень параметра стану А є ймовірність достовірної величини і дорівнює 1.
Середнє статистичне значення
величини А позначається
![]() і визначається для дискретних станів
так
і визначається для дискретних станів
так
![]() ,
(6)
,
(6)
а для неперервної зміни величини А як
![]() ,
,
де сума й інтеграл беруться по всім можливим станам системи.
Флуктуації
це випадкові відхилення
термодинамічних параметрів від
рівноважних значень. Якщо термодинамічна
система складається з невеликого числа
частинок, то розподіл частинок, випадково
відхиляючись від рівноважного, може
суттєво змінювати величини термодинамічних
параметрів. Для кількісної оцінки
флуктуації деякої величини А використовують
квадратичну флуктуацію, яку ще називають
дисперсією ![]() .
Дисперсія є середнє значення квадрата
відхилення А від її середнього значення:
.
Дисперсія є середнє значення квадрата
відхилення А від її середнього значення:
![]() .
.
Величина
![]() називається абсолютною флуктуацією,
а
називається абсолютною флуктуацією,
а
![]()
відносною.
відносною.
Природа флуктуацій термодинамічних величин визначається хаотичним тепловим рухом структурних частинок середовища. Чим більше число N цих частинок, тим менший вплив їх флуктуацій на значення термодинамічних величин. Доведено, що для хімічно однорідного ідеального газу, при сталому об'ємі, флуктуації густини , тиску Р та температури Т обернено пропорційні кореню з числа частинок газу
![]() .
.
Звідси видно, що для середовища з великим числом частинок флуктуаціями термодинамічних величин можна нехтувати.
