
- •8.Реальні середовища
- •8.1. Реальні гази
- •8.2. Рівняння Ван - дер – Ваальса
- •8.3. Рідини
- •8.3.1. Енергія та сила поверхневого натягу
- •8.3. 2. Змочування
- •8.3.2. Тиск під скривленою поверхнею
- •8.4. Капілярні явища
- •8.5. Теплові процеси в рідині
- •8.6. Стаціонарна течія рідини та газу в циліндрі
- •8.6.1.Радіальний розподіл швидкості течії у циліндричному потоці
- •8.6.2. Формула Пуазейля.
- •8.6.3. Формула Стокса.
- •8.7. Тверде тіло
- •8.7.1.Анізотропія кристалів
- •Фізичні типи кристалів
- •8.9. Теплове розширення та теплоємність кристалів
- •8.10. Фазові перетворення
- •8.11. Контрольні питання
8.Реальні середовища
8.1. Реальні гази
Між молекулами будь-якого
газу в реальному середовищі існують
сили міжмолекулярного тяжіння й
відштовхування. Вони
мають електромагнітну та квантову
природу. Сили тяжіння виникають на
відстанях
![]() ,
а їх величина
,
а їх величина![]() .
Сили відштовхування
.
Сили відштовхування
![]() ,
де n9.
Гази, в яких враховуються
сили міжмолекулярної взаємодії та їх
власний об'єм,
називаються реальними.
,
де n9.
Гази, в яких враховуються
сили міжмолекулярної взаємодії та їх
власний об'єм,
називаються реальними.
Реальний газ має ізотерми
представлені на діаграмі Мал.13, які
суттєво відрізняються від ізотерм
ідеального газу. По-перше, на відміну
від ідеального, реальний газ простим
зменшенням об'єму переходить у рідину,
тобто один агрегатний стан переходить
в інший. По-друге, реальні ізотерми мають
розриви, які виглядають на діаграмах у
вигляді поличок сталого тиску і, при
збільшенні температури, їх величина
зменшується, а при деякій температурі
![]() ,
яка називаєтьсякритичною,
поличка переходить у точку K.
На М
,
яка називаєтьсякритичною,
поличка переходить у точку K.
На М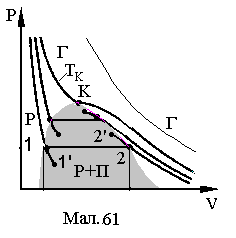 ал.61
огинаюча кінців поличок має вигляд
купола. Під куполом речовинаіснує
у вигляді рідини і насиченого пару над
нею. Під ізотермою
ал.61
огинаюча кінців поличок має вигляд
купола. Під куполом речовинаіснує
у вигляді рідини і насиченого пару над
нею. Під ізотермою
![]() ,
ліворуч купола, речовина існує у виглядірідини,
а праворуч, у вигляді пару.
Над ізотермою
,
ліворуч купола, речовина існує у виглядірідини,
а праворуч, у вигляді пару.
Над ізотермою
![]() речовина існує угазоподібному
стані, а його ізотерми
співпадають з ізотермами ідеального
газу. Під паром
розуміють газ, який має температуру
менше критичної й простим зменшенням
об'єму може повністю конденсуватися у
рідину. Насичений пар
це пар, який знаходиться у динамічній
рівновазі з рідиною, тобто з рідини
випаровується стільки частинок скільки
їх конденсується в рідину. Як видно з
діаграми, на відміну від простого пару,
насичений пар може неперервно переходити
в рідину при зменшенні об'єму,
залишаючись при
сталому тискові.
речовина існує угазоподібному
стані, а його ізотерми
співпадають з ізотермами ідеального
газу. Під паром
розуміють газ, який має температуру
менше критичної й простим зменшенням
об'єму може повністю конденсуватися у
рідину. Насичений пар
це пар, який знаходиться у динамічній
рівновазі з рідиною, тобто з рідини
випаровується стільки частинок скільки
їх конденсується в рідину. Як видно з
діаграми, на відміну від простого пару,
насичений пар може неперервно переходити
в рідину при зменшенні об'єму,
залишаючись при
сталому тискові.
Загалом, при підвищенні температури газу до критичної, зникають відмінності між рідиною та газом, стають рівними нулю питома теплота пароутворення і коефіцієнт поверхневого натягу . Коло критичної температури спостерігається критична опалесценція сильне розсіювання світла речовиною внаслідок великої оптичної неоднорідності, викликаної значними флуктуаціями концентрації частинок та збільшенням стислості речовини.
При високій чистоті речовини спостерігаються стани 11' та 22'. Крива 11' відповідає перегрітій рідині, яка при відсутності центрів випаровування не може закипіти, а крива 22' відповідає переохолодженому парові, який, за відсутністю центрів конденсації, не може переходити в рідину. Центри випаровування та конденсації можуть створюватися шляхом іонізації частинок речовини елементарними частинками і тому рідина та газ у станах 11' та 22' успішно застосовується в приладах, які реєструють елементарні частинки.
8.2. Рівняння Ван - дер – Ваальса
Створено декілька моделей реального газу, які представлені рівняннями, наприклад, Ван - дер - Ваальса, Бертло, Майєра, Вукаловича й Новікова і т. п. Нижче ми зупинимося на моделі Ван-дер-Ваальса.
Рівняння Ван - дер - Ваальса одержано введенням у рівняння Капейрона-Менделеєва поправок на додатковий внутрішній тиск, викликаний взаємодією частинок, та на власний об'єм частинок. Для моля реального газу рівняння Ван-дер-Ваальса має вигляд
![]() ,
(1)
,
(1)
де
![]() об'єм моля газу,
об'єм моля газу,![]() додатковий внутрішній
тиск, b
поправка на власний об'єм
частинок, яка враховує дію сил
відштовхування. Ізотерми Ван-дер-Ваальса
представлені на Мал.62.
додатковий внутрішній
тиск, b
поправка на власний об'єм
частинок, яка враховує дію сил
відштовхування. Ізотерми Ван-дер-Ваальса
представлені на Мал.62.
Рівняння Ван - дер - Ваальса
(1) при сталому тискові є рівнянням
третього ступеня відносно об'єму V
і має три дійсних корені
![]() ,
які, при збільшенні температури
зближуються і, при критичній температурі,
становляться рівними. Огинаюча крайніх
коренів ізотерм Ван-дер-Ваальса утворює
купол подібний куполові реальних
ізотерм. Ділянка ізотерми 11'
відповідає перегрітій рідині, а 22'
п
,
які, при збільшенні температури
зближуються і, при критичній температурі,
становляться рівними. Огинаюча крайніх
коренів ізотерм Ван-дер-Ваальса утворює
купол подібний куполові реальних
ізотерм. Ділянка ізотерми 11'
відповідає перегрітій рідині, а 22'
п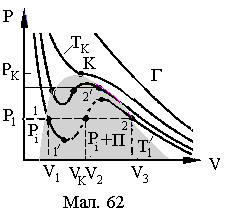 ереохолодженому
парові. Відрізки, що з'єднують стани 1
та 2 відповідають поличкам реальних
ізотерм. Таким чином проста модель
реального газу Ван-дер-Ваальса є достатньо
наближеною до експериментальних кривих,
окрім ділянки ізотерм 1'2',
які у реальних ізотермах відсутні.
ереохолодженому
парові. Відрізки, що з'єднують стани 1
та 2 відповідають поличкам реальних
ізотерм. Таким чином проста модель
реального газу Ван-дер-Ваальса є достатньо
наближеною до експериментальних кривих,
окрім ділянки ізотерм 1'2',
які у реальних ізотермах відсутні.
Величини а і b рівняння Ван-дер-Ваальса зв'язані з параметрами критичного стану моля газу pk, Vk, Tk. Відповідні співвідношення випливають із того, що в критичній точці (рk ,Vk) рівняння Ван - дер - Ваальса
![]() (2)
(2)
має три рівних корені відносно Vk і це рівняння може бути представлено у вигляді
![]() .
(3)
.
(3)
Запишемо (2-3) як два многочлени відносно V.
![]() ,
(4)
,
(4)
![]() .
(5)
.
(5)
Прирівнюючи в (4-5) коефіцієнти при відповідних степенях V, одержимо три рівняння для визначення критичних параметрів газу через сталі Ван - дер - Ваальса
![]() .
(6)
.
(6)
В результаті розв'язку (6) маємо
![]() ,
,![]() ,
(7)
,
(7)
![]() ,
,
![]() ,
,![]() .
(8)
.
(8)
Крім того, сталу b у (7) можна записати через ефективний діаметр d, що визначає власний об'єм V моля частинок, а саме
![]() ,
(9)
,
(9)
де
![]() число Авогадро.
число Авогадро.
Існування додаткового тиску
![]() створює додаткову потенціальну енергію
створює додаткову потенціальну енергію![]() рівну роботі по збільшенню об'єму газу
до такої величини, коли зникнуть сили
міжмолекулярної взаємодії. Розширюючись,
газ виконує елементарну роботу
рівну роботі по збільшенню об'єму газу
до такої величини, коли зникнуть сили
міжмолекулярної взаємодії. Розширюючись,
газ виконує елементарну роботу
![]() .
(10)
.
(10)
Після інтегрування (10) одержимо
![]() .
(11)
.
(11)
В (11) ми врахували, що стала інтегрування дорівнює 0. Таким чином з урахуванням (11) внутрішня енергія моля реального газу становить
U=![]() iRT-
iRT-
![]() .
(12)
.
(12)
Таблиця. Сталі Ван дер Ваальса та критичні значення PK,VK,K
|
|Речовина
|
а, Дж м3/моль2 |
b105, м3/моль |
TK, K |
Pк, МП а |
K, кг/м3 |
|
Азот |
0,136 |
3,8 |
126 |
3.4 |
311 |
|
Аргон |
0,132 |
3.2 |
151 |
4.87 |
531 |
|
Вода |
0,554 |
3 |
647 |
22 |
307 |
|
Водень |
0,024 |
2.7 |
33 |
1.3 |
31 |
|
Вуглекислий газ |
0,364 |
4.3 |
304 |
7.38 |
468 |
|
Кисень |
0,137 |
3.2 |
154 |
5.07 |
430 |
|
Гелій |
0,003 |
2.2 |
5.2 |
0.23 |
69 |
