
- •8.Реальні середовища
- •8.1. Реальні гази
- •8.2. Рівняння Ван - дер – Ваальса
- •8.3. Рідини
- •8.3.1. Енергія та сила поверхневого натягу
- •8.3. 2. Змочування
- •8.3.2. Тиск під скривленою поверхнею
- •8.4. Капілярні явища
- •8.5. Теплові процеси в рідині
- •8.6. Стаціонарна течія рідини та газу в циліндрі
- •8.6.1.Радіальний розподіл швидкості течії у циліндричному потоці
- •8.6.2. Формула Пуазейля.
- •8.6.3. Формула Стокса.
- •8.7. Тверде тіло
- •8.7.1.Анізотропія кристалів
- •Фізичні типи кристалів
- •8.9. Теплове розширення та теплоємність кристалів
- •8.10. Фазові перетворення
- •8.11. Контрольні питання
8.7.1.Анізотропія кристалів
Як
указувалося вище, основною відмінністю
від ізотропних тіл, є те, що кристали
мають анізотропні властивості. Вони
полягають у тому, що фізичні властивості
кристалів залежать від напрямку.
Наприклад, у ізотропному діелектрикові
вектор електричної індукції (зміщення)
![]() зв'язаний з вектором напруженості
електричного поля
зв'язаний з вектором напруженості
електричного поля
![]() лінійним рівнянням
лінійним рівнянням![]() .
Це означає, що
.
Це означає, що![]() .
У кристалі цей зв'язок
набуває іншого характеру
.
У кристалі цей зв'язок
набуває іншого характеру
 (1)
(1)
У цьому
випадкові кажуть що між
![]() та
та
![]() існує тензорна залежність через тензор
діелектричної проникливісті
існує тензорна залежність через тензор
діелектричної проникливісті
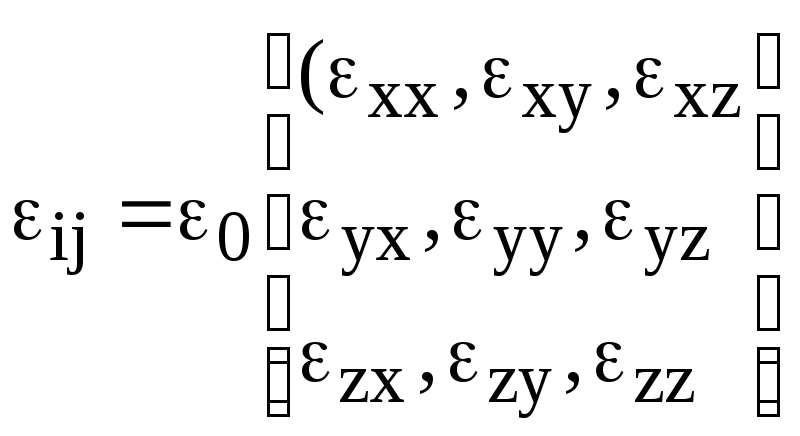 .
(2)
.
(2)
Фізичний зміст (1) полягає у тому, що кожна з компонент індукції лінійно залежить від усіх компонент електричного поля.
Фізичні типи кристалів
В залежності від природи частинок у вузлах кристалічної решітки й характеру взаємодії між частинками розрізнюють чотири типи кристалів: іонні, атомні, металічні й молекулярні.
1. Іонні кристали (NaCl, KCl та інші). У вузлах решітки розміщені іони різних знаків заряду. Сили взаємодії електростатичні (кулонівські) сили тяжіння між різнойменно зарядженими іонами. Такий зв'язок називається гетерополярним. Примітивна решітка іонного кристала кухонної солі представлена на Мал.68 а.
2.Атомні кристали
(алмаз, графіт, ZnS і т. п. ). У вузлах решітки
розміщені нейтральні атоми. Зв'язок
між атомами має квантову природу і
називається г омеополярним
(або ковалентним). Зв'язок здійснюється парами
валентних електронів взаємодіючих
атомів, що визначає направленість їх
взаємодії. Примітивна решітка ковалентного
кристала алмаза представлена на Мал.68
б.
омеополярним
(або ковалентним). Зв'язок здійснюється парами
валентних електронів взаємодіючих
атомів, що визначає направленість їх
взаємодії. Примітивна решітка ковалентного
кристала алмаза представлена на Мал.68
б.
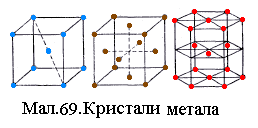 3.
Металічні кристали.
У вузлах решітки розміщені додатні
іони металів, між якими хаотично рухаються
вільні валентні електрони, що відокремились
від атомів при утворенні іонів. Ці
електрони утримують додатні іони у
вузлах. Сили зв'язку
визначаються взаємодією
іонів із газом вільних електронів
та квантовими обмінними
силами перекриття внутрішніх електронних
атомних орбіталей. Більшість металів
має примітивні решітки одного з трьох
типів, представлених на Мал.69:
об'ємноцентровану, гранецентровану та
повну гексагональну.
3.
Металічні кристали.
У вузлах решітки розміщені додатні
іони металів, між якими хаотично рухаються
вільні валентні електрони, що відокремились
від атомів при утворенні іонів. Ці
електрони утримують додатні іони у
вузлах. Сили зв'язку
визначаються взаємодією
іонів із газом вільних електронів
та квантовими обмінними
силами перекриття внутрішніх електронних
атомних орбіталей. Більшість металів
має примітивні решітки одного з трьох
типів, представлених на Мал.69:
об'ємноцентровану, гранецентровану та
повну гексагональну.
4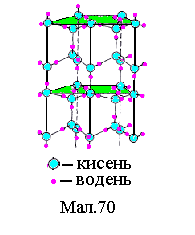 .Молекулярні
кристали (H2,
N2,
O2,
CO2,
H2O
і т. п. ). У вузлах решітки розміщені
певним чином орієнтовані
молекули. Сили
зв'язку між молекулами
в кристалі називаються
ван-дер-ваальсовими
і вони мають ту ж природу, що і сили
тяжіння між молекулами реального газу.
Примітивна решітка молекулярного
кристала льоду представлена на Мал.70.
.Молекулярні
кристали (H2,
N2,
O2,
CO2,
H2O
і т. п. ). У вузлах решітки розміщені
певним чином орієнтовані
молекули. Сили
зв'язку між молекулами
в кристалі називаються
ван-дер-ваальсовими
і вони мають ту ж природу, що і сили
тяжіння між молекулами реального газу.
Примітивна решітка молекулярного
кристала льоду представлена на Мал.70.
8.9. Теплове розширення та теплоємність кристалів
Тверді тіла при нагріванні розширюються, а їхні лінійні розміри L змінюються за законом
![]() ,
,
де
![]() температурний коефіцієнт лінійного
розширення,
температурний коефіцієнт лінійного
розширення,![]()
початкова довжина при
початкова довжина при
![]() ,
,![]() приріст
температури. Відповідно змінюється й
об'єм твердого тіла
приріст
температури. Відповідно змінюється й
об'єм твердого тіла
![]() ,
,
де
![]() температурний коефіцієнт об'ємного
розширення, V0
об'єм при
температурний коефіцієнт об'ємного
розширення, V0
об'єм при
![]() .
.
Тверде хімічно просте кристалічне тіло з класичної точки зору являє собою одну молекулу з N атомами, яка має 3N - 6 3N коливальних ступенів свободи. На них приходиться теплова енергія коливального руху U = 3NkT. У зв'язку з малістю коефіцієнта теплового розширення можна вважати, що теплоємності при сталому об'ємі і сталому тискові рівні між собою і тоді для високих температур (для більшості твердих тіл кімнатна температура є вже досить високою)
![]() .
.
Для моля речовини кристала
![]() і
і
![]() .
.
Такий результат збігається
з експериментально встановленим правилом
Дюлонга - Пті для високих
температур кристала. Теплоємність
твердих тіл, які не
є хімічно простими, дорівнює сумі атомних
теплоємностей елементів, що складають
речовину. Наприклад,
молярна теплоємність кухонної солі
дорівнює
![]() .
Нижче в таблиці
наведені експериментальні значення
молярних теплоємностей деяких твердих
тіл.
.
Нижче в таблиці
наведені експериментальні значення
молярних теплоємностей деяких твердих
тіл.
Таблиця. Теплоємність деяких твердих тіл
|
Речовина
|
С, Дж/(моль-К)
| |
|
теорія
|
дослід
| |
|
Алюміній А1
|
25
|
25,5
|
|
Алмаз С
|
25
|
5,9
|
|
Берилій Be
|
25
|
15,6
|
|
Бор В
|
25
|
13,5
|
|
Залізо Fe
|
25
|
26,8
|
|
Срібло Ag
|
25
|
25,6
|
|
NaCI
|
50
|
50,6
|
|
AgCl
|
50
|
50,9
|
|
СаСl2
|
75
|
76,2
|
Як показують наведені в таблиці дослідні дані, для багатьох речовин закон Дюлонга й Пті виконується задовільно, хоча теплоємності С, Be, В мають значні відхилення.
Досліди по вимірюванню
теплоємностей твердих тіл при низьких
температурах показали, що вони залежать
від температури пропорційно
![]() .
Для хімічно простих речовин хорошу
модель розрахунку теплоємності створив
на основі квантової теорії П. Дебай.
Температурна залежність теплоємності
за Дебаєм представлена на Мал.25. У цій
моделі т
.
Для хімічно простих речовин хорошу
модель розрахунку теплоємності створив
на основі квантової теорії П. Дебай.
Температурна залежність теплоємності
за Дебаєм представлена на Мал.25. У цій
моделі т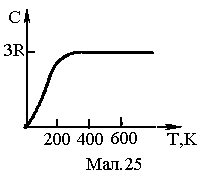 еплоємність
при низьких температурах кристалів
визначається законом Дебая
еплоємність
при низьких температурах кристалів
визначається законом Дебая
![]() ,
,
де
![]()
характеристична температура Дебая.
Дослідні та експериментальні значення
теплоємностей для хімічно простих
речовин практично мають незначні
розбіжності. При температурах більших
за характеристичну температуру Дебая
теплоємність кристалів розглядається
на основі класичної теорії, а при нижчих
на основі квантової теорії.
характеристична температура Дебая.
Дослідні та експериментальні значення
теплоємностей для хімічно простих
речовин практично мають незначні
розбіжності. При температурах більших
за характеристичну температуру Дебая
теплоємність кристалів розглядається
на основі класичної теорії, а при нижчих
на основі квантової теорії.
