
FIZIKA_kospekt_lektsy
.pdfРешение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней. Возможные значения Е1, Е2,,
Е3 — показаны на рис. в виде горизонтальных прямых. Самый нижний уровень
Е1, отвечающий минимальной возможной энергии, основной, все остальные
(Еn>Е1, п=2, 3, ...) — возбужденные. При Е<0 движение электрона является связанным — он находится внутри гиперболической «потенциальной ямы». Из рисунка следует, что по мере роста главного квантового числа п энергетические уровни располагаются теснее и при п=∞ Е∞=0. При Е>0 движение электрона является свободным; область непрерывного спектра Е>0 (заштрихована на рис.34.1) соответствует ионизованному атому. Энергия ионизации атома водорода равна
Еi |
= -Е1 |
= |
mee4 |
=13,55 эВ. |
(34.14) |
|
8h2 02 |
||||||
|
|
|
|
|
Выражение совпадает с формулой, полученной Бором для энергии атома водорода. Однако если Бору пришлось вводить дополнительные гипотезы
(постулаты), то в квантовой механике дискретные значения энергии, являясь следствием самой теории, вытекают непосредственно из решения уравнения Шредингера.
Решение уравнения Шредингера, т.е. математическое описание орбитали,
возможно лишь при определенных, дискретных значениях характеристик,
получивших название квантовых чисел.
Главное квантовое число n определяет основной запас энергии электрона,
т.е. степень его удаления от ядра, или размер электронного облака (орбитали).
Оно может принимать целочисленные значения от 1 до ∞.
Состояние электрона, характеризующееся определенным значением n,
называется энергетическим уровнем электрона в атоме. Электроны, имеющие одинаковые значения n, образуют электронные слои (электронные оболочки),
обозначаемые цифрами 1,2,3,4,5… или соответственно буквами: K, L, M, N, O…
351

Наименьшее значение энергии Е соответствует n=1. Остальным квантовым состояниям отвечают более высокие значения энергий, и электроны,
находящиеся на этих энергетических уровнях, менее прочно связаны с ядром.
Орбитальное (побочное или азимутальное) квантовое число l определяет
орбитальный момент количества движения электрона |
l = |
h |
|
|
и |
|
|
l(l 1) |
|||||
|
||||||
|
|
2 |
||||
характеризует форму электронного облака (рис.34.2). Оно принимает все целочисленные значения от 0 до (n-1). Каждому n соответствует определенное число значений орбитального квантового числа, т.е. энергетический уровень представляет собой совокупность энергетических подуровней, несколько различающихся по энергиям. Число подуровней, на которые расщепляется уровень, равно номеру уровня (т.е. численному значению n). Эти подуровни имеют следующие буквенные обозначения:
Орбитальное квантовое число: |
0 |
1 |
2 |
3 |
4 |
Подуровень |
s |
p |
d |
f |
g |
Формы орбиталей, соответствующие различным значениям l
Рис.34.2
Таким образом, энергетический подуровеньэто состояние электрона в атоме,
характеризующееся определенным набором квантовых чисел n, l. Такое состояние электрона, соответствующее определенным значениям n и l (т.е. тип орбитали), записывается в виде сочетания цифрового обозначения n и
буквенного l, например:4р (n=4; l=1); 5d (n =5; l =2).
352
Магнитное квантовое число ml определяет значение орбитального момента количества движения электрона L на произвольно выделенную ось z:
Lz |
= |
h |
ml, т.е. характеризует пространственную ориентацию электронного |
|
|||
|
|
2 |
|
облака. Оно принимает все целочисленные значения от – l до + l, например, при l=0 ml =0, при l=1 ml =-1,0,+1; при l=2 ml =-2,-1,0,+1,+2
В общем виде любому значению при l соответствует (2l+1) значений магнитного квантового числа, т.е. (2l+1) возможных расположений электронного облака данного типа в пространстве. Следовательно, можно говорить, что число значений n указывает на число орбиталей с данным значением l. s –состоянию соответствует одна орбиталь, p- состоянию –три, d—
состоянию – пять, f –состоянию семь. Все орбитали, соответствующие какому-
либо состоянию, имеют одинаковую энергию и называются вырожденными.
Общее число орбиталей, из которых состоит любой энергетический уровень, равно n2, а число орбиталей, составляющих подуровень - (2l+1).
Состояние электрона в атоме, характеризующееся определенными значениями квантовых чисел n, l, ml,, т.е. определенными размерами, формой и ориентацией в пространстве электронного облака, называется атомной электронной оболочкой.
Спиновое квантовое число S характеризует собственный механический момент электрона, связанный с вращением его вокруг своей оси. Оно может иметь только два значения +1/2 или –1/2.
Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули: в атоме не может быть двух электронов, у
которых все четыре квантовых числа были бы одинаковы.
Следовательно, на одной орбитали могут находится не более двух электронов, отличающихся друг от друга значениями спинового квантового числа; максимальная емкость энергетического подуровня 2(2l+1) электронов, а уровня 2n2.
353

34.5. Спин электрона
Штерн и Герлах обнаружили, что узкий пучок атомов водорода, заведомо
находящихся в s-состоянии, в неоднородном магнитном поле расщепляется на два пучка. В этом состоянии момент импульса электрона равен нулю.
Магнитный момент атома, связанный с орбитальным движением электрона,
пропорционален механическому моменту, поэтому он равен нулю и магнитное поле не должно оказывать влияния на движение атомов водорода в основном состоянии, т. е. расщепления быть не должно. Однако в дальнейшем при применении спектральных приборов с большой разрешающей способностью было доказано, что спектральные линии атома водорода обнаруживают тонкую структуру (являются дублетами) даже в отсутствие магнитного поля.
Для объяснения тонкой структуры спектральных линий, а также ряда других трудностей в атомной физике Д. Уленбек и С. Гаудомит предположили,
что электрон обладает собственным неуничтожимым механическим моментом
импульса, не связанным с движением электрона в пространстве, — спином.
Спин электрона (и всех других микрочастиц) — квантовая величина, у
нее нет классического аналога; это внутреннее неотъемлемое свойство
электрона, подобное его заряду и массе.
Если электрону приписывается собственный механический момент импульса (спин) Ls то ему соответствует собственный магнитный момент рms.
Согласно общим выводам квантовой механики, спин квантуется по закону
Ls =ћ s(s 1) , |
(34.15) |
|
где s— спиновое квантовое число. |
|
|
По аналогии с орбитальным |
моментом импульса, проекция |
Lsz спина |
квантуется так, что вектор Ls, может принимать 2s +1 ориентации. Так как в опытах Штерна и Герлаха наблюдались только две ориентации, то 2 s +1=2,
откуда s = 1/2. Проекция спина на направление внешнего магнитного поля,
являясь квантованной величиной, определяется выражением
Lsz= ћms |
(34.16) |
354
где ms — магнитное спиновое квантовое число; оно может иметь только два значения: ms =±1/2.
Таким образом, опытные данные привели к необходимости характеризовать электроны (и микрочастицы вообще) добавочной внутренней степенью свободы. Поэтому для полного описания состояния электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
34.6. Спектры. Спектральный анализ
Спектры излучения. Спектральный состав излучения у различных ве-
ществ имеет весьма разнообразный характер. Однако все спектры делятся на три типа: а) сплошной спектр; б) линейчатый спектр; в) полосатый спектр.
а) Сплошной (непрерывный) спектр. Накаленные твердые и жидкие тела и газы (при большом давлении) испускают свет, разложение которого дает сплошной спектр, в котором спектральные цвета непрерывно переходят один в другой. Характер непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и вза-
имодействием атомов друг с другом. Сплошные спектры одинаковы для разных веществ, и поэтому их нельзя использовать для определения состава вещества.
б) Линейчатый (атомный) спектр. Возбужденные атомы разреженных газов или паров испускают свет, разложение которого дает линейчатый спектр, состоящий из отдельных цветных линий. Каждый химический элемент имеет характерный для него линейчатый спектр. Атомы таких веществ не взаимодействуют друг с другом и излучают свет только определенных длин волн. Изолированные атомы данного химического элемента излучают строго определенные длины волн. Это позволяет по спектральным линиям судить о химическом составе источника света.
в) Молекулярный (полосатый) спектр. Спектр молекулы состоит из большого числа отдельных линий, сливающихся в полосы, четкие с одного края и размытые с другого. В отличие от линейчатых спектров полосатые спектры создаются не атомами, а молекулами, не связанными или слабо
355
связанными друг с другом. Серии очень близких линий группируются на отдельных участках спектра и заполняют целые полосы. В 1860 г. немецкие ученые Г. Кирхгоф и Р. Бунзен, изучая спектры металлов, установили следующие факты:
1)каждый металл имеет свой спектр;
2)спектр каждого металла строго постоянен;
3)введение в пламя горелки любой соли одного и того же металла всегда приводит к появлению одинакового спектра;
4)при внесении в пламя смеси солей нескольких металлов в спектре одновременно появляются все их линии;
5) яркость спектральных линий зависит от концентрации элемента в данном веществе.
Спектры поглощения. Если белый свет от источника, дающей сплошной спектр, пропускается через пары исследуемого вещества и затем разлагается в спектр, то на фоне сплошного спектра наблюдаются темные линии поглощения в тех же самых местах, где находились бы линии спектра испускания паров исследуемого элемента. Такие спектры получили название атомных спектров поглощения.
Все вещества, атомы которых находятся в возбужденном состоянии,
излучают световые волны, энергия которых определенным образом распределена по длинам волн. Поглощение света веществом также зависит от длины волны. Атомы поглощают излучение лишь тех длин волн, которые они могут испускать при данной температуре.
Спектральный анализ. Явление дисперсии используется в науки и технике в виде метода определения состава вещества, получившего название спектрального анализа. В основе этого метода лежит изучение света,
излучаемого или поглощаемого веществом. Спектральным анализом
называется метод изучения химического состава вещества, основанный на исследовании его спектров.
Спектральные аппараты. Для получения и исследования спектров используют спектральные аппараты. Наиболее простые спектральные
356
приборы — призма и дифракционная решетка. Более точные — спектроскоп и спектрограф.
Спектроскопом называется прибор, с помощью которого визуально исследуется спектральный состав света, испускаемого некоторым источником. Если регистрация спектра происходит на фотопластинке, то прибор называется спектрографом.
Применение спектрального анализа. Линейчатые спектры играют особо важную роль, потому что их структура прямо связана со строением атома.
Ведь эти спектры создаются атомами, не испытывающими внешних воздействий. Состав сложных, главным образом органических смесей анализируется по их молекулярным спектрам.
С помощью спектрального анализа можно обнаружить данный элемент в составе сложного вещества, если даже его масса не превышает
10-10 г. Линии, присущие данному элементу, позволяют качественно судить о его наличии. Яркость линий дает возможность (при соблюдении стандартных условий возбуждения) количественно судить о наличии того или иного элемента.
Спектральный анализ можно проводить и по спектрам поглощения. В
астрофизике по спектрам можно определить многие физические ха-
рактеристики объектов: температуру, давление, скорость движения, маг-
нитную индукцию и др. с помощью спектрального анализа определяют химический состав руд и минералов.
Основные направления применения спектрального анализа таковы:
физико-химические исследования; машиностроение, металлургия; атомная индустрия; астрономия, астрофизика; криминалистика.
Современные технологии создания новейших строительных материалов
(металлопластиковые, пластиковые) непосредственно взаимосвязаны с такими фундаментальными науками как химия, физика. Данные науки используют современные методы исследования веществ. Поэтому спектральный анализ можно применять для определения химического состав состава строительных материалов по их спектрам.
357

ГЛАВА 35. ЭЛЕМЕНТЫ ЗОННОЙ ТЕОРИИ ТВЕРДЫХ ТЕЛ
35.1. Кристаллы. Связи между атомами и молекулами в твердых
телах
Каждая частица в кристаллической решетке (ион, атом или молекула)
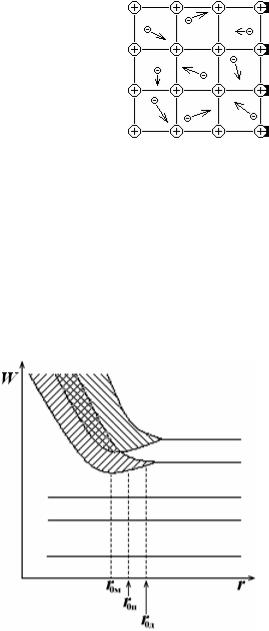
испытывает силы межмолекулярного взаимодействия. Равновесное расположение всех частиц твердого тела в узлах кристаллической решетки соответствует минимуму свободной энергии кристалла и наиболее устойчивому его состоянию. При этом частицы в узлах решетки располагаются на некоторых равновесных расстояниях r0 друг от друга, называемых периодом кристаллической решетки.
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают следующие четыре типа решеток:
ионную, атомную, молекулярную и металлическую.
В узлах ионной решетки чередуются отрицательные и положительные ионы. Благодаря электрическим взаимодействиям они образуют устойчивую структуру кристалла. Подавляющее большинство кристаллов имеют именно ионную решетку. Типичным примером ионной
решетки является изображенная на рис. 35.1 решетка каменной соли NaCl. В
ней чередуются ионы Na и Cl- . В газообразном состоянии хлористый натрий состоит из молекул, в которых объединены попарно ионы натрия с ионами хлора. В кристалле молекулы утрачивают обособленное существование. Ионный кристалл состоит не из молекул, а из ионов. Весь кристалл в целом можно рассматривать как одну гигантскую молекулу.
В узлах молекулярной решетки (см. рис. 35.2) размещаются полярные молекулы. Разноименно заряженные частицы двух соседних молекул притягиваются и связывают молекулы в кристаллическую решетку. Таким образом, между молекулами кристалла действуют те же силы, что и между молекулами реального газа. Эти силы называют еще силами Ван-дер-Ваальса.
358

По сравнению с ионными, молекулярные решетки не такие прочные, они легко деформируются. Такие решетки имеют вода (лед), углекислота (сухой лед),
азот, кислород, водород, а также резина, парафин, целлюлоза и многие другие кристаллы.
Ватомных решетках нейтральные атомы соседних узлов связаны между собой валентными электронами. Орбиты электронов смещаются так, что электрон движется по орбите, охватывающей два соседних атома, и таким образом, связывает их между собой. Так осуществляется связь атомов в молекулах с ковалентной связью.
Вкачестве примера рассмотрим атомные решетки
алмаза и графита. Эти кристаллы идентичны по своей химической природе – они построены из атомов углерода, но отличаются строением решетки. В
кристалле алмаза (см. рис. 35.3) соседние атомы углерода размещены на одинаковом расстоянии 154 пм друг от друга. Они одинаково и очень тесно связаны во всех направлениях, что является причиной
чрезвычайной прочности и твердости алмаза. Каждый четырехвалентный атом углерода размещается в центре правильной четырехгранной пирамиды – тетраэдра, в вершинах которой находятся четыре его ближайших соседа, с
которыми он связан валентной связью. Такую же решетку, как у алмаза, имеют типичные полупроводники – германий Ge и кремний Si.
Кристаллическая решетка графита (см. рис. 35.4)
имеет совершенно другое строение. Она состоит из ряда параллельных слоев атомов. Каждый слой заполнен тесно связанными между собой атомами углерода,
размещенными в вершинах правильного шестиугольника на расстоянии 142 пм друг от друга. Между соседними атомами, лежащими в одном слое, осуществляется прочная валентная связь Атомы соседних слоев слабо
связаны друг с другом, так как расстояние между соседними слоями более чем вдвое превышает расстояние между атомами шестиугольника и равняется
359
340 пм. В этом направлении связь осуществляется слабыми силами Ван-дер-
Ваальса. Поэтому кристалл графита легко скалывается вдоль этих слоев
(плоскостей спайности), он мягок и легко крошится. Это позволяет изготовлять из графита грифели карандашей, щетки электродвигателей, сухие смазки,
используемые, например, для уменьшения трения между листами рессоры автомобиля. Поскольку лишь три валентных электрона атома углерода из четырех принимают участие в образовании валентных связей с соседними атомами, четвертый электрон оказывается слабо связанным с атомом. Именно такие электроны обеспечивают электропроводность графита, тогда как алмаз не является проводником электрического тока.
Вузлах металлической решетки (см. рис. 35.5)
размещены положительные ионы металла. В пространстве между узлами решетки двигаются свободные (точнее – коллективизированные) электроны. Эти электроны не принадлежат отдельным атомам, а движутся по сложным орбитам, охватывающим весь металл. Таким образом,
междоузельное пространство заполнено своеобразным “электронным газом”,
который стягивает, “склеивает” положительные ионы в плотную кристаллическую решетку. Наличием свободных электронов объясняется хорошая электропроводность металлов.
35.2. Зоны энергетических уровней электронов в кристалле
При объединении атомов в кристалл |
|
|||
орбитали |
электронов |
внешних |
электронных |
|
оболочек |
(валентных |
электронов) |
|
|
перекрываются и |
образуют |
электронное |
|
|
облако, охватывающее (пронизывающее, |
|
|||
омывающее) всю кристаллическую решетку. |
|
|||
Каждый валентный |
электрон |
принадлежит |
|
|
уже не отдельному атому, а всему кристаллу в |
|
|||
целом. Поэтому кристалл и его валентные |
|
|||
электроны |
образуют единую |
квантовую |
Рис. 35.6 |
|
360
