
Общая химия (часть 2, 2012 г
.).pdf
Но в атомах известных к настоящему времени элементов эти подуровни электронами не заполняются.
Каждый подуровень в пределах данного энергетического уровня характеризуется определенным значением орбитального квантового числа l, которое может принимать только целочисленные значения в интервале от 0 до n-1.
Для s-подуровня, расположенного на любом энергетическом уровне, всегда l = 0; для p-подуровня l = 1; для d-подуровня l = 2, для f-подуровня l = 3, для g-подуровня l = 4 и т.д.
Орбитальное квантовое число характеризует форму и энергию электронных облаков, расположенных на одном и том же энергетическом уровне, но на разных подуровнях. Чем больше значение l, тем выше энергия размещенных на данном подуровне электронов.
Еs-подуровня Еp-подуровня Еd-подуровня Еf-подуровня
Наименьшей энергией на каждом энергетическом уровне, таким образом, обладают электроны s-подуровня, наибольшей – электроны подуровня, имеющего максимальное для данного уровня значение l.
E 
|
4f |
|
4 |
4d |
|
4p |
||
|
||
|
3d |
|
3 |
4s |
|
3p |
||
|
||
|
3s |
|
2 |
2p |
|
2s |
||
|
||
1 |
1s |
|
уровни |
подуровни |
Рис. 5. Схема расщепления энергетических уровней на подуровни
Следует подчеркнуть, что в пределах одного и того же уровня разница в энергии между электронами, расположенными на его разных подуровнях небольшая, в отличие от электронов, расположенных на разных уровнях.
Каждый подуровень состоит из определенного числа атомных орбиталей соответствующего ему вида.
21

Количество орбиталей на данном подуровне определяется числом их возможных направлений или ориентаций при расположении этих орбиталей в пространстве (рис. 6).
При этом каждое отдельное пространственное расположение орбитали характеризуется определенным значением магнитного квантового числа ml, которое может принимать любые целочисленные значения от (-l до +l), включая и нулевое (табл. 2).
Для разных значений l число возможных значений ml различно. Для s-электронов (l = 0) возможно только одно значение ml (ml = 0), поэтому s-подуровень состоит только из одной s- орбитали; для р-электронов (l = 1) возможны три различных значения ml (-1, 0, +1), поэтому p-подуровень состоит из трех p- орбиталей; для d-электронов (l = 2) ml может принимать пять различных значений (-2, -1, 0, +1, +2), поэтому d-подуровень состоит из пяти d-орбиталей; соответственно, f-подуровень – из семи f- орбиталей.
а)
б)
в)
Рис. 6. Формы и пространственная ориентация электронных облаков: а) s-, б) p- и в) d-электронов
22
Таким образом, число орбиталей на каждом подуровне равно числу возможных значений ml, которое определяется соотношением (2l+1).
Число орбиталей на данном энергетическом уровне равно:
Nорб.= n2.
Кроме движения вокруг ядра атома каждый электрон характеризуется собственным механическим моментом движения или импульсом, который называется иначе спином и не связан с перемещением электрона в пространстве. Раньше упрощенно представляли спин, как вращение электрона вокруг собственной оси, которое может осуществляться только по часовой или против часовой стрелки. На самом деле спин – это чисто квантовое свойство электрона, не имеющее аналогов в классической механике.
Таблица 2. Максимальное число электронов на атомных энергетических уровнях и подуровнях
Энер |
Энер- |
Возможные зна- |
Число орбиталей |
Максимальное |
|||
гети- |
гетиче- |
чения магнитно- |
число электронов |
||||
тиче- |
ский |
|
|
||||
го квантового |
на под- |
на |
на под- |
на |
|||
че- |
подуро |
||||||
ский |
уро- |
числа m |
уровне |
уровне |
уровне |
уровне |
|
уро- |
вень |
||||||
|
|
|
|
|
|||
вень |
|
|
|
|
|
|
|
n = 1 |
s (l = 0) |
0 |
1 |
1 |
2 |
2 |
|
|
|
|
|
|
|
|
|
|
s (l = 0) |
0 |
1 |
|
2 |
|
|
n = 2 |
|
|
|
4 |
|
8 |
|
|
p (l = 1) |
–1, 0, + 1 |
3 |
|
6 |
|
|
|
s (l = 0) |
0 |
1 |
|
2 |
|
|
n = 3 |
p (l = 1) |
–1, 0, + 1 |
3 |
9 |
6 |
18 |
|
|
d (l = 2) |
–2, –1, 0, +1, +2 |
5 |
|
10 |
|
|
|
s (l = 0) |
0 |
1 |
|
2 |
|
|
n = 4 |
p (l = 1) |
–1, 0, + 1 |
3 |
16 |
6 |
32 |
|
|
d (l = 2) |
–2, –1, 0, +1, +2 |
5 |
|
10 |
|
|
|
f (l = 3) |
–3,–2,– |
7 |
|
14 |
|
|
|
|
1,0,+1,+2,+3 |
|
|
|
|
|
Для всех электронов абсолютное значение спина (s) всегда равно 12. Проекция спина на ось z или спиновое квантовое
23

число (ms) может иметь лишь 2 значения: ms= +1 2 или ms=
1 2.
Таким образом, состояние любого электрона в атоме может быть охарактеризовано набором из четырёх квантовых чисел (n, l, ml, ms. Причем, согласно принципу (запрету) Паули, в атоме не
может быть двух электронов, у которых все эти четыре числа были бы одинаковыми.
Электроны в многоэлектронном атоме располагаются таким образом, чтобы их суммарная энергия соответствовала минимально возможному значению. Такое состояние атома и его электронов будет наиболее устойчивым. Любое другое его состояние является возбужденным, неустойчивым и из него атом самопроизвольно может переходить в состояние с более низкой энергией.
Всеволод Маврикиевич Клечковский (1900
– 1972) – советский агрохимик. Является автором работ, посвященных теории периодической системы элементов, закономерностям в распределении электронов в атомах и последовательности термов в атомных спектрах. В частности, ввёл (1951) представления о (n + l)-областях электронных состояний в атомах и сформулировал (n + l)-правило формирования электронных конфигураций атомов по мере роста заряда ядра (правила Клечковского). Проводил исследования по изучению вивианита как источника фосфора для растений, а также до-
менных и других металлургических шлаков в качестве удобрений. Исследовал поведение в почвах изотопов стронция, иттрия, циркония.
Согласно принципу Паули на одной орбитали в атоме может находиться не более двух электронов, которые обязательно должны иметь противоположные (антипараллельные) значения ms или спины. Такие два электрона называются спаренными. Электроны с одинаковым значением ms (одинаковыми или параллельными спинами) на одной орбитали размещаться не могут.
Если на орбитали находится один электрон, то он называет-
ся неспаренным.
Максимальное количество электронов, которое может находиться на данном энергетическом уровне, равно удвоенному квадрату номера уровня:
Nэлектронов = 2n2
24
Так, на первом энергетическом уровне не может быть больше 2 электронов, на втором – больше 8, на третьем – больше 18 и на четвертом – больше 32. Максимальное количество электронов на последующих электронных слоях у известных к настоящему времени элементов не меняется и остается равным 32.
Уровень энергии электронной орбитали в атоме определяется суммой её главного и орбитального квантовых чисел (n + l), чем она больше, тем энергия орбитали выше.
Орбитали, расположенные на одном и том же подуровне, имеют одинаковое значение суммы (n + l). В соответствии с этим последовательность заполнения электронами энергетических уровней и подуровней невозбужденного атома определяется двумя правилами Клечковского.
Первое правило: «Последовательное заполнение элек-
тронных орбиталей в атоме происходит от подуровня с меньшим значением суммы (n + l) к подуровню с большим значением этой суммы».
Второе правило: «Заполнение подуровней с одинаковыми
значениями суммы (n + l) происходит последовательно в направлении возрастания главного квантового числа n».
В соответствии с этими двумя правилами очередность заполнения подуровней для первых четырех уровней будет иметь следующий вид:
1s-подуровень2s-подуровень2p-подуровень3s-подуровень n+l=1+0=1 n+l=2+0=2 n+l=2+1=3 n+l=3+0=3
3p-подуровень4s-подуровень3d-подуровень n+l=3+1=4 n+l=4+0=4 n+l=3+2=5
4р-подуровень n+l=4+1=5
Рассуждая аналогичным образом, можно определить очередность заполнения подуровней и для элементов с большим числом энергетических уровней. Так, например, для атома, содержащего шесть электронных слоев, последовательность заполнения электронами подуровней выглядит следующим образом:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p
25

Хунд Фридрих (1896–1986 )- немецкий фи-
зик-теоретик. Важнейшие научные работы Хунда посвящены квантовой механике, спектроскопии (систематика атомных и молекулярных спектров), магнетизму, квантовой химии, истории физики.В 1927 г. Хунд сформулировал эмпирические правила, регулирующие порядок заполнения атомных орбиталей электронами (правила Хунда). Ввёл (1931) представления о пи- и сигма-электронах и о пи- и сигмасвязях в молекулах. Исследовал закономерности взаимодействия угловых моментов в двухатомных молекулах (случаи Хунда). В 1928-1932 гг. принимал участие (наряду с Р.С. Малликеном и
Дж.Э. Леннард-Джонсом) в разработке основного метода квантовой химии – метода молекулярных орбиталей. Метод основан на предположении, что внешние электроны молекулы, которые определяют многие из её важных свойств, находятся не на орбиталях отдельных атомов, а на орбиталях, принадлежащих молекуле в целом.
Заполнение электронами подуровня, состоящего из более чем одной орбитали (p-, d- или f-подуровня), подчиняется пра-
вилу Хунда: «Впределах энергетического подуровня орбитали заполняются электронами так, чтобы их суммарный спин был максимальным». Это означает, что в пределах одного подуровня электроны сначала заполняют все свободные орбитали, а затем на каждую такую орбиталь добавляется по второму электрону.
Электронные формулы и электронно-графические схемы
Распределение электронов в атомах выражается с помощью
формул электронных конфигураций или электроннографических схем.
В электронно-графических схемах любую электронную орбиталь изображают ячейкой , а электрон в ней – стрелкой « » или « ». Направление стрелки указывает значение ms. Электрон с ms=+1 2 условно обозначают , а с ms= 1 2 условно обозначают .
Два электрона, размещенные в одной орбитали, обязательно должны иметь противоположный спин: 
26

Номер энергетического уровня, на котором располагается орбиталь, обозначают цифрой, а вид подуровня – соответствующей буквой: s, p, d или f.
Так электронно-графическая схема атомов водорода и гелия выглядит следующим образом:
|
s |
s |
|
|
|
1H 1 |
|
2 He 1 |
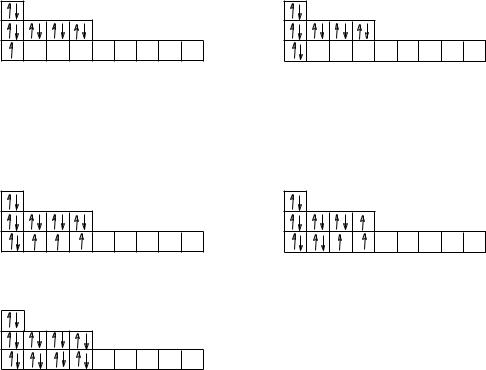
При составлении электронно-графических схем других атомов сначала записывают их так называемый «орбитальный скелет», т.е. рисуют в виде клеточек все их электронные орбитали, сгруппированные в соответствующие уровни и подуровни, а затем распределяют электроны данного атома по орбиталям в соответствии с правилами Клечковского и Хунда.
«Орбитальный скелет» атома можно графически изображать разными способами. Покажем это на примере электроннографических схем элементов 2 периода:
|
s |
|
2 |
|
|
s |
s |
p |
1 |
p |
|
5 B 1 |
p |
|
|||
|
|
N 1 |
2 |
2 |
||||
3 Li 2 |
|
|
s |
|
7 |
|||
|
|
|
|
|
|
|||
|
2s |
2p |
|
|
|
2s |
2p |
|
|
|
|
|
|
|
|
||
|
1s |
|
|
|
1 |
|
|
|
|
|
|
|
|
s |
|
|
|
|
9F |
|
|
|
10Ne |
|
|
|
Мы в дальнейшем будем придерживаться схемы атома Li.
При составлении электронных формул или электронных конфигураций сначала цифрой указывают номер энергетического уровня (или электронного слоя), затем буквой – вид подуровня и в виде показателя степени – количество электронов на данном подуровне.
Например:
1H 1s1; 3Li 1s22s1; 5B 1s22s22p1; 7N 1s22s22p3; 9F 1s22s22p5; 10Ne 1s22s22p6.
27
Уэлементов He и Ne на внешнем электронном слое содержится максимально возможное число электронов (2 – у гелия и 8
у– неона). Такой электронный слой полностью заполнен и поэтому является весьма устойчивым.
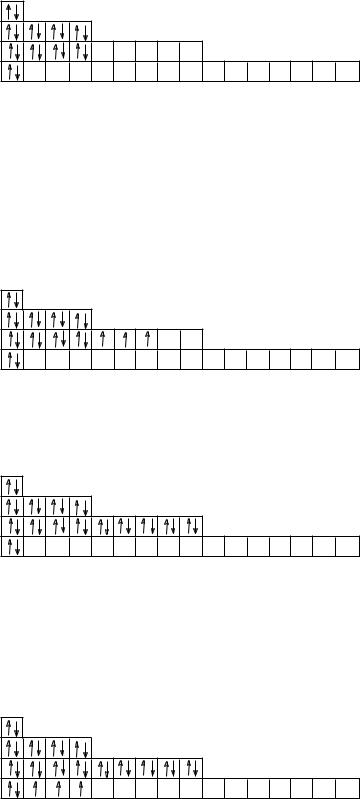
Уатомов элементов третьего периода начинает формироваться третий электронный слой. Причем сначала электронами заполняется 3s-подуровень у натрия и магния:
11Na 1s22s22p63s1 |
и |
12Mg 1s22s22p63s2. |
||
Электронно-графические схемы этих элементов выглядят |
||||
следующим образом: |
|
|
|
|
|
s |
|
|
s |
1 |
p |
|
1 |
p |
2 |
d |
|
2 |
d |
3 |
|
|
3 |
|
11Na 1s22s22p63s1 |
|
12Mg 1s22s22p63s2 |
||
Затем в соответствии с правилом Хунда заполняется 3рподуровень:
|
s |
|
|
s |
1 |
p |
|
1 |
p |
2 |
|
d |
2 |
d |
3 |
|
|
3 |
|
|
15Р 1s22s22p63s23р3 |
16S 1s22s22p63s23р4 |
|
s |
|
1 |
p |
|
2 |
d |
|
3 |
|
|
|
18Ar 1s22s22p63s23р6 |
|
В атоме аргона на внешнем электронном слое содержится 8 электронов. Такая электронная конфигурация тоже является устойчивой, хотя, как следует из таблицы 3, на третьем энергетическом уровне максимально может содержаться 18 электронов. Недостающие 10 электронов должны заполнить 3d-подуровень, но его формирование (в соответствии с первым правилом Клечковского) происходит в атомах элементов 4 периода после заполнения 4s-подуровня нового электронного слоя.
28
|
s |
1 |
p |
2 |
d |
3 |
f |
4 |
|
20Ca 1s22s22p63s23р64s2
Дальше, в соответствии со вторым правилом Клечковского, заполняется не 4р-подуровень, а 3d-подуровень, только в отличие от аргона, у следующих за кальцием 10 элементов (Sc, Ti, V, Cr …) этот подуровень располагается уже не на внешнем слое, а на предвнешнем.
|
s |
1 |
p |
2 |
d |
3 |
f |
4 |
|
23V 1s22s22p63s23р63d34s2
В атомах Zn заполнение 3d-подуровня завершается:
|
s |
1 |
p |
2 |
d |
3 |
f |
4 |
|
30Zn 1s22s22p63s23р63d104s2
В атомах последующих 6 элементов (Ga, Ge, As …), согласно второму правилу Клечковского, начинает формироваться 4рподуровень внешнего слоя.
|
s |
1 |
p |
2 |
d |
3 |
f |
4 |
|
|
33As 1s22s22p63s23р63d104s24p3 |
29

Ватомах криптона завершается заполнение этого подуровня
иу последующих элементов появляется новый пятый энергетический уровень.
|
s |
1 |
p |
2 |
d |
3 |
f |
4 |
|
|
36Kr 1s22s22p63s23р63d104s24p6 |
Таким образом, в атоме любого элемента (кроме 1Н и 2Не) на внешнем энергетическом уровне максимально может находиться не более 8 электронов.
Состояние атома с полностью или наполовину заполненным подуровнем, т.е., когда на каждой его орбитали имеется по одному неспаренному электрону, является более устойчивым. Этим объясняется такое явление, как самопроизвольный «проскок» или
«провал» электрона с подуровня, обладающего меньшей энергией, на подуровень с большей энергией. Например, с 4s-подуровня на 3d-подуровень у элементов Cr, Cu.
|
s |
1 |
p |
2 |
d |
3 |
f |
4 |
|
|
s |
1 |
p |
2 |
d |
3 |
f |
4 |
|
|
24Cr 1s22s22p63s23р63d54s1 |
s |
|
1 |
p |
2 |
d |
3 |
f |
4 |
|
|
30 |
