
Общая химия (часть 2, 2012 г
.).pdf
зеркальными отображениями. В простейшем случае – это комплекс тетраэдрического строения с четырьмя различными лигандами. Он может существовать в виде двух пространственных изомеров, которые относятся друг к другу как предмет и несовместимое с ним зеркальное отображение.
Такие изомеры называются оптическими или энантиомера-
ми.
Природа химических связей в комплексных соединениях
В основе механизма образования комплексных соединений лежит прежде всего взаимодействие между комплексообразователем и лигандами. Природа связи между ними в современной химии описывается с помощью различных квантово-
механических методов: метода валентных связей, теории кри-
сталлического поля, теории поля лигандов и метода молекулярных орбиталей.
С точки зрения метода валентных связей, комплексообразователь образует с лигандами ковалентные связи по донорноакцепторному механизму. Данная связь в комплексных соединениях называется иначе координационной связью. При этом комплексообразователь представляет вакантную орбиталь и выступает в роли акцептора электронной пары, а лиганды – неподеленную электронную пару, выступая в роли ее донора.
Вакантные орбитали центрального атома, участвующие в образовании связей, подвергаются гибридизации. Ее вид опреде-
171
ляется как электронной структурой комплексообразователя, так и числом, природой и электронной структурой лигандов.
Гибридизация электронных орбиталей комплексообразователя, в свою очередь, оказывает влияние на геометрию комплекса, т.е. пространственное расположение лигандов во внутренней координационной сфере (табл. 18).
Таблица 18. Геометрическая конфигурация комплексного иона и тип гибридизации комплексообразователя
Комплексный ион |
Вид гибридизации ор- |
Геометрическая |
|
|
|
биталей комплексооб- |
структура комплек- |
|
|
разователя |
са |
[Cu(NH3)2]+ |
sp |
линейная |
|
[Zn(NH ) ]2+ |
sp3 |
тетраэдрическая |
|
3 |
4 |
|
|
[Ni(CN) ]2– |
*dsp2 |
квадратная |
|
4 |
|
|
|
[Co(NH3)6]3+ |
*d2sp3 |
октаэдрическая |
|
[CoF6]3– |
|
sp3d2 |
октаэдрическая |
* гибридизации подвергаются d-орбитали на предвнешнем энергетическом уровне (орбитали 3d-подуровня).
Внастоящее время метод валентных связей применительно
ккомплексным соединениям потерял свое былое значение. При всех своих достоинствах (простоте и наглядности) он не позволяет объяснить ряд важных свойств соединений, в частности, их спектры поглощения, детали магнитных свойств и др.
Более предпочтительной в этом плане является теория кристаллического поля (ТКП). Она основана на предположении, что между комплексообразователем и лигандами осуществляется чисто электростатическое взаимодействие.
Однако, в отличие от классических электростатических представлений, в теории кристаллического поля учитывается пространственное распределение электронной плотности d- орбиталей предвнешнего слоя комплексообразователя.
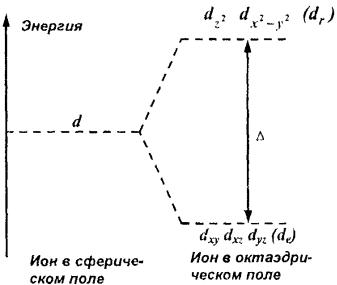
Всвободном атоме (или ионе) электроны, находящиеся на любой из орбиталей d-подуровня, обладают одинаковой энергией. Если этот атом (ион) поместить в центре сферы с равномерно распределенным на ее поверхности отрицательным зарядом, то на все 5 d-электронных орбиталей будет действовать одинаковая
172
сила отталкивания. В результате энергия расположенных на этих орбиталях d-электронов возрастет на одну и ту же величину.
Если же атом (ион) попадает в создаваемое лигандами несимметричное поле (октаэдрическое, тетраэдрическое и др.), то энергия d-электронов будет возрастать тем значительнее, чем ближе к лигандам расположено соответствующее электронное облако. Например, в октаэдрическом поле d-орбитали разделяются на две группы с разными значениями энергий (рис. 39): три орбитали (dxy, dxz, dyz) с более низкой энергией (dе-орбитали) и две орбитали (dz2 и dх2–у2) – с более высокой энергией (dr- орбитали). Разность между энергиями dе- и dr-орбиталей называется энергией расщепления и обозначается греческой буквой .
Для конкретного комплексообразователя значение энергии расщепления определяется природой лигандов. В порядке убывания вызываемой ими энергии расщепления лиганды располагаются в следующий ряд:
NO, CO, CN– > NO2– > NH3 > Н2О > OH– > F– > Cl– > Br– > I–,
который называется спектрохимическим рядом ИрвингаВильямса.
Рис. 39. Схема расщепления орбиталей d-подуровня
Лиганды, расположенные в конце спектрохимического ряда (так называемые лиганды слабого поля), вызывают малое расщепление энергии d-подуровня. В этом случае энергия взаимного
173
отталкивания двух спаренных электронов оказывается более высокой, чем энергия расщепления. Поэтому d-орбитали заполняются электронами в соответствии с правилом Хунда: первые 3 электрона распределяются по одному на dе-орбиталях, а следующие два – на dr-орбиталях. Только после этого начинается попарное заполнение электронами сперва dе-, а затем dr-орбиталей.
Лиганды, расположенные в начале спектрохимического ряда (лиганды сильного поля), вызывают значительное расщепление d-подуровня. При этом энергия расщепления превышает энергию межэлектронного отталкивания спаренных электронов. Поэтому сначала заполняются dе-орбитали (сперва одиночными, а затем спаренными электронами, после чего происходит заполнение dr- орбиталей.
Если на подуровне есть незаполненная орбиталь, то при поглощении комплексным ионом света возможен переход электрона с нижнего электрического подуровня dе на dr-подуровень.
Этот переход определяет цвет комплексного соединения, т.к. энергия поглощаемого кванта света (Е) равна энергии расщепления ().
Теория кристаллического поля дает возможность объяснить многие свойства комплексных соединений: магнитные, оптические и др. Но ее применение ограничено, главным образом, соединениями с преимущественно ионным характером связи между центральным атомом и лигандами. Кроме того, она не может объяснить положение лигандов в спектрохимическом ряду.
При рассмотрении комплексов, в которых, кроме ионных связей, присутствует и сравнительно небольшая доля ковалентных связей, используется усовершенствованная модернизация теории кристаллического поля – теория поля лигандов, согласно которой наличие ковалентной связи учитывается введением определенных поправок в расчеты, приводимые методами ТКП, прежде всего на основе использования идеи перекрывания орбиталей.
При рассмотрении комплексных соединений со значительной долей ковалентных связей наиболее полное и точное описание характера взаимодействия центрального атома и лигандов может быть дано на основе метода молекулярных орбиталей,
учитывающего структуру комплексообразователя и лигандов как
174

единого целого. Метод молекулярных орбиталей фактически объединяет идеи как теории валентных связей, так и теории кристаллического поля, и является ведущим и наиболее плодотворным в теории строения комплексных соединений, однако он достаточно сложен для понимания.
Указанные методы трактовки природы координационной связи не взаимоисключают, а, наоборот, дополняют друг друга и позволяют дать многогранное описание столь сложных веществ, какими являются комплексные соединения.
Диссоциация комплексных соединений
Комплексные соединения при растворении в Н2О обычно диссоциируют в два этапа. На первом этапе происходит отщепление ионов внешней сферы. Внутренняя сфера ведет себя при этом как единое целое, представляя собой положительно или отрицательно заряженный ион:
[Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl–
K4[Fe(CN)6] 4K+ + [Fe(CN)6]4–
Такая диссоциация называется первичной. Она протекает по типу диссоциации сильных электролитов, т.е. необратимо и до конца.
На втором этапе происходит диссоциация самого комплексного иона или внутренней сферы. Она называется вторичной, протекает по типу диссоциации слабых электролитов, т.е. обратимо (не до конца) и характеризуется наличием равновесия между комплексным ионом, комплексообразователем и лигандами:
[Ag(NH3)2]+ 
 Ag+ + 2NH3
Ag+ + 2NH3
[Fe(CN)6]4– 
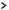 Fe2+ + 6CN–
Fe2+ + 6CN–
Количественно диссоциация комплексного иона характеризуется константой равновесия обратимой реакции, назы-
ваемой иначе константой нестойкости комплекса (Kнест.):
K с Ag c2 NH3
нест.
c Ag NH3 2
K |
|
|
с Fe2 с6 |
CN |
|
||
нест. |
с Fe CN |
4 |
|
|
|||
|
|
|
|
||||
|
|
|
|
|
|||
|
|
|
|
6 |
|
|
|
175

Константа нестойкости может служить мерой устойчивости комплекса, поскольку, чем меньше ее величина, тем более устойчивым считается комплекс. Однако такая закономерность напрямую применима только к однотипным комплексам, т.е. имеющим одинаковое число лигандов во внутренней сфере.
Иногда вместо константы нестойкости комплексов используется обратная ей величина, называемая константой устойчи-
вости (Kуст.):
|
|
1 |
|
|
|
с Ag NH3 |
2 |
|
|
|
|
|
с Fe CN 6 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
K |
уст. |
|
; |
K |
уст. |
|
|
; |
K |
уст. |
|
|
|
|
|||||
Kнест. |
с Ag с2 |
NH3 |
с Fe 2 с6 |
CN |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
В этом случае комплексный ион считается тем более устойчивым, чем больше величина Kуст.
Комплексные ионы, содержащие в своем составе несколько лигандов, подобно слабым многоосновным кислотам или многокислотным основаниям, диссоциируют ступенчато. Каждая последующая стадия при этом протекает хуже, чем предыдущая. Общее число стадий или ступеней равно количеству лигандов во внутренней сфере.
Так, ион [Ag(NH3)2]+ диссоциирует в 2 стадии:
1) |
[Ag(NH |
3 |
) ]+ |
|
|
|
|
[AgNH ]+ + NH |
3 |
K |
|
|
|
|
|
||||||||
|
|
|
|||||||||
|
|
2 |
|
3 |
1 |
||||||
2) |
[AgNH3]+ |
|
|
|
Ag+ + NH3 |
|
K2 |
||||
|
|
|
|
||||||||
|
|
|
|||||||||
а ион [Fe(CN)6]4– диссоциирует в 6 стадий:
1) |
[Fe(CN)6]4– |
|
|
|
|
[Fe(CN)5]3– + CN– |
K1 |
||
|
|
|
|
||||||
|
|
|
|||||||
2) |
[Fe(CN)5]3– |
|
|
|
|
[Fe(CN)4]2– + CN– |
K2 |
||
|
|
|
|
||||||
|
|
|
|
||||||
3) |
[Fe(CN)4]2– |
|
|
|
|
[Fe(CN)3]– + CN– |
K3 |
||
|
|
|
|
||||||
|
|
|
|
||||||
4) |
[Fe(CN)3]– |
|
|
|
|
|
[Fe(CN)2]0 + CN– |
K4 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|||||
5) |
[Fe(CN)2]0 |
|
|
|
|
|
[FeCN]+ + CN– |
K5 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|||||
6) |
[Fe(CN)]+ |
|
|
|
Fe2+ + CN– |
K6 |
|||
|
|
|
|
||||||
|
|
|
|||||||
176
Каждая стадия диссоциации комплексного иона характеризуется своей константой нестойкости или устойчивости (K1,
K2, …).
Общая константа нестойкости (или устойчивости) комплекса равна произведению констант нестойкости (или устойчивости) каждой из стадий. Для вышеприведенных ком-
плексных ионов это будет выглядеть следующим образом:
Kнест.([Ag(NH3)2]+) = K1 K2
Kнест.( [Fe(CN)6]4–) = K1 K2 K3 K4 K5 K6
Значения констант нестойкости комплексных ионов определяются опытным путем и приводятся в соответствующих справочниках (табл. 19).
При наличии в растворе нескольких лигандов, способных к образованию комплексного соединения с ионом металла, наблюдается совмещенное лигандообменное равновесие. Процессы образования комплексного соединения с каждым из лигандов являются конкурирующими: преобладающим будет процесс, который приводит к образованию наиболее прочного (т.е. с наименьшей константой нестойкости) комплексного иона. Заключение о сравнительной прочности комплексных ионов на основании величины Kнест. можно напрямую делать только для однотипных соединений (с одинаковым числом лигандов во внутренней сфере).
Таблица 19. Общие константы нестойкости некоторых комплексных ионов при 25оС
Вид иона |
Величина Kнест. |
Вид иона |
Величина Kнест. |
|
[Co(CN)6]2– |
8,1 10–20 |
[Ag(NH3)2]+ |
6,8 |
10–8 |
[Cu(CN)4]2– |
2,0 10–30 |
[Cu(NH3)2]2+ |
1 10–12 |
|
[Fe(CN)6]3– |
1,3 10–44 |
[Co(NH3)6]2+ |
1 10–5 |
|
[Zn(CN)4]2– |
2,4 10–20 |
[Pt(NH3)4]2+ |
5 10–34 |
|
[Ni(CN)4]2– |
1,4 10–31 |
[Zn(NH3)4]2+ |
1,3 10–8 |
|
[Fe(CN)6]4– |
1,3 10–37 |
[Co(NH3)6]3+ |
1 10–35 |
|
Например, если в растворе в равных концентрациях окажутся ионы Zn2+, молекулы NH3 и ионы CN–, то преимущественно
образуется ион [Zn(CN)4]2–, а не [Zn(NH3)4]2+, так как Kнест. первого иона значительно меньше (табл. 19).
177
Существуют и такие совмещенные лигандообменные равновесия, в которых объектом конкуренции является лиганд, а конкурирующими частицами ионы металлов. Например, если в растворе будут присутствовать ионы Zn2+ и Ni2+ и цианид-ионы, то преимущественно образуется ион [Ni(CN)4]2–, а не [Zn(CN)4]2–, т.к. у первого комплекса константа нестойкости гораздо меньше (табл. 18).
В отличие от реакций ионного обмена, образование комплексных соединений часто не является мгновенным процессом. Например, разрушение иона [Co(NH3)6]3+ при добавлении кислоты полностью происходит при 20оС за несколько дней.
Хелатирование.
Его роль в биологии и медицине
Хелатирование комплексообразователя лигандом, когда лиганд предоставляет комплексообразователю два и более атома, образуя с ним циклическую структуру, широко распространено в природе. Центральный атом такого комплекса оказывается как бы втянутым внутрь лиганда (см. строение глицината меди) и охвачен связями наподобие клешней рака. Отсюда их название
хелатные (chelate – клешня).
Би- и полидентатные лиганды связываются с ионом комплексообразователя намного прочнее, чем монодентатные. Определяемая по величинам констант нестойкости прочность хелатных этилендиаминовых комплексов [M(En)2]n+ на 8-10 порядков выше, чем прочность комплексных ионов тех же металлов с аммиаком [M(NH3)4]n+, хотя у тех и у других по четыре однотипных связи M N. Объясняется это взаимосвязанностью донорных атомов в пределах би- и полидентатного комплекса. Чтобы удалить молекулу NH3 из комплекса [M(NH3)4]n+, требуется разорвать только одну связь M – N. Для удаления H2NCH2CH2NH2 из комплекса [M(En)2]n+ необходим разрыв уже двух связей, образованных двумя атомами азота.
Повышенная прочность комплексных соединений с би- и полидентатными лигандами называется хелатным эффектом. Хелатный эффект полидентатных лигандов настолько велик, что они могут формировать устойчивые комплексы даже с ионами
178
щелочных и щелочно-земельных металлов. Хорошо известным примером является хлорофилл – важнейший природный комплекс магния с порфином:
|
|
|
|
|
H3C |
CH CH |
2 |
|
|
|
|
|
|
|
|
|
N |
|
|
H3C |
|
N |
|
|
|
|
|
CH3 |
|||
|
H |
2+ |
O |
H |
|
||
|
Mg |
|
N |
Mg N |
|
||
|
|
|
|
||||
N |
N |
|
CH2 |
CH2 |
|
||
|
|
|
|
||||
|
|
|
|
CH2CH3 |
|||
|
H |
|
фитил O |
H |
|
||
|
N |
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
H3C |
O |
|
CH3 |
|
|
|
|
|
O |
O |
|
|
|
порфин |
|
|
|
хлорофилл |
|
|
В молекуле порфина два атома водорода, связанные с азотом, легко замещаются на ион металла. Еще две связи, – двух оставшихся атомов азота с ионом магния, – формируются по до- норно-акцепторному механизму.
Хлорофилл играет ключевую роль в процессе фотосинтеза, являющемся самой масштабной химической реакцией на Земле. Хотя при этом утилизируется не более 1% световой энергии, падающей на лист растения, продукция фотосинтеза (1011 тонн органического вещества в год) в сотни раз превышает продукцию всего нефтехимического производства, а запасаемая в растениях энергия во столько же раз превышает энергию сжигаемого человечеством топлива.
Примерно одинаковую структуру ядра (порфиновое кольцо) имеет второй природный комплекс – гем крови. Разница лишь в том, что у гема роль комплексообразователя выполняют катионы двухвалентного железа (II). Координационное число ионов Mg2+ и Fe2+ равно 6, поэтому по вакантным местам присоединяются ещё две молекулы иных веществ. Например, в гемоглобине по одну сторону хелата присоединяется молекула белка глобина, а по другую – молекула кислорода, благодаря чему это соединение является переносчиком кислорода в крови:
179
|
O 2 |
N |
|
|
|
|
N |
|
|
Fe2+ |
|
N |
|
N |
глобин
Роль металла в биокомплексах высокоспецифична: замена его даже на близкий по физико-химическим параметрам металл приводит к значительной или полной утрате физиологической активности комплекса. В случае гемоглобина только кобальтовый аналог природного соединения обладает незначительной способностью связывать и переносить кислород.
Из других значимых в биологическом отношении комплексных соединений следует выделить витамин В12 и многие металлоферменты (каталаза, переносчики электронов – цитохромы), дефицит которых у человека приводит к серьезным заболеваниям.
Хелатный эффект дает ключ к пониманию состояния катионов, особенно d-элементов, в организме. Все d-элементы оказываются прочно связанными теми или иными полидентатными биолигандами, как правило, аминокислотами, полипептидами или циклическими биолигандами – производными порфина. В свободном виде, и то в виде аквакомплексов: [Cu(H2O)4]2+, [Fe(H2O)6]3+ и др., эти катионы обнаруживаются лишь в плазме крови, причем в ничтожных количествах.
Наблюдаемое при хелатировании снижение констант нестойкости комплексных ионов обусловило использование полидентатных лигандов (комплексонов) в аналитической химии, токсикологии, гигиене и т.д. Часто это базируется на разрушении комплексоном менее устойчивого соединения с переводом его в более прочное комплексное, имеющее меньшую константу нестойкости. Примером может служить растворение осадка Cu(OH)2 в растворе NH3, при этом образуется комплексное основание:
Cu(OH)2↓ + 4NH3 = [Cu(NH3)4](OH)2.
Связывание гемоглобина молекулами угарного газа (СО) является аналогичным примером разрушения одного биокомплекса – оксигемоглобина – за счет формирования в 300 раз более прочного другого биокомплекса – карбонилглобина:
180
