
Общая химия (часть 2, 2012 г
.).pdfНа нижнем конце бюретки находится стеклянный пришлифованный кран (рис. 50 а), или небольшое овальное расширение, на которое плотно надевается резиновая трубка со стеклянным, оттянутым в капилляр, концом. Резиновая трубка зажимается металлическим зажимом или стеклянной бусиной, представляющей собой стеклянный шарик с диаметром немного больше внутреннего диаметра резиновой трубки (рис. 50 б, в). Шарик помещается внутри трубки между концом бюретки и оттянутым стеклянным капилляром. Нажимая большим и указательным пальцами на резиновую трубку возле шарика, образуют внутри ее узкий просвет, через который жидкость вытекает из бюретки с большей или меньшей скоростью (рис. 50 г).
У бюреток, снабжённых краном, кран смазывают очень тонким слоем вазелина, следя за тем, чтобы вазелин не попал в канал крана.
Перед титрованием бюретку нужно подготовить в работе. Для этого её тщательно моют, ополаскивают несколько раз дистиллированной H2O, а затем раствором, которым она должна наполняться. Бюретку закрепляют в штативе в вертикальном положении, заполняют с помощью воронки нужным раствором до 2/3 её объёма. В кране или резиновой трубке и в наконечнике не должно оставаться пузырьков воздуха. Чтобы удалить их, нужно несколько раз быстро открыть и закрыть кран (зажим) и спустить жидкость сильной струёй.
В бюретках со стеклянным шариком для удаления воздуха отгибают вверх резиновую трубку с капилляром и нажимают на шарик. Жидкость выливается через загнутую вверх резиновую трубку и вытесняет из неё и капилляра весь воздух (рис. 52).
211

Рис. 52. Удаление воздуха из капилляра бюретки
Убедившись в полном удалении воздуха, бюретку снова заполняют жидкостью – сначала выше нулевого деления, а затем, открыв кран либо зажим или надавив на шарик, точно до нулевого деления.
Отсчёты уровня светлых жидкостей производят по их нижнему мениску, а тёмных – по верхнему. При выполнении нескольких измерений в каждом из них все отсчёты делают аналогичным образом.
Проведение титрования
С помощью пипетки отмеряют, а затем переносят в колбу для титрования соответствующий объём раствора. Если титрование осуществляют в присутствии индикатора, то в колбу для титрования добавляют несколько его капель (как правило, 1-2 капли). Приготовленную таким образом колбу помещают на белом фоне под бюреткой (рис. 53).
212
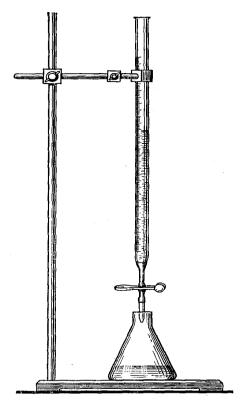
Рис. 53. Положение колбы и бюретки при титровании
Нажимая большим и указательным пальцами левой руки на шарик бюретки, добавляют в колбу небольшими порциями второй раствор. При этом правой рукой осторожно встряхивают колбу для быстрого перемешивания раствора.
Вблизи точки эквивалентности раствор в колбе в месте падения капли раствора из бюретки на некоторое время приобретает окраску, характерную для точки эквивалентности. Это может служить признаком приближающегося конца реакции титрования. В этом случае раствор из бюретки начинают прибавлять по одной капле, каждый раз внимательно наблюдая окраску смеси в колбе.
После стойкого (неисчезающего) изменения окраски титрование прекращают и записывают показание объема жидкости в бюретке.
Первое титрование служит для ориентировочного установления объёма и при расчётах не используется. Титрование с тем же исходным объёмом раствора в колбе проводят ещё не менее трёх раз. Перед началом каждого нового опыта уровень жидкости в бюретке снова доводят до нулевой отметки.
213
Первую порцию жидкости при повторном титровании спускают из бюретки одномоментно (объём её должен быть немного меньше 0,5-1 мл) результата первого титрования. После этого дотитровывают раствор по каплям до наступления точки эквивалентности. По результатам нескольких измерений рассчитывают средний объём раствора, пошедшего на титрование.
Кислотно-основное титрование
Общая характеристика метода
В основе многих методов объёмного анализа лежат реакции ионного обмена. К их числу относятся и кислотно-основные реакции, сущность которых сводится к взаимодействию между собой в водных растворах ионов гидроксония и гидроксильных
ионов:
Н3О+ + ОН¯ = 2Н2О
В упрощённом виде данную реакцию можно записать следующим образом:
Н+ + ОН¯ = Н2О
При протекании таких реакций часто происходит передача протона от титранта к титруемому веществу или наоборот (если один из реагентов является слабым электролитом).
Реакции кислотно-основного взаимодействия (или подругому: реакции нейтрализации) характеризуются высокой скоростью и протекают строго стехиометрически.
Метод кислотно-основного титрования применяется для количественного определения кислот, оснований или солей, способных гидролизоваться в водных растворах. В зависимости от природы используемого титранта кислотно-основное титрование подразделяется на ацидиметрию (acidium-кислота) и алкали-
метрию (alkalis – щёлочь).
В ацидиметрии в качестве рабочего раствора (титранта) чаще всего используют соляную кислоту, реже - серную, т.к. она в ряде случаев может образовывать с исследуемым веществом осадки, которые будут влиять на точность результатов анализа.
214
Азотная кислота, являясь сильным окислителем, может вступать в побочные реакции, не предусмотренные стехиометрией основного процесса, поэтому в ацидиметрии используется редко, кроме того, её растворы могут частично разлагаться при нагревании и на свету.
Растворы НСl и H2SO4 нельзя приготовить по точной навеске исходного вещества из-за летучести первого и гигроскопичности второго.
Поэтому их готовят разбавлением концентрированных растворов, а затем точный титр устанавливают с помощью другого стандартного раствора.
В ацидиметрии для этих целей используют растворы карбоната натрия Na2CO3 (соды) или декагидрата тетрабората натрия Na2B4O7·10H2O (буры), полученные растворением в соответствующем объёме H2O рассчитанной навески.
Уравнения протекающих при этом реакций будут иметь вид:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2 Na2B4O7 + 2HCl + 5H2O = 2NaCl + 4H3BO3
Таким образом, фактор эквивалентности соды и буры в этом случае равен 1/2.
Рабочие растворы кислот (HCl, H2SO4) являются устойчивыми и могут храниться без изменения своего количественного и качественного состава продолжительное время. Обычно в ацидиметрии используют растворы с молярной концентрацией химического эквивалента кислоты от 0,01 моль/дм3 до 0,2 моль/дм3.
Ацидиметрия используется для количественного определения оснований и солей, вступающих в необратимое взаимодействие с сильными кислотами.
В алкалиметрии в качестве титрантов используют растворы щелочей (NaOH, KOH, Ba(OH)2), в которых молярная концентрация эквивалента вещества колеблется в интервале от 0,01 моль/дм3 до 0,2 моль/дм3. Их не готовят по точной массе рассчитанной навески, поскольку щелочи являются гигроскопичными и даже при правильном хранении содержат в качестве примесей небольшое количество воды и карбонатов, а получают разбавлением концентрированных растворов с последующей стандартизацией другим раствором, титр которого известен. Для этих це-
215
лей обычно используют стандартные растворы щавелевой Н2С2О4 или янтарной Н2С4Н4О4 кислот:
Н2С2О4 + 2NaOH = Na2C2O4 + 2H2O Н2С4Н4О4 + 2NaOH = Na2C4H4O4 + 2H2O
Рабочие растворы щелочей сохраняют свою устойчивость, если их хранить не в стеклянной, а в парафинированной либо фторопластовой посуде. Необходимо также учитывать, что растворы щелочей поглощают СО2 из воздуха с образованием карбонатов. Вследствие этого их титр желательно устанавливать непосредственно перед проведением анализа.
Алкалиметрию используют для количественного определения кислот и солей, гидролизующихся по катиону, т.е. имеющих кислую реакцию среды.
Для стандартизации рабочих растворов в кислотноосновном титровании могут использоваться и те растворы НСl, H2SO4 либо NaOH, KOH, точный титр которых уже установлен с помощью первичных стандартов.
Стандартные растворы кислот и щелочей можно получить также из фиксаналов, выпускаемых промышленностью. Это значительно сокращает затраты времени и средств на подготовительной стадии анализа.
Определение точки эквивалентности в кислотно-основном титровании. Кислотно-основные индикаторы
Характерной особенностью ацидо- и алкалиметрии является непрерывное изменение рН раствора в процессе титрования.
В точке эквивалентности среда может быть нейтральной, слабокислой или слабощелочной в зависимости от природы взаимодействующих между собой веществ.
Можно выделить в связи с этим три основных случая:
1. Титрование сильной кислоты сильным основанием:
HCl + NaOH → NaСl + H2O
216
Продуктом данной реакции является соль, не подвергающаяся гидролизу. Значит, точка эквивалентности в этом случае будет находиться в нейтральной среде при рН = 7.
2. Титрование слабой кислоты сильным основанием:
CH3COOH + NaOH ↔CH3COONa + H2O
Образовавшаяся при этом соль в водном растворе будет подвергаться гидролизу по аниону:
СН3СОО- + НОН↔СН3ООН + ОН-
Вследствие этого даже после полного расходования исход-
ных веществ реакция среды в точке эквивалентности будет
слабощелочной (рН>7).
3. Титрование слабого основания сильной кислотой:
NH3·H2O + HCl ↔NH4Cl + H2O
Получившаяся соль в водном растворе станет подвергаться гидролизу по катиону:
NH4+ + HOH↔NH3·H2O + H+
Реакция среды в точке эквивалентности будет слабокислой (рН<7).
Взаимодействия между кислотами и основаниями не сопровождаются, как правило, какими-либо внешними эффектами. Большинство растворов кислот и щелочей являются бесцветными, как и растворы, образующихся при их взаимодействии солей.
Конечную точку титрования обнаруживают потенциометрически, кондуктометрически, спектро-фотометрически или другими инструментальными методами, а также визуально.
Для визуального фиксирования точки эквивалентности ши-
роко используют кислотно-основные индикаторы (indicator –
указатель).
В их роли выступают сложные органические вещества, способные изменять свою окраску в зависимости от рН раствора. По своей природе данные соединения представляют слабую кислоту или основание, которые в водной среде могут одновременно су-
217
ществовать как в ионизированной, так и в неионизированной форме.
Например, если индикатор является слабой кислотой HInd, то в растворе будет наблюдаться следующее равновесие:
HInd + H2O ↔ Ind- + H3O+ |
|
неионизированная |
ионизированная |
форма |
форма |
Если индикатор – слабое основание Ind, то аналогичный процесс можно условно представить следующим образом:
Ind + H2O ↔ HInd+ + OH- |
|
неионизированная |
ионизированная |
форма |
форма |
Обе формы индикатора окрашены в разный цвет и их равновесное количественное соотношение в растворе определяется величиной рН среды. Изменение её значения приводит к смещению равновесия процесса диссоциации индикатора либо вправо, либо влево. В первом случае возрастает количество ионизированной формы индикатора, во втором – молекулярной или неионизированной формы. В соответствии с этим раствор приобретает окраску превалирующей формы индикатора.
Считается, что цвет одной формы индикатора доминирует, если её концентрация как минимум в 10 раз превышает концентрацию другой формы.
Таким образом, все кислотно-основные индикаторы изменяют окраску не скачкообразно, а плавно, т.е. в определённом интервале значений рН раствора, называемом интервалом перехода индикатора. Каждый индикатор имеет свой интервал перехода, который зависит от особенностей структуры его молекулы и её способности к ионизации. Значения интервалов перехода индикаторов, а также окраска той или иной его формы в растворе определяются опытным путём и приводятся в соответствующих справочниках в виде таблицы (табл. 21).
218
Таблица 21. Важнейшие кислотно-основные индикаторы
Индикатор |
Изменение окраски |
Интервал перехода |
|
|
индикатора |
|
|
(в единицах рН) |
|
|
|
Тропеолин ОО |
красно-жёлтая |
1,3-3,2 |
|
|
|
Метиловый оранжевый |
красная-оранжево-жёлтая |
3,1-4,0 |
|
|
|
Бромфеноловый синий |
жёлтая-синяя |
3,0-4,6 |
|
|
|
Метиловый красный |
красная-жёлтая |
4,2-6,2 |
|
|
|
Нейтральный красный |
красная-янтарно-жёлтая |
6,8-8,4 |
|
|
|
Фенолфталеин |
бесцветная-малиново- |
8,2-10,0 |
|
красная |
|
|
|
|
Тимолфталеин |
бесцветная - синяя |
9,3-10,5 |
|
|
|
Ализариновый красный |
фиолетовая - жёлтая |
10,0-12,0 |
Для большинства индикаторов разница в крайних значениях рН интервала перехода не превышает двух единиц, а границы самого интервала перехода определяются соотношением рКа±1 для кислотного индикатора или рКв±1 для основного индикатора (рКа = -lgKa, а рКв = - lgKв). Ка и Кв являются константой диссоциации, соответственно, индикатора-кислоты и индикатораоснования. Часто в общем виде их обозначают как Кинд.
Изменение окраски становится отчётливо видным уже при рН среды, равной рКинд.. Значение рН, при котором обычно заканчивается титрование, называют показателем титрования рТ. Индикатор для титрования подбирают таким образом, чтобы его интервал перехода окраски включал то значение рН, какое должен иметь раствор в точке эквивалентности (Подробнее о подборе индикатора см. ниже).
Причина изменения цвета индикатора заключается в том, что присоединение или отдача протонов Н+ его молекулами связаны с заменой в них одних хромофорных группировок атомов другими или с появлением новых хромофорных групп в результате внутримолекулярной перегруппировки.
Различают обратимые и необратимые индикаторы. Изме-
нение окраски первых (например, фенолфталеина) в ту или иную сторону при изменении рН среды может быть повторено многократно. Необратимые индикаторы подвергаются необратимым
219
химическим превращениям, при которых невозможен обратный переход одной хромофорной группировки атомов в другую.
Индикаторы, которые вводят в исследуемый раствор, называются внутренними, в отличие от внешних, реакцию с которыми проводят вне анализируемой смеси. В последнем случае одну или несколько капель анализируемого раствора помещают на бумажку, пропитанную индикатором, или смешивают их на белой фарфоровой пластинке с каплей индикатора.
Индикаторы, у которых окрашена только одна форма, называют одноцветными, в отличие от двухцветных, у которых обе формы имеют разные цвета. Индикаторы должны иметь интенсивную окраску, чтобы при незначительных концентрациях (порядка 10-4-10-5 моль/дм3) титруемый раствор был бы ими достаточно чётко окрашен.
Для превращения одной формы в другую индикаторы взаимодействуют с некоторой частью титранта или исследуемого вещества. Следовательно, количество использованного для анализа индикатора должно быть минимальным, чтобы существенно не влиять на результат анализа в ту или иную сторону.
Подбор индикаторов при кислотно-основном титровании
Правильный подбор индикатора имеет большое значение для титрования, т.к. от этого, в первую очередь, будет зависеть точность анализа и достоверность полученных результатов.
Для решения данной задачи строят кривые титрования, которые выражают зависимость изменения рН реакционной среды от объёма добавленного титранта. Необходимые для построения такого графика значения водородного показателя раствора можно рассчитать теоретически или определить экспериментально с помощью потенциометрии.
Типичная кривая титрования, полученная при взаимодействии между собой сильной кислоты (НСl) и щёлочи (NaOH), представлена на рис 54. Если двигаться вдоль кривой слева направо – проследим ход изменения рН при титровании кислоты щёлочью.
220
