
- •Министерство здравоохранения Республики Беларусь
- •Введение
- •Химический эквивалент. Основы титриметрического метода анализа
- •Техника выполнения лабораторных работ и техника безопасности
- •Первая помощь при ожогах и отравлениях *
- •Фундаментальные единицы измерения
- •Лабораторная посуда
- •Методические указания к занятию № 2
- •Химический эквивалент
- •Молярная масса химического эквивалента
- •Количество вещества эквивалента
- •Молярная концентрация химического эквивалента
- •Закон эквивалентов
- •1. Примеры расчета молярной концентрации эквивалента (нормальной концентрации)
- •2. Контролирующие задания
- •3. Выполнение индивидуальных заданий
- •Методические указания к занятию № 3
- •Титриметрический анализ. Общая характеристика метода
- •Требования, предъявляемые к реакциям, которые используют в титриметрии
- •Способы титрования
- •Способы приготовления рабочих растворов
- •Правила работы с мерной посудой при проведении аналитических измерений
- •Мерные колбы
- •Пипетки
- •Бюретки
- •Проведение титрования
- •Методические указания к занятию № 4
- •Кислотно-основное титрование. Общая характеристика метода
- •Определение точки эквивалентности в кислотно-основном титровании. Кислотно-основные индикаторы
- •Подбор индикаторов при кислотно-основном титровании
- •Кривые титрования многоосновных (полипротонных) кислот, многокислотных оснований и их солей
- •Применение кислотно-основного титрования
- •Расчет: вычисляют средний объем (V) кислоты, пошедшей на титрование, с точностью до сотых мл
- •Методические указания к занятию № 5
- •Редоксиметрия. Общая характеристика и классификация методов
- •Кривые титрования в редоксиметрии
- •Способы определения точки эквивалентности
- •Перманганатометрия
- •Иодометрия
- •Расчет: вычисляют средний объем (V) kMnO4,, пошедшей на титрование с точностью до сотых мл
- •Тесты к теме: Закон эквивалентов. Титриметрия
- •Учение о растворах Методические указания к занятию № 6
- •1. Задачи для самостоятельного решения
- •Методические указания к занятию № 7
- •1. Задачи для самостоятельного решения
- •Тесты к теме: Растворы. Электролитическая диссоциация. Буферные растворы
- •Методические указания к занятию № 8
- •Лабораторная работа № 2: Прочность и разрушение комплексных ионов.
- •Тесты к теме: Комплексные соединения
- •Химическая кинетика и катализ Методические указания к занятию № 9
- •1. Задачи для самостоятельного решения
- •Тесты к теме: Скорость химических реакций
- •Методические указания к занятию № 10
- •Тесты к теме: Катализ
- •Электрохимия Методические указания к занятию № 11
- •Методические указания к занятию № 12
- •Тесты к теме: Электрохимия. Электропроводимость растворов
- •Поверхностные явления Методические указания к занятию № 13
- •Методические указания к занятию № 14
- •Тесты к теме: Поверхностные явления. Адсорбция
- •Физическая химия дисперсных систем Методические указания к занятию № 15
- •Методические указания к занятию № 16
- •Тесты к теме: Дисперсные системы. Коллоидные растворы
- •Методические указания к занятию № 17
- •Тесты к теме: Растворы биополимеров
- •Химия биогенных элементов Методические указания к занятию № 18
- •Общая характеристика биогенных элементов.
- •Общая характеристика групп элементов общая характеристика элементов VII а группы Нахождение в природе
- •Строение атомов галогенов, их физические и химические свойства
- •Общая характеристика элементов
- •VI а группы Нахождение в природе
- •Строение атомов, химические и физические свойства халькогенов
- •Общая характеристика элементов
- •V a группы Нахождение в природе
- •Строение атомов, физические и химические свойства пниктогенов
- •Общая харатеристика элементов
- •Ivа группы Нахождение в природе
- •Физические и химические свойства элементов iva группы
- •Общая характеристика элементов II а группы Нахождение в природе
- •Общая характеристика элементов iiа группы на основании строения их атомов и положения в таблице д.И. Менделеева
- •Общая харатеристика элементов
- •I а группы Нахождение в природе
- •Общая характеристика щелочных металлов на основании строения их атомов и положения в таблице д.И. Менделеева
- •Физические свойства простых веществ
- •Общая харатеристика d-элементов
- •Качественные реакции на важнейшие биогенные элементы
- •1. Химическая термодинамика
- •2. Строение атома, химическая связь
- •Тесты по темам кср Химическая термодинамика
- •Строение атома. Химическая связь
- •Вопросы для подготовки к экзамену по общей химии для лечебного и педиатрического факультетов
- •Вопросы для подготовки к экзамену по общей химии для медико-психологического факультета
- •Содержание
- •VI а группы 287
- •V a группы 290
- •Ivа группы 296
- •I а группы 303
- •Подписано в печать 20 .07.2011.
Физические свойства простых веществ
Простые вещества, образованные элементами IА группы, являются типичными металлами и находятся при обычных условиях в твердом агрегатном состоянии. Они имеют серебристо-белый цвет (кроме цезия, которому характерна желтая окраска), обладают небольшой твердостью и температурой плавления. При переходе от лития к цезию эти свойства закономерно уменьшаются в связи с падением прочности металлической связи.
Все щелочные металлы (кроме лития) легко режутся ножом. Они являются легкими металлами, причем Li, Na и K имеют плотность меньше, чем у воды, и могут плавать на ее поверхности (таблица 10).
В химическом отношении щелочные металлы чрезвычайно реакционноспособны. Уже на воздухе они легко взаимодействуют с кислородом и парами воды (а литий еще и с азотом). Поэтому при хранении щелочных металлов необходимо исключить доступ к ним воздуха и влаги. С этой целью металлы помещают обычно под слой керосина (так как с алканами они не реагируют) и в герметически закрытые сосуды.
Общая харатеристика d-элементов
Элементы, атомы которых достраивают электронами d-подуровень предвнешнего слоя, называются переходными или d-элементами. Они занимают промежуточное положение между s-элементами (являющимися типичными металлами) и р-элементами (большинство из которых принадлежит к неметаллам). В связи с этим d-элементы в своих соединениях часто проявляют как металлические, так и неметаллические свойства.
В таблице Д.И. Менделеева d-элементы расположены в В группах и присутствуют только в больших периодах. Все они являются металлами и проявляют только положительную степень окисления. Но в отличие от металлов IА и IIА групп для d-элементов валентными являются не только электроны внешнего слоя, расположенные на s-подуровне, но и неспаренные электроны d-подуровня предвнешнего слоя. Поэтому они, как и р-элементы, в соединениях могут проявлять несколько значений валентности или степени окисления (в зависимости от числа электронов, принимающих участие в образовании связей). Причем с увеличением номера группы от I до VII количество возможных значений степени окисления атомов d-элементов в соединениях возрастает. Величина же высшей степени окисления при этом совпадает с номером группы, в которой d-элементы находятся в таблице Д.И. Менделеева.
Например, ванадий находится в VВ группе.
V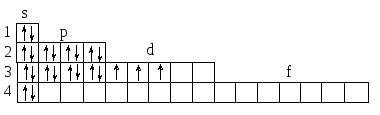
На внешнем слое его атома находятся 2 s-электрона, которые легко распариваются при возбуждении. За счет их V будет проявлять степень окисления +2, но у ванадия валентными будут и неспаренные электроны, расположенные на 3d-подуровне. С учетом их V может проявлять степень окисления +3, +4 и +5 (в зависимости от количества d-электронов, участвующих вместе с s-электронами в образовании связей).
Марганец находится в VIIB группе.
Mn
У его атомов на внешнем слое находятся 2 s-электрона. За счет их в возбужденном состоянии Mn может проявлять степень окисления +2. Кроме того, он может проявлять степень окисления +3, +4, +5, +6 и +7 (в зависимости от числа d-электронов, принимающих участие в образовании связей).
Элементы IВ группы, кроме степени окисления +1, могут проявлять и более высокие значения степени окисления: +2 (Cu) или +3 (Au). Из элементов VIIIВ группы максимальную степень окисления +8 могут проявлять только Fe, Ru и Os. У остальных она ниже, чем +8.
С повышением степени окисления d-элементов основные свойства их соединений уменьшаются, а кислотные свойства, наоборот, возрастают.
Соединения (оксиды, гидроксиды), в которых d-элементы находятся в своей низшей степени окисления (+1 или +2), как правило, обладают основными свойствами. Если степень окисления d-элемента в соединении (оксиде, гидроксиде) равна +3 или +4, то ему присущи амфотерные свойства. И, наконец, соединения, в которых d-элементы проявляют свою высшую степень окисления (от +5 и выше), обладают кислотными свойствами.
Чем выше степень окисления d-элемента в соединении, тем в большей мере присущи ему окислительные свойства.
Характерной особенностью d-элементов является их сильновыраженная способность к образованию комплексных ионов. Многие соединения d-элементов имеют характерную окраску и проявляют (наряду с простыми веществами) каталитическую активность.
Простые вещества, которые образуют d-элементы, обладают более высокими температурами плавления и имеют большую плотность, чем металлы, образованные s-элементами. Это объясняется тем, что в образовании металлической связи у d-элементов принимают участие не только электроны внешнего слоя (один или два), но и неспаренные электроны с d-подуровня предвнешнего слоя. В результате металлическая связь становится более прочной.
Металлы, образованные d-элементами, являются лучшими проводниками электрического тока, чем щелочные и щелочноземельные металлы. Особенно это характерно для тех металлов, атомы которых имеют только один внешний s-электрон и полузаполненный (Cr, Mo) или заполненный (Cu, Ag, Au) d-подуровень предвнешнего слоя.
