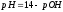- •Аналитикалық, физикалық және коллоидтық химия пәні бойынша
- •Астана 2010 мазмұны
- •1 Бөлім. Физикалық химия
- •2 Бөлім. Аналитикалық химия
- •3 Бөлім. Коллоидтық химия
- •Аналитикалық, физикалық және коллоидтық химия пәнін оқытудың әдістемелік нұсқаулары
- •Глоссарий
- •Зертханалық жұмыстарды орындаудың әдістемелік нұсқаулары
- •Химиялық зертханада жұмыс істегенде қолданатын сақтық шаралары
- •Реактивтерді пайдалану ережелері
- •Таразы және таразыда өлшеу
- •Химиялық ыдыстардың түрлерімен танысу
- •1. Оқытушы туралы мәлімет:
- •6.1 Дәрістік сабақтардың тізбесі
- •6.2 Зертханалық сабақтардың тізбесі
- •7. «Аналитикалық, физикалық және коллоидтық химия» пәні бойынша сөж орындау және тапсыру кестесі
- •8. Әдебиеттер тізімі
- •8.1. Негізгі әдебиет
- •8.2. Қосымша әдебиет
- •9. Курс саясаты
- •10. Білімді бағалау ақпараты
- •11. Бағалау саясаты Емтиханда білімін бағалау сызба нұсқасы
- •Студенттердің білімін бағалау шкаласы
- •Әдістемелік қамтамасыз етілу картасы
- •1 Бөлім. Физикалық химия Химиялық термодинамика және кинетика
- •Тақырып бойынша бақылау сұрақтары
- •1 Тәжірибе. Калий гидроксидінің сумен әрекеттесу реакциясының жылу эффектісі
- •3 Тәжірибе. Бейтараптану реакциясының жылу эффектісін анықтау
- •4 Тәжірибе. Химиялық реакция жылдамдығының әрекеттесуші заттардың концентрациясына тәуелділігі
- •5 Тәжірибе. Химиялық реакция жылдамдығының температураға тәуелділігі
- •6 Тәжірибе. Сутегі пероксидінің каталитикалық айырылуы
- •7 Тәжірибе. Қайтымды реакцияның химиялық тепе-теңдігінің ығысуы
- •Тақырып бойынша бақылау сұрақтары
- •1 Тәжірибе. Сыну көрсеткіші арқылы ерітіндінің концентрациясын анықтау.
- •Электролит ерітінділері
- •Тақырып бойынша бақылау сұрақтары
- •1 Тәжірибе. Криоскопиялық әдіс (Раульдің 3-ші заңы)
- •2 Тәжірибе. Эбулиоскопиялық әдіс (Раульдің 2-ші заңы)
- •3 Тәжірибе. Электролиттің диссоциациялануына еріткіштің әсері
- •4 Тәжірибе. Диссоциациялану процесінің тепе-теңдігінің ығысуы
- •5 Тәжірибе. Бейэлектролиттердің және электролиттердің электроөткізгіштіктері.
- •Судың иондық көбейтіндісі. Буферлік ерітінділер
- •Тақырып бойынша бақылау сұрақтары
- •4 Тәжірибе. Буферлік жүйелер
- •Электрохимиялық процестер
- •Салыстырмалы электродтар
- •Индикаторлық электродтар
- •Тақырып бойынша бақылау сұрақтары
- •1 Тәжірибе. Тотығу-тотықсыздану реакциялары
- •2 Тәжірибе. Даниэльдің электрохимиялық элементі
- •3 Тәжірибе. Концентрлі гальваникалық элементтер
- •Фотохимиялық реакциялар
- •Тақырып бойынша бақылау сұрақтар
- •1 Тәжірибе. Фотореакцияның жылдамдығына жарықтың әсері
- •2 Тәжірибе. Тионинның фотохимиялық тотықсыздануы
- •Беттік құбылыстар. Сорбция процестері
- •Тақырып бойынша бақылау сұрақтары
- •Хроматографиялық анализ
- •Тақырып бойынша бақылау сұрақтары
- •1 Тәжірибе. Топырақтың адсорбциялық және ионалмастырғыш қасиеттері
- •3 Тәжірибе. Темір, мыс және кобальт иондарын бағаналық хроматография және қағаздағы хроматография арқылы ажырату
- •5 Тәжірибе. Ав-17 анионитпен суды Сl- -ионынан тазарту
- •2 Бөлім. Аналитикалық химия Аналитикалық химия. Талдау әдістері
- •Тақырып бойынша бақылау сұрақтары
- •Сапалық анализ негіздері
- •Тақырып бойынша бақылау сұрақтары
- •1 Тәжірибе. Маңызды катиондарға арналған сапалық реакциялары
- •2 Тәжірибе. Маңызды аниондарға арналған сапалық реакциялары
- •1. Карбонат анионын анықтау
- •Тақырып бойынша бақылау сұрақтары
- •1,5368 Г құрамында 0,2262гбар
- •100Г құрамында х г бар
- •Титриметриялық анализ
- •Тақырып бойынша бақылау сұрақтары
- •1 Тәжірибе. Қышқылдық-негіздік титрлеу әдісі
- •2 Тәжірибесі. Комплекcонометриялық титрлеу
- •3 Тәжірибе. Редоксиметрия титрлеу әдісі
- •3 Бөлім. Коллоидтық химия Коллоидтық жүйелер
- •Тақырып бойынша бақылау сұрақтары
- •1. Тәжірибе. Коллоидтық жүйелерді алу
- •2. Тәжірибе. Коллоидтық бөлшектерінің заряд таңбасын анықтау
- •3. Тәжірибе. Пептизация құбылысы
- •4. Тәжірибе. Диализ құбылысы
- •5. Тәжірибе. Коллоидтық жүйелердің электр қасиеттері
- •Коллоидтық жүйелердің тұрақтылығы
- •Тақырып бойынша бақылау сұрақтары
- •1. Тәжірибе. Коллоидтық ерітінділердің коагуляция құбылысы
- •2. Тәжірибе. Ақуыз ерітіндісінің коагуляциясы
- •3. Тәжірибе. Өзара коагуляция құбылысы
- •Жоғары молекулалық қосылыстары, олардың ерітінділері
- •Тақырып бойынша бақылау сұрақтары
- •1. Тәжірибе. Жмқ алу жолдары
- •2 Тәжірибе. Жоғары молекулалық қосылыстардың ісінуі
- •3. Тәжірибе. Жоғары молекулалық қосылыстардың ерітінділерін алу
- •4. Тәжірибе. Тұзсыздану процесі
- •Студенттердің өзіндік жұмысына арналған есептер мен тапсырмалар
- •Берілген реакция теңдеуі бойынша келесі тапсырмаларды орындаңыз:
- •1 Аралық бақылауға дайындық сұрақтары
- •1 Аралық бақылаудың нұсқасы
- •2 Аралық бақылауға дайындық сұрақтары
- •2 Аралық бақылаудың нұсқасы
- •Емтиханға дайындық сұрақтары
- •Қорытынды бақылаудың тест сұрақтарының жиынтығы
- •Реферат дайындау әдістемелік нұсқасы
- •Реферат такырыптары
Судың иондық көбейтіндісі. Буферлік ерітінділер
Су, әлсіз электролит болғандықтан, иондарға өте аз ыдырайды.
Н2О Н+ + ОН-
Бұл процесс үшін әрекеттесуші массалар заңын қолданып жазуға болады

К – судың диссоциациялану константасы, 220С температурада судың константасы Кдисс=1,810-16 тең болады.
Судың концентрациясы тұрақты деп алып, оны диссоциациялану константасымен Кд біріктіруге болады
Кд Н2О = Н+ОН-
Н2О = 1000 / 18 = 55,56 моль/л
Кд Н2О = КН2О
КН2О = Н+ОН-
КН2О – судың иондық көбейтіндісі
КН2О = Н+ОН- = 1,810-16 55,56 = 10-14
Таза суда Н+ = ОН- = КН2О = 10-7 моль/л
Ерітінді ортасын Н+ концентрациясы арқылы көрсетуге болады:
Н+ = 10-7 - бейтарап орта
Н+ 10-7 - қышқыл орта
Н+ 10-7 - сілтілік орта
Есептеулерде дәрежесі теріс сандарды қолданбас үшін, есептеуге ыңғайлы болу үшін Н+ иондарының концентрациясы сутектік көрсеткіш рН арқылы көрсетеді.
Сутектік көрсеткіш деп теріс таңбамен алынған сутек иондары концентрациясының ондық логарифмі аталады.
рН = - lg Н+ және рОН = - lg ОН- рН + рОН = 14
рН = 7 бейтарап орта
рН 7 қышқылдық орта
рН 7 сілтілік орта
Практикада ерітінді ортасын индикаторлар көмегімен анықталады. Индикаторлар өздерінің түсін ерітінді ортасына байланысты өзгеретеді, оны төмендегі кестеден көруге болады. Мысалы, лакмус рН = 5 – қызыл түсті, рН = 8 – көк түсті
|
Индикатордың аталуы |
Ортаға байланысты индикатор түсінің өзгеруі | ||
|
Қышқылдық орта |
Сілтілік орта |
Бейтарап орта | |
|
Лакмус |
қызыл |
көк |
түссіз |
|
Фенолфталеин |
түссіз |
қызғылт |
түссіз |
|
Метилоранж |
қызыл |
сары |
қызыл |
Тұздардың гидролизі деп тұз иондары мен су иондары әрекеттескенде әлсіз электролит түзілуі нәтижесінде ерітіндідегі сутегі және гидроксид иондарының концентрацияларының өзгеру арқылы жүретін реакцияны айтады.
CH3COO- + HOH CH3COOH + OH- рН 7
Әр бір тұзды қышқыл мен негіз әрекеттескенде түзілген зат деп қарастыруға болады. Осыған байланысты гидролиздің төрт типін бөледі.
1) әлсіз қышқыл және күшті негізбен түзілген тұз гидролизі. Гидролиз анион бойныша жүреді.
CH3COO- + HOH CH3COOH + OH- рН 7
Ерітінді ортасы сілтілік болады.
Егер анион көп зарядты болса, онда гидролиз сатылап жүреді. Бірінші сатыда қышқыл тұз және негіз түзіледі.
SO32- + HOH HSO32- + OH-
Екінші сатыда түзілген қышқыл тұз әрі қарай гидролизденеді.
HSO32- + НОН OH- + H2SO3
2) әлсіз негіз және күшті қышқылмен түзілген тұз гидролизі. Гидролиз катион бойынша жүреді.
NH4+ + HOH NH4OH + H+ рН 7
Егер катион көп зарядты болса, гидролиз сатылап жүреді. Бірінші сатыда негіз тұз және қышқыл түзіледі.
Fe2+ + HOH (FeOH)+ + H+
Түзілген негіз тұз әрі қарай гидролизденеді.
(FeOH)+ + НОН Fe(OH)2 + H+
3) әлсіз негіз және әлсіз қышқылмен түзілген тұз гидролизі. Гидролиз катион және анион бойынша жүреді.
СH3COONH4 + H2O CH3COOH + NH4OH
СH3COO- + NH4+ + H2O CH3COOH + NH4OH
Ерітінді ортасы түзілген қышқылдың және негіздің күшіне байланысты.
Егер гидролиз нәтижесінде газ немесе тұнба түзілсе гидролиз қайтымсыз жүреді. Мысалы, Al2S3, Cr2S3
Al2S3 + 6H2O 2Al(OH)3 + 3H2S
4) күшті қышқылмен күшті негізден түзілген тұздар гидролизге ұшырамайды. Мысалы, NaCl, Na2SO4 т.б.
Гидролизді сандық жағынан гидролиздену дәрежесімен hг және гидролиздену константасымен Кг сипаттайды.
Гидролиз константасы.


Кг – гидролиз константасы
Кқыш – гидролиз нәтижесінде түзілген қышқылдың диссоциациялану константасы
Гидролиздену дәрежесі – гидролизденген молекулалар санының жалпы молекула санына қатынасы.

Гидролиздену дәрежесіне әсер ететін факторлар:
1) температура (температура жлоғарлаған сайын гидролиз жоғарлайды);
2) тұздың концентрациясы;
3) тұздың табиғаты (неғұрлым гидролиз нәтижесінде түзілген қышқылдың немесе негіздің күші әлсіз болса, соғұрлым гидролиз күшті жүреді)
Тұздар гидролизі – жалпы гидролиз ұғымының бір мысалы. Гидролиз деп әр түрлі заттардың сумен алмасып, ыдырауын айтады. Ағаш гидролизі арқылы этил спирті, глюкоза, фурфурол, скипидар, метил спирті т.б. заттар алынады. Тұз гидролизін суды тазарту үшін пайдаланады. Тірі организмде полисахаридтердің, белоктардың т.б. органикалық заттардың гидролизі үздіксіз жүріп жатады.
Буферлік ерітінділер – бұл жүйедегі тепе-теңдікті ығыстыратын шамамен мөлшердегі заттарды қосқанда, сондай-ақ сұйылтқанда немесе концентрлегенде аз өзгеретін, сутегі (гидроксид) иондарының концентрациясы тұрақты ерітінділер.
Буферлік ерітінділер құрамына байланысты бірнеше түрге бөлінеді:
1.
әлсіз ыдырайтын қышқыл + осы қышқылдың
күшті негізбен түзетін тұзы (бикарбонатты
буферлік жүйе
 )
)
2.
әлсіз негіз + осы негіздің күшті қышқылмен
түзетін тұзы (аммонийлі буферлік жүйе
 )
)
3.
( )
)
4.
амфотерлі ( )
)
Буферлік ерітінділердің негізгі қасиеттерінің қатарына, олардың буферлік сыйымдылығы және рН тұрақтылысы жатады.
Буферлік жүйенің рН-н белгілі бір шамаға дейін ғана бір қалыпта ұстау мүмкін. Ол ерітіндінің сыйымдылығымен анықталады. Осы буферлік сыйымдылық неғұрлым көп болса, ерітіндінің рН-ін өзгертпей, соғұрлым қышқыл мен негіздің эквиваленттік мөлшерлерін көп қосуға болады.
Буферлік сыйымдылық В 1л буферлік жүйенің сутектік көрсеткішін (рН) бір бірлікке өзгертуге қажет қышқыл мен негіздің моль санымен анықталады:

мұндағы с – 1л буферлі ерітіндіге қосылған қышқылдың немесе негіздің мөлшері;
рН1 – қышқыл немесе негіз қосылғанға дейінгі ерітіндінің рН-тың мәні;
рН2 – қышқыл немесе негіз қосылғанға кейінгі ерітіндінің рН-тың мәні
Буферлік әсер сақталынатын рН мәні аймағы буферлік әсер аймағы деп аталады, ол мына теңдікпен анықталады: рН=рК 1 мұнда рК= – lgKдисс
Қышқылдық буферлік жүйелердің рН көрсеткішін келесі формуламен есептеуге болады:


Негіздік буферлік жүйелердің рН көрсеткішін төмендегі формуламен есептеуге болады: