
- •Дмитрів а. М., Стецьків а. О., Леочко н. С. Колоїдна хімія Навчальний посібник
- •Івано-Франківськ – 2011
- •Передмова
- •Розділ 1 поверхневі явища
- •Теоретичні відомості
- •Сорбційні процеси і їх класифікація
- •Приклади розв’язування задач
- •Заняття №1
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Адсорбція спиртів на межі вода повітря Інформаційна частина
- •Поверхневий натяг води при різних температурах
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №2
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Адсорбція ацетатної кислоти на вугіллі Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 2 фізико-хімія дисперсних систем
- •Методи одержання колоїдно-дисперсних систем
- •Диспергаційні методи одержання дисперсних систем
- •Конденсаційні методи одержання колоїдних систем
- •Приклади розв’язування задач
- •Заняття №3
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Перелік питань, які виносяться на змістовий модуль 3
- •Лабораторна робота Одержання колоїдних розчинів Експериментальна частина.
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №4
- •Теоретична частина
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення розмірів частинок дисперсної фази методом турбідиметрії
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №5 Тема: Електричні властивості колоїдних розчинів. Будова колоїдної міцели. Електрокінетичні явища.
- •Теоретичні відомості
- •Завдання для самостійної позааудоторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Визначення електрокінетичного потенціалу ліофобного золю
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №6
- •Теоретична частина
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Питання для самоконтролю
- •Заняття №7
- •Теоретична частина
- •Колоїдні поверхнево-активні речовини
- •Завдання для самостійноїпозааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Самостійна робота на занятті
- •Лабораторна робота Седиментаційний аналіз суспензії
- •Експериментальна частина Реактиви та обладнання: порошок Al2o3; дистильована вода; циліндр на 100 см3; торсійні терези; скляна паличка. Методичні вказівки
- •Питання для самоконтролю
- •Розділ 3 високомолекулярні сполуки
- •Приклади розв’язування задач
- •Заняття №8
- •Завдання для самостійноїпозааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Питання для самоконтролю
- •Заняття №9
- •Завдання для самостійноїпозааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Обробка результатів
- •Питання для самоконтролю
- •Перелік питань, які виносяться на модуль 2 «колоїдна хімія»
- •Банк тестових завдань з колоїдної хімії
- •1. Поверхневі явища
- •2. Загальна характеристика дисперсних систем, методи Їх одержання та очистки
- •3. Молекулярно-кінетичні властивості дисперсних систем (броунівський рух, дифузія. Осмотичний тиск). Седиментація. Оптичні властивості дисперсних систем
- •4. Електрокінетичні властивості колоїдних систем. Будова міцели
- •5. Стійкість і коагуляція. Колоїдний захист
- •6. ГРубодисперсні системи: аерозолі, суспензії, емульсії, порошки, піни
- •7. Колоїдні пар. Ккм
- •8. Високомолекулярні речовини та їх розчини
- •Засоби контролю знань студентів
- •Значення найважливіших фундаментальних сталих
- •Перелік літератури Основна література
- •Додаткова література
- •76018, М. Івано-Франківськ, вул. Галицька, 2.
Завдання для самостійноїпозааудиторної роботи і. Засвоїти основний матеріал навчальної програми
Поняття про ВМС, класифікація та методи одержання.
Взаємозв’язок між особливостями будови і механічними властивостями полімерів.
Явища набрякання та розчинення ВМС, фактори, що впливають на ці процеси.
В’язкість розчинів ВМС (аномальна, структурна, приведена, характеристична). Рівняння Ньютона і Пуазейля та відхилення від них розчинів ВМС.
Іі. Дати письмові відповіді на контрольні запитання
Які чинники спричинюють висолювання ВМС? Напишіть ліотропний ряд Гофмейстера і поясніть його. За якого значення рН висолювальна дія електролітів буде максимальною?
Який процес лежить в основі висолювання? Чим відрізняється висолювання ВМС від коагуляції золів?
Ііі. Розв’язати задачі
1. Характеристична в'язкість розчину зразка полімеру А в розчиннику В при Т°С рівна [η] м3/моль. Розрахуйте середню молекулярну масу полімеру в даному розчиннику. Постійні рівняння Штаудінгера прийняти рівними K (моль/м3) і α.
|
№ п/п |
А |
В |
t, 0С |
[η] |
K∙10-5 |
α |
|
1 |
Ацетилцелюлоза |
Ацетон |
25 |
1,4∙10-3 |
4,30 |
0,82 |
|
2 |
Натуральний каучук |
Толуен |
20 |
4,41∙10-3 |
5,14 |
0,67 |
|
3 |
Нейлон |
Мурашина кислота |
25 |
1,12∙10-3 |
15,90 |
0,72 |
2. Зразок гуми об'ємом 3,15∙10-3 м3 через 5 годин витримування у тетрахлоретані при 298 К набрав об'єму 5,31∙10-3 м3. Обчисліть ступінь набрякання полімеру.
Самостійна робота на занятті
1. Виконання тестових завдань.
2. Виконання лабораторної роботи.
3. Обговорення результатів досліджень, оформлення та захист протоколу (залік лабораторної роботи).
ЛАБОРАТОРНА РОБОТА
Високомолекулярні речовини та їх розчини
Експериментальна частина
Реактиви та обладнання:штативи з пробірками (20); міліметровий папір; мірні піпетки на 100 см3; розчин СН3СООН (0,1 моль/дм3); розчин СН3СООNa (0,1 моль/дм3); желатин (порошок) або натуральний каучук; розчин КCl (0,01 моль/дм3); розчин NaCl (0,01 моль/дм3); розчин NaІ (1 моль/дм3); розчин Na2SO4(1 моль/дм3); розчин NaCl (1 моль/дм3); розчин цукру (10 %); розчин сечовини (10 %); бензен (або бензин).
Методичні вказівки
Дослід 1. Одержання розчинів ВМС.
1.1. Одержання розчину крохмалю. Розтерти в ступці 0,5 г крохмалю з 10 см3води перенести в колбочку, додати ще 40 см3води і при постійному перемішуванні нагрівати на водяній ванні до кипіння. При цьому крохмаль розчиняється повністю, утворюючи розчин ВМС.
1.2. Приготування розчину желатини. Всипати в колбочку 1,5 г порошку желатини і залити 25 см3води. Після набрякання желатини (через 15 хв) долити ще 25 см3води і нагріти на водяній ванні до 50 С0поки вся желатина не розчиниться.
1.3. Приготування розчину каучуку. 0,5 г дрібно порізаних кусочків каучуку залити в колбочці 50 см3бензену (або бензину) і залишити на 1 год. Аналогічний дослід провести з вулканізованим каучуком (гумою). Порівняти результати і пояснити відмінність у розчинності в двох випадках.
Дослід 2. Вивчення властивостей розчинів ВМС.
2.1. Визначення ізоелектричної точки желатини, набрякання желатини від рН розчину. Готують у пробірках наступні розчини:
Таблиця 3.1
|
№ про-бір- ки |
Склад буферної суміші |
рН суміші |
Висота желатини, а1, см |
Висота желатини після набрякання, а2, см |
Зміна висоти, а2 – а1, см |
Ступінь набрякання,
| |
|
СН3СООNa (0,1 моль/дм3) |
СН3СООН (0,1 моль/дм3) | ||||||
|
1 |
9 |
1 |
|
|
|
|
|
|
2 |
7 |
3 |
|
|
|
|
|
|
3 |
5 |
5 |
|
|
|
|
|
|
4 |
3 |
7 |
|
|
|
|
|
|
5 |
1 |
9 |
|
|
|
|
|
|
6 |
Н2О дист. вода (10 см3) |
|
|
|
|
| |
У пробірки вносять добре розтертий порошок желатини, щоб висота порошку желатини в пробірці становила а1 = 0,5 см і додають однакові об’єми розчинів вказаних в таблиці. Обережно струшують і залишають на 40 хв. Потім за допомогою смужки фільтрувального паперу визначають висоту гелю а2 і вичислюють ступінь набрякання:
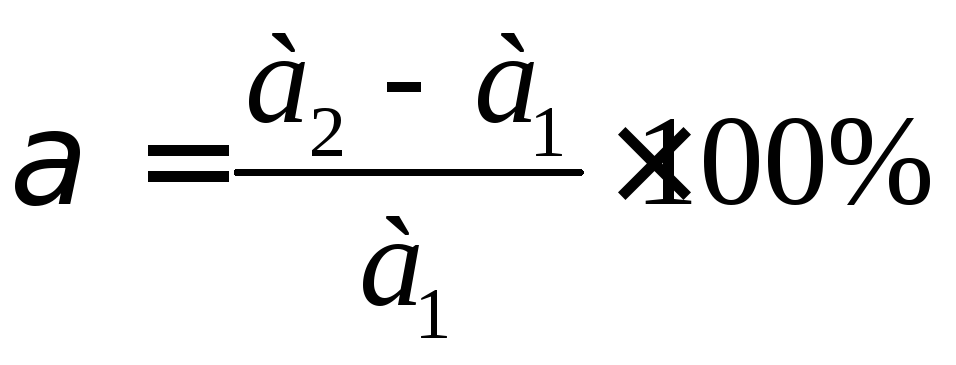 ,
,
де а1, а2 – висота осаду до і після набрякання.
За отриманими експериментальними даними необхідно:
обчислити ступінь набрякання желатини;
побудувати графік α = f(рН);
визначити ізоелектричну точку.
2.2. Дослідження залежності ступеня набрякання желатини від рН середовища. У пронумеровані колби (1–5) вносять по 10 см3 буферних розчинів з різним значенням рН. Зважують 5 кусочків сухої желатини (записують масу кожного) і поміщають в колби. Залишають на 1 год. Потім зливають розчин і вибирають желатин. Обережно висушують її, поклавши желатин на фільтрувальний папір і знов зважують. Дані експерименту і розрахунків заносять у таблицю:
Таблиця 3.2
Вплив рН розчину на набрякання желатини
|
рН розчину |
Маса желатину |
Маса розчинника поглиненого желатиною | ||
|
до набрякання, m0, г |
після набрякання, m, г |
даною наважкою, Δm =m –m0, г |
одним грамом (ступінь набрякання) i =Δm/m0 | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
На міліметровому папері побудувати графік залежності ступеня набрякання желатини від рН, відкладаючи рН на осі абсцис. Визначити ізоелектричну точку. Зробити висновки з отриманих даних.
Дослід 3. Вивчення впливу електролітів та неелектролітів на ступінь набрякання желатини. У вісім вузьких пробірок однакового діаметра поміщають до висоти 0,5 см порошок сухого желатини і додають однаковий об’єм (5,0 см3) розчинів, вказаних в таблиці. Через 60 хв визначають висоту осаду за допомогою міліметрового паперу.
Таблиця 3.3
|
№ пробір. |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Розчин |
Н2О |
NaOH |
HCl |
NaI |
Na2SO4 |
NaCl |
цукор |
сечовина |
|
Концентрація |
– |
0,1 Н |
0,1 Н |
1 Н |
1 Н |
1 Н |
10 % |
10 % |
|
Висота осаду до набрякання в мм |
5,0 |
5,0 |
5,0 |
5,0 |
5,0 |
5,0 |
5,0 |
5,0 |
|
Висота осаду після набрякання в мм |
|
|
|
|
|
|
|
|
|
Ступінь набрякання в % |
|
|
|
|
|
|
|
|
За отриманими експериментальними даними визначають ступінь набрякання для різних розчинів електролітів та неелектролітів.
