
- •Державний вищий навчальний заклад
- •Лабораторна робота 3
- •2.1. У результаті проведення лабораторного заняття студенти повинні:
- •2.2. Самостійна робота на занятті:
- •3. Реактиви і обладнання:
- •4. Теоретичні відомості
- •5.Зміст роботи
- •5.1.2. Дія загальних реагентів
- •5.1.3.1. Окиснення хром (ііі)-катіона до Сr(vі) різними окисниками.
- •5.1.3.2. Співосадження хром (ііі) і цинк (іі) гідроксидів
- •5.1.4.1. Дія алізарину
- •5.1.4.3. Гідроліз гідроксоалюмінатів (ііі) у присутності амоній хлориду
- •5.1.5.4. Реакція на Zn 2 -іон сухим способом
- •5.1.6. Характерні реакції на Sn(іі)-катіон
- •5.1.7. Характерні реакції на Sn(іv)-катіон
- •5.1.8. Характерні реакції на As(іii)-катіон (Обережно! Сполуки Арсену отруйні)
- •5.1.9. Характерні реакції на As(V)-катіон
- •Контрольні запитання
- •Література
5.1.3.2. Співосадження хром (ііі) і цинк (іі) гідроксидів
Явище співосадження хром (ІІІ) і цинк (ІІ) гідроксидів у формі нерозчинного в надлишку NаОН хром(ІІІ) діоксоцинкату Сr2(ZnO2)3 використовують в аналізі. Якщо при доливанні до аналізованого розчину надлишку лугу осад повністю не розчиняється, то це вказує на присутність у розчині хром (ІІІ)- і цинк (ІІ)-катіонів.
Виконання реакції
У пробірці змішують по 3 краплі розчинів хром хлориду і цинк сульфату та доливають 2М розчину NаОН в надлишку. Утворені гідроксиди неповністю розчиняються.
5.1.3.3.
Комплексон ЕДТА (Na2H2Y∙2H2O
– динатрієва
сіль етилендіамінтетраоцтової кислоти,
відома також за назвою "трилон Б",
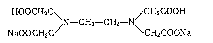 )
з хром
(ІІІ)-катіоном у слабокислому середовищі
утворює координаційну сполуку фіолетового
кольору СrY-
,
де Y-
–
аніон ЕДТА.
)
з хром
(ІІІ)-катіоном у слабокислому середовищі
утворює координаційну сполуку фіолетового
кольору СrY-
,
де Y-
–
аніон ЕДТА.
Виконання реакції
До 3-4 крапель розчину солі хром (ІІІ)-катіона додати 3-5 крапель 30%-го розчину оцтової кислоти, 10-15 крапель розчину ЕДТА, перемішати, перевірити рН розчину (має бути 4-5) і нагріти на водяній бані до появи фіолетового забарвлення. При рН=7-9 фіолетовий СrY- переходить у синій Сr(ОН)Y2-.
5.1.4. Характерні реакції на іони Al 3+
5.1.4.1. Дія алізарину
Алізарин (1,2-діоксіантрахінон) у лужному середовищі утворює з катіоном А13+ хелатну сіль яскраво-червоного кольору ("алюмінієвий лак"):
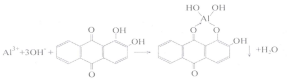
Виконання реакції
До 3-5 крапель розчину солі алюмінію додати 2М розчин натрій гідроксиду до сильнолужної реакції (перевірити індикаторним папірцем). Якщо при цьому утворився осад, відокремити його центрифугуванням. До прозорого розчину додати 2-3 краплини 0,2% розчину алізарину. При появі фіолетового забарвлення додати краплинами розчин ацетатної кислоти до зникнення забарвлення. У присутності алюмінію, залежно від концентрації, випадає червоний осад або розчин забарвлюється в червоний колір.
5.1.4.2. Реакція на Al 3+-іон сухим способом
Розбавлений розчин Со(NО3)2 дає з йонами Аl3+ при прожарюванні кобальт (II) алюмінат синього кольору (“тенарова синь”):
4Аl(ОН)3↓ +2Со(NО3)2 → 2Со(АlО2)2 + 4NО2 + О2↑ +6Н2О.
Виконання реакції
Реакція виконується сухим методом. На смужку фільтрувального паперу нанести 2-3 краплі розчину Аl2(SО4)3 і 2-3 краплі розчину амоніаку, підсушити над електроплиткою, змочити розчином солі Со(NО3)2 і спалити. Якщо присутній Al 3+-катіон, то зола, яка утворюється при спалюванні смужки, має темно-синє забарвлення.
5.1.4.3. Гідроліз гідроксоалюмінатів (ііі) у присутності амоній хлориду
При дії на іони Al3+ надлишку NaОН утворюється безбарвний розчинний натрій гідроксоалюмінат NaAl(OH)4. Гідроксоалюмінати гідролізують за нагрівання лише у присутності катіонів слабких основ. Натрій гідроксоалюмінат NaAl(OH)4 руйнується при додаванні сухого NH4Cl (для зв’язування іонів ОН -). При цьому утворюється білий аморфний осад Al(OH)3:
Al(NO3 )3+4NaOH = NaAl(OH)4 +3NaNO3
NaAl(OH)4 + NH4Cl = Al(OH)3↓ + NaCl + NH4OH
Реакція гідролізу алюмінату є характерною і використовується для виявлення алюмінію. Виявленню алюмінію за допомогою цих реакцій заважають іони Cr 3+ та Sn (II,IV).
Виконання реакцій
До 6 крапель розчину солі алюмінію у пробірці додати краплями розчин NaOH до повного розчинення утвореного пластівчастого осаду. Розчин поділити на 2 частини. До однієї частини додати кілька кристаликів NH4Cl і 2-3 мл води, до другої частини додати лише стільки ж води. Обидві пробірки нагріти і кип’ятити. У першій пробірці утворюється осад. Пробірку нагрівають до тих пір, поки не перестане виділятися амоніак.
5.1.4.4. Реакція з натрій ацетатом CH3COONa. Натрій ацетат з розчинами солей алюмінію на холоді не утворює осаду, бо алюміній ацетат розчиняється у воді. Проте як сіль слабкої основи і слабкої кислоти він гідролізує і при кип’ятінні розчину утворює білий пластівчастий осад основної солі:
AlCl3 + 3CH3COONa → Al(CH3COO)3 + 3NaCl
Al(CH3COO)3 + H2O → AlOH(CH3COO)2↓ + CH3COOH.
5.1.4.5. Реакція з натрій тіосульфатом Na2S2O3. Натрій тіосульфат при кип’ятінні з розчином солі алюмінію утворює осад алюміній гідроксиду і виділяє вільну сірку:
2Al3+ + 3S2O32– + 3H2O → 2Al(OH)3↓+ 3S↑ +3SO2.
(Аналогічно відбувається реакція з іонами Cr3+).
5.1.5. Характерні реакції на іони Zn2+
5.1.5.1. Гідроген сульфід Н2S утворює з іонами Zn 2+ білий драглистий осад цинк сульфіду ZnS:
ZnSO4+ H2S = ZnS↓ + 2H2SO4
Реакцію проводять у середовищі оцтової кислоти, оскільки осад розчинний у сильних мінеральних кислотах, але нерозчинний в оцтовій кислоті. До реакційної суміші додають також ацетат натрію СН3COONa:
ZnSO4 + H2S + 2CH3COONa =ZnS↓ + 2NaSO4+ 2CH3COOH
Виконання реакції
У пробірку набрати 1-2 краплі розчину солі цинку, додати краплину розчину СН3COONa та 1-2 краплини свіжоприготовленого розчину Н2S. Утворюється каламуть білого кольору. Перевірити відношення осаду до мінеральних та оцтової кислот.
Осад ZnS утворюється і в лужному середовищі, у цьому випадку як реагент використовують сульфід натрію Na2S. У цих умовах катіони ІV аналітичної групи не заважають виявленню цинку.
5.1.5.2. Калій гексаціаноферат К4[Fe(CN)6 ] утворює з іонами Zn2+ білий осад ("каламуть") подвійної солі К2Zn[Fe(CN)6 ]2:
3Zn2+ +2К+ +2[Fе(СN)б;]4– → Zn3К2[Fе(СN)6]2↓.
Реакцію проводять у нейтральному або оцтовокислому середовищі. Осад розчинний у лугах, NH4OH і нерозчинний у розведених мінеральних кислотах.
Виконання реакції
До 5-6 крапель розчину солі цинку додати такий же об’єм розчину К4[Fе(СN)6]. Утворений осад розділити на 2 пробірки: у першу прилити декілька крапель мінеральної кислоти, а в другу – декілька крапель розчину лугу.
Реакція може використовуватися для виявлення Zn 2+-йонів у присутності Аl3+-йонів, які з цим реагентом не утворюють осад.
5.1.5.3. Дитизон (дифенілтіокарбазон, Н2Dz), розчинений у СН3Сl або CCl4, в лужному середовищі з Zn 2+-катіоном утворює внутрішньокомплексну сполуку червоного кольору.
Виконання реакції
У пробірку набрати 2 краплі водного розчину солі цинку, додати краплями 2М розчину NaОН до повного розчинення утвореного осаду і 1-2 краплі розчину дитизону. Вміст пробірки перемішують струшуванням впродовж 0,5-1 хв. Краплі розчину дитизону і водного лужного розчину забарвлюються в однаковий червоний колір.
Реакція може використовуватися для виявлення Zn 2+-йонів у присутності інших катіонів IVгрупи.
