
Бх лекция Belki-2012
.pdf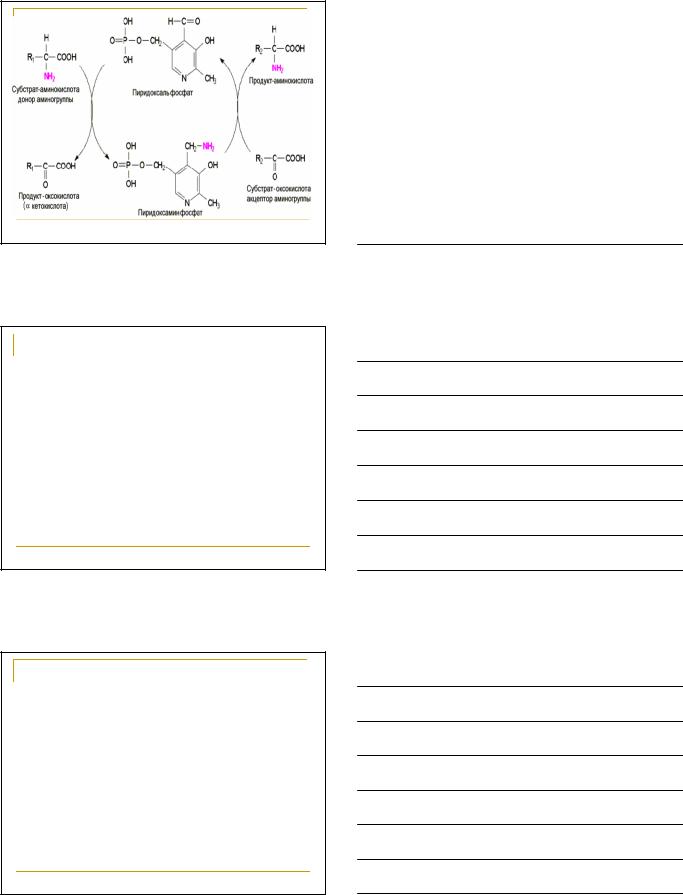
КафедрабиохимииГомГМУ,2012 |
16.03.2012 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16.03.2012 |
92 |
Это главный путь удаления азота у аминокислот.
Выделены трансаминазы, катализирующие переаминирование большинства аминокислот.
После поступления пищевых аминокислот из воротной вены, например, значительная часть их в печени подвергается переаминированию.
16.03.2012 |
93 |
Исключением являются аминокислоты с разветвленным углеводородным радикалом, для которых в печени нет соответствующих трансаминаз, о чем говорит более высокая концентрация таких аминокислот в крови, оттекающей от печени по сравнению с концентрацией в крови воротной вены.
16.03.2012 |
94 |
31

КафедрабиохимииГомГМУ,2012 |
16.03.2012 |
Непрямое окислительноедезаминирование.
Почти все природные а/к сначала реагируют с α-КГК в реакциитрансаминирования с образованиемГЛУ и соответствующей кетокислоты,а образовавшаяся ГЛУзатем подвергается прямому окислительному дезаминированию поддействием ГДГ.
Т.е. все а/к подвергаются дезаминированию непрямымпутем, только через стадию образованияГЛУ
16.03.2012 |
95 |
Любая а/к |
α- КГК |
NADH2 |
+NН3 |
Любая кето |
ГЛУ |
NADH+ |
+ HOH |
кислота
ГДГ
трансаминазы
16.03.2012 |
96 |
Поскольку обе эти реакции – и трансаминирование, и прямое дезаминированиеобратимы, то создаются условия для синтеза новой заменимой а/к, если в организме есть соответствующие кетокислоты. Организм человека не наделен способностью синтезировать углеводные скелеты( т.е. α- кетокислоты) незаменимых а/к. Этой способностью обладают растения.
16.03.2012 |
97 |
32

КафедрабиохимииГомГМУ,2012 |
16.03.2012 |
Т.о. можно сказать, что путь синтеза заменимых а/к в организмеэто непрямое окислительное дезаминирование, которое запущеное в обратном направлении.
Этот путь называется трансаминированием.
16.03.2012 |
98 |
|
|
|
|
16.03.2012 |
99 |
|
|
|
|
|
|
|
|
|
|
16.03.2012 |
100 |
|
|
|
|
|
|
33
КафедрабиохимииГомГМУ,2012 |
16.03.2012 |
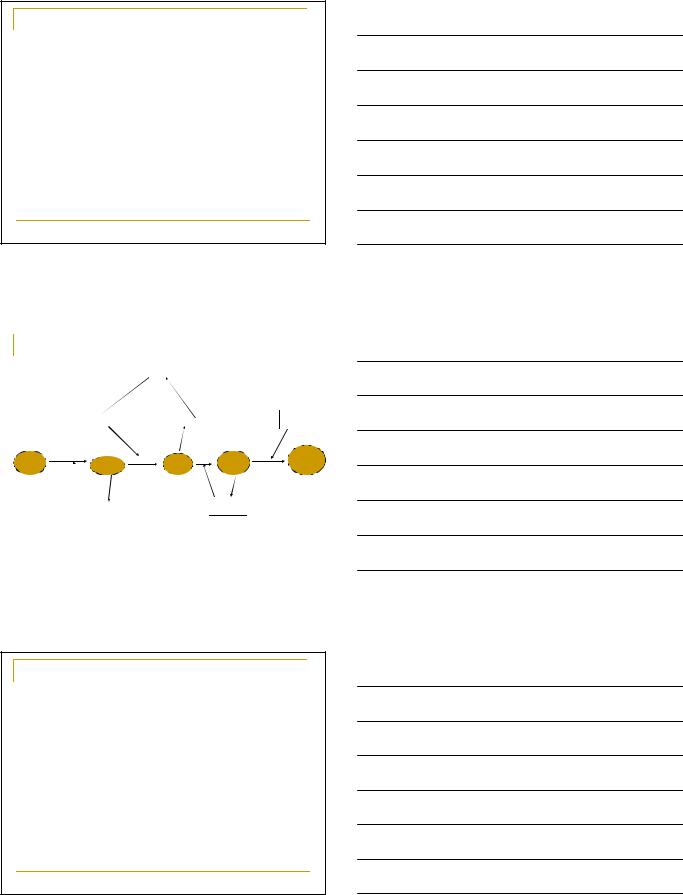
Существует еще один механизм непрямого дезаминирования α- аминокислот, при котором ГЛУ, АСП, и АМФ выполняют роль системы переноса NН2- группы:
16.03.2012 |
101 |
|
|
О2--- малат |
|
|
|
|
|
|
|
|
ЩУК |
фумарат |
|
|
|
|
|
|
|
|
|
Н2О |
|
|
||
|
|
|
|
|
|
|
||
|
АК |
ГЛУ |
АСП |
АМФ |
|
NH3 |
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
ИМФ |
|
|
|
|
|
|
α- кетоглу |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16.03.2012 |
|
|
|
102 |
|
|
|
|
|
|
|
|
|
|
|
|
ГДГ выполняет следующие функции:
1.Осуществляет связь обмена а/к с ЦТК через α-кето-ГЛУ 2.Обеспечивает связывание аммиака
3.Обеспечивает синтез всех заменимых аминокислот 4.Обеспечивает перекачку протонов с
NADH на NADFH ( пластическая функция при синтезе а/к)
16.03.2012 |
103 |
34

КафедрабиохимииГомГМУ,2012 |
16.03.2012 |
|
|
|
|
NH4+ |
аминокислота |
пируват |
глутамат |
оксалоацетат |
|
кетокислота |
АЛА |
КГ |
АСП |
мочевина |
трансаминаза |
АЛТ |
АСТ |
|
|
16.03.2012 |
104 |
Трансаминирование-это главный путь удаления азота у аминокислот. Выделены трансаминазы, катализирующие переаминирование большинства аминокислот.
После поступления пищевых аминокислот из воротной вены, например, значительная часть их в печени подвергается переаминированию.
16.03.2012 |
105 |
Аланиновая трансаминаза АЛТ
АЛА + -КГ Пируват + ГЛУ
Аспарагиновая трансаминаза АСТ АСП + -КГ 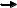 Оксалоацетат + ГЛУ
Оксалоацетат + ГЛУ
|
Тирозиновая трансаминаза ТТ |
|
ТИР |
+ -КГ |
р-ОН фенил + ГЛУ |
|
|
пируват |
16.03.2012 |
|
106 |
35

КафедрабиохимииГомГМУ,2012 |
16.03.2012 |
Исключением являются аминокислоты с разветвленным углеводородным радикалом, для которых в печени нет соответствующих трансаминаз, о чем говорит более высокая концентрация таких аминокислот в крови, оттекающей от печени по сравнению с концентрацией в крови воротной вены.
16.03.2012 |
107 |
Клиническое значение определения активности трансаминаз
Для клинических целей наибольшее значение имеют 2 трансаминазыАсАТ и АлАТ
|
АсАТ |
АСП + α-КГК |
ЩУК+ ГЛУ |
|
АлАТ |
АЛА + α-КГК |
ПВК + ГЛУ |
|
|
16.03.2012 |
108 |
В сыворотке крови здоровых людей активность этих трансаминаз в среднем составляет-15-20 Е., по сравнению с десятками и сотнями тысяч единиц во внутренних органах и тканях. Поэтому органические поражения при остых и хронических заболеваниях сопровождаются деструкцией клеток, и выходу АсАТ и АлАТ из очага поражения в кровь.
16.03.2012 |
109 |
36

КафедрабиохимииГомГМУ,2012 |
16.03.2012 |
Наибольшая активность АлАТ приходится на печень, а АсАТ на миокард. Поэтому определение активности АлАТ в сыворотке крови используется для ранней диагностики болезней Боткина, а также для ее безжелтушных форм.
Высокая активность фермента поддерживается 10-15 дней, затем постепенно снижается.
16.03.2012 |
110 |
Определениеактивности АсАТ используется для ранней диагностики ИМ. Причем увеличение активности наблюдается через 24-36 час. И снижаетсяна 3-7 сутки, при благоприятном исходе.
Для дифференциальной диагностики гепатита
иИМ используется коэффициент де Ритиса: К= АсАТ/ АлАТ = 1,5-2,0 (в норме)
Если К>2 – ИМ. Если К < 0,6 – болезнь Боткина.
16.03.2012 |
111 |
Токсичность аммиака и пути его обезвреживания
1.Аммиакв тканях протонирован
(NH4+), т.е., он связываетН+ и тем самым изменяетКЩБ (кислотнощелочной баланс).
2.Аммиаквступает в реакции «насильственного» аминирования с α- кетокислотами,извлекая их из ЦТК , и вызывает тем самым низкоэнергетический сдвиг, или состояние близкоек гипоксии.
16.03.2012 |
112 |
37

КафедрабиохимииГомГМУ,2012 |
16.03.2012 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16.03.2012 |
113 |
3.Аммиак изменяетсоотношение ионов натрия и калия т.к. близок к ним по физикохимическимсвойствам:следовательно нарушается водноэлектролитный баланс.
4.Аммиак обладаетнейротоксичностьюизменяет мембранныйпотенциал нейронов, способенингибировать биосинтез белка ( аминируетбелки)
16.03.2012 |
114 |
Пути обезвреживания аммиака
В плазме крови содержится25-40 мМ/л аммиака.
При накоплении последнего возникает тремор,нечленораздельная речь,иногда смерть.
Аммиак– этиологический фактор печеночной недостаточности.
16.03.2012 |
115 |
38

КафедрабиохимииГомГМУ,2012 |
16.03.2012 |
1.Восстановительное аминирование
α-КГК + NH3+ NADFH2---------- Глутамат
ГДГ
ЦТК
16.03.2012 |
116 |
2.Образование амидов дикарбоновых кислот
Т.к. ГЛН и АСН выделяются с мочой, то они являются транспортной формой аммиака.
ГЛН -- АЛА-- по воротной вене в печень, где аминогруппа идет на синтез мочевины, а углеродные скелеты на ГНГ. Это глюкозоаланиновый цикл между печенью и мышцами ( цикл Кори)
16.03.2012 117
|
|
|
|
16.03.2012 |
118 |
|
|
|
|
|
|
39

КафедрабиохимииГомГМУ,2012 |
16.03.2012 |
3.Основная массаГЛН и АСН захватывается почками,где под действием глутаминазы от них отщепляется аммиак.
Далее он реагирует с Н+ и дает ион аммония, который экскретируется с мочой.
При ацидозе экскреция катиона аммонияс мочой увеличивается,т.к. ацидоз активирует глутаминазу и она активно отщепляет аммиакот ГЛН. Последний,в свою очередь активно захватывает протоны и тем самым ликвидирует ацидоз.
16.03.2012 |
119 |
Кроме того при ацидозе происходит потеря Na+ и K+ смочой. Это приводит к снижению осмотического давления и обезвоживанию тканей. Но этот процесс не развивается благодаря образованию NH4+ , который обладает близкими физикохим. cвойствами с Na+ и K+,замещая их он предотвращает нарушение водноэлектролитного баланса. Это аммониогенез
16.03.2012 |
120 |
4. Способ удаления аммиакаамидирование свободных карбоксильных групп белков (амидированные формы белков устойчивы к протеазам)
16.03.2012 |
121 |
40
