
- •X. Елементи фізики твердого тіла §137. Поняття про квантові статистики Бозе-Ейнштейна і Фермі-Дірака
- •§138. Розподіл електронів провідності в металі за енергіями. Енергія Фермі
- •§139. Енергетичні зони в кристалах
- •§140. Розподіл електронів по енергетичних зонах. Валентна зона і зона провідності. Метали, діелектрики і напівпровідники
- •§141. Власна провідність напівпровідників
- •§142. Домішкова провідність напівпровідників
- •Тучкевич володимир максимович
- •Гольдман олександр генріхович
- •Пулюй іван павлович
- •Гольдман олександр генріхович
- •Білий михайло ульянович
- •Шпак марат терентійович
- •Пекар соломон ісаакович
§139. Енергетичні зони в кристалах
Використовуючи рівняння Шредінгера, можна розглянути задачу про кристал, наприклад, знайти можливі значення енергії, а також відповідні енергетичні стани електронів та ядер.
Рівняння Шредінгера для кристала має такий вигляд:
![]()
![]()
![]()
![]() .
.
Тут
![]() ,
,![]() ,...
– координати електронів, а
,...
– координати електронів, а![]() ,
,![]() ,...
- координати ядер,m- маса електрона,
,...
- координати ядер,m- маса електрона,![]() – маса ядрак-го атома. Перший і
другий доданки відповідають сумарній
кінетичній енергії всіх електронів та
ядер. Наступні доданки описують
кулонівську взаємодію між електронами,
взаємодію між ядрами і взаємодію між
електронам та ядрами. У правій частині
рівнянняE– повна енергія
системи, яка складається із
енергії
електронів і ядер.
– маса ядрак-го атома. Перший і
другий доданки відповідають сумарній
кінетичній енергії всіх електронів та
ядер. Наступні доданки описують
кулонівську взаємодію між електронами,
взаємодію між ядрами і взаємодію між
електронам та ядрами. У правій частині
рівнянняE– повна енергія
системи, яка складається із
енергії
електронів і ядер.
Але як у класичній, так і у квантовій механіці відсутні методи точного розв’язання динамічної задачі для системи багатьох частинок. Тому цю задачу розв’язують наближено.
Спочатку використовується адіабатичне наближення. Квантово-механічна система поділяється на важкі і легкі частинки – ядра і електрони. Оскільки маси і швидкості цих частинок значно відрізняються, можна вважати, що рух електронів відбувається в полі нерухомих ядер, а ядра, що повільно рухаються, знаходяться в усередненому полі всіх електронів. Вважаючи, що ядра у вузлах кристалічної ґратки нерухомі, рух електронів розглядається в постійному періодичному полі ядер.
Адіабатичне наближення математично приводить до того, що рівняння Шредінгера розпадається на два окремі рівняння, перше з яких описує рух легких електронів, а друге – важких ядер. В результаті рівняння для електронів має вигляд:
![]()
![]() .
.
Тут хвильова функція залежить лише від координат електронів:
![]() ,
,
а
![]() – енергія взаємодії електронів з
періодичним полем ядер.
– енергія взаємодії електронів з
періодичним полем ядер.
Далі використовується наближення самоузгодженого поля. Взаємодія даного електрона з усіма іншими електронами замінюється дією на нього стаціонарного електричного поля, що має періодичність кристалічної ґратки. Це поле створюється усередненим в просторі зарядом усіх інших електронів. За допомогою цього поля система взаємодіючих електронів замінюється системою не взаємодіючих електронів, внаслідок чого багатоелектронна задача зводиться до одноелектронної.
Рівняння Шредінгера в цьому випадку набирає вигляду:
![]() ,
,
де
![]() – потенціальна енергія одного
електрона
не лише в періодичному полі ядер ґратки,
але і в усередненому періодичному
полі всіх інших електронів.
– потенціальна енергія одного
електрона
не лише в періодичному полі ядер ґратки,
але і в усередненому періодичному
полі всіх інших електронів.
І снують
два наближені методи розв’язання цього
рівняння. В першому з них передбачається,
що кінетична енергія електрона набагато
більша за його потенціальну енергію
(метод слабкого зв’язку).
Електрон є майже вільний, силове поле
ґратки чинить на нього лише незначну
збурюючи дію. Слабкому зв’язку
відповідають валентні електрони. В
результаті розв’язування рівняння
Шредінгера виявляється, що спектр
можливих значень енергій валентних
електронів розпадається на ряд
дозволених і заборонених зон, які
чергуються. В межах дозволених зон
енергія змінюється квазінеперервно.
Значення енергії, що належать забороненим
зонам, не можуть реалізуватися (рис. 353).
снують
два наближені методи розв’язання цього
рівняння. В першому з них передбачається,
що кінетична енергія електрона набагато
більша за його потенціальну енергію
(метод слабкого зв’язку).
Електрон є майже вільний, силове поле
ґратки чинить на нього лише незначну
збурюючи дію. Слабкому зв’язку
відповідають валентні електрони. В
результаті розв’язування рівняння
Шредінгера виявляється, що спектр
можливих значень енергій валентних
електронів розпадається на ряд
дозволених і заборонених зон, які
чергуються. В межах дозволених зон
енергія змінюється квазінеперервно.
Значення енергії, що належать забороненим
зонам, не можуть реалізуватися (рис. 353).
У другому наближенні, навпаки, вважається, що електрон сильно зв’язаний зі своїм атомом (ядром) і не може вільно переміщатися по ґратці (метод сильного зв’язку). Якісно задача розв’язується так. Із окремих атомів будується кристалічна ґратка і з’ясовується, як впливають сусідні атоми кристала на поведінку електрона в окремому атомі, тобто досліджується вплив поля сусідніх атомів на енергетичні рівні.
Р
Na Na


Кожний з них зображений у вигляді потенціальної ями, всередині якої проведені рівні 1s, 2s, 2p, 3s,….Рівні1s, 2sі2pу натрію укомплектовані повністю, рівень3s– наполовину; рівні, які розміщені вище3s, – вільні.
Ізольовані атоми
відокремлені один від одного потенціальними
бар’єрами завтовшки
![]() ,
деa– стала ґратки. Потенціальний
бар’єр перешкоджає вільному переходу
електронів від одного атома до іншого.
,
деa– стала ґратки. Потенціальний
бар’єр перешкоджає вільному переходу
електронів від одного атома до іншого.
У верхній частині
рис. 354 показана якісна картина
розподілу густини ймовірності
![]() виявлення електронів на даній відстані
від ядра. Максимуми кривих відповідають
приблизно положенню борівських орбіт
для цих електронів.
виявлення електронів на даній відстані
від ядра. Максимуми кривих відповідають
приблизно положенню борівських орбіт
для цих електронів.

Тепер будемо повільно зближати атоми ґратки, не порушуючи її симетрію. На рис. 355 наведена картина, яка відповідає такому зближенню. З цього рисунка видно, що потенціальні криві, які відділяють сусідні атоми (показані пунктиром), частково накладаються одна на одну і дають результуючі криві, які проходять нижче нульового рівня 00(на рисунку вони показані суцільними лініями).
Отже, зближення
атомів зменшує товщину потенціального
бар’єру до значення порядку aі
зменшує його висоту. Для електронів
рівня1s висота бар’єра стає![]() ,
для електронів2s -
,
для електронів2s -![]() ,
для електронів2p-
,
для електронів2p-![]() .
Для електронів рівня3s висота
бар’єра виявляється нижчою від
початкового положення рівня3sв атомі натрію. Тому валентні електрони
цього рівня отримують можливість
практично без перешкод переходити від
одного атома до
.
Для електронів рівня3s висота
бар’єра виявляється нижчою від
початкового положення рівня3sв атомі натрію. Тому валентні електрони
цього рівня отримують можливість
практично без перешкод переходити від
одного атома до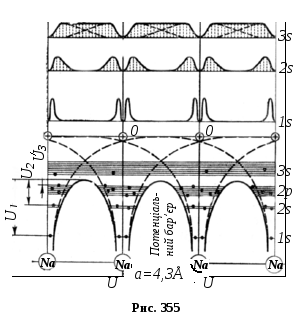 іншого. Про це свідчить і характер
електронних хмар валентних електронів,
вони перекриваються настільки сильно,
що створюють результуючу хмару
рівномірної густини (рис. 355).
Це відповідає стану
повної їх
колективізації в ґратці. Такі колективні
електрони називаються вільними, а їх
сукупність – електронним газом.
іншого. Про це свідчить і характер
електронних хмар валентних електронів,
вони перекриваються настільки сильно,
що створюють результуючу хмару
рівномірної густини (рис. 355).
Це відповідає стану
повної їх
колективізації в ґратці. Такі колективні
електрони називаються вільними, а їх
сукупність – електронним газом.
Внаслідок різкого зменшення товщини і висоти потенціального бар’єра при зближенні атомів можливість переміщення в кристалі отримують не лише валентні електрони, але й електрони, що розміщені на інших рівнях атомів. Переміщення відбувається шляхом тунельного переходу електронів через бар’єри, що відокремлюють сусідні атоми.
Якщо колективні електрони зберігають досить сильний зв’язок з атомами, то їх потенціальну енергію можна подати у такому вигляді:
![]() ,
,
де
![]() – потенціальна енергія електрона в
ізольованому атомі. Для кристала вона
є періодичною функцією з періодом, що
дорівнює параметру ґратки, оскільки
енергія електрона повторюється при
переході його від одного атома до іншого
(рис. 355);
– потенціальна енергія електрона в
ізольованому атомі. Для кристала вона
є періодичною функцією з періодом, що
дорівнює параметру ґратки, оскільки
енергія електрона повторюється при
переході його від одного атома до іншого
(рис. 355);![]() - доданок, який враховує вплив сусідніх
атомів на цю енергію.
- доданок, який враховує вплив сусідніх
атомів на цю енергію.
Якщо знехтувати
доданком
![]() ,
тобто розглядати так зване нульове
наближення, то в ролі хвильової функції
і енергії електрона в кристалі слід
взяти хвильову функцію
,
тобто розглядати так зване нульове
наближення, то в ролі хвильової функції
і енергії електрона в кристалі слід
взяти хвильову функцію![]() і енергію
і енергію![]() електрона в ізольованому атомі.
електрона в ізольованому атомі.
Відмінність між
кристалом й атомом полягає в цьому
випадку в наступному: в той час як в
ізольованому атомі даний енергетичний
рівень
![]() є єдиним, в кристалі, що складається зNатомів, він повторюєтьсяNразів. Кожний рівень ізольованого атома
в кристалі стаєN –
кратно виродженим.
є єдиним, в кристалі, що складається зNатомів, він повторюєтьсяNразів. Кожний рівень ізольованого атома
в кристалі стаєN –
кратно виродженим.
Якщо врахувати
доданок
![]() в потенціальній енергії, то у міру
зближення ізольованих атомів і утворення
з них ґратки кожний атом потрапляє у
поле своїх сусідів, яке зростає. Така
взаємодія приводить до зняття виродження.
Тому кожний енергетичний рівень, не
вироджений в ізольованому атомі,
розщеплюється наNблизько розміщених один від одного
підрівнів, що утворюють енергетичну
зону. На кожному підрівні згідно з
принципом Паулі може знаходитись не
більше двох електронів з антипаралельними
спінами.
в потенціальній енергії, то у міру
зближення ізольованих атомів і утворення
з них ґратки кожний атом потрапляє у
поле своїх сусідів, яке зростає. Така
взаємодія приводить до зняття виродження.
Тому кожний енергетичний рівень, не
вироджений в ізольованому атомі,
розщеплюється наNблизько розміщених один від одного
підрівнів, що утворюють енергетичну
зону. На кожному підрівні згідно з
принципом Паулі може знаходитись не
більше двох електронів з антипаралельними
спінами.
Якщо енергетичний
рівень мав в атомі
![]() – кратне виродження, то відповідна
йому енергетична зона буде складатися
із
– кратне виродження, то відповідна
йому енергетична зона буде складатися
із![]() підрівнів. Так,s-рівень даєs-
зону, яка складається ізNпідрівнів і здатна вмістити2Nелектронів;р-рівень даєр-зону, яка складається із3Nпідрівнів і здатна вмістити6Nелектронів, і т.д.
підрівнів. Так,s-рівень даєs-
зону, яка складається ізNпідрівнів і здатна вмістити2Nелектронів;р-рівень даєр-зону, яка складається із3Nпідрівнів і здатна вмістити6Nелектронів, і т.д.
Найбільший вплив поле ґратки чинить на зовнішні валентні електрони атомів. Тому стани цих електронів в кристалі відчувають найбільші зміни, а енергетичні зони, які утворені з енергетичних рівнів цих електронів, виявляються найбільш широкими.
Внутрішні ж електрони, які сильно зв’язані з ядром, відчувають лише незначні збурення від інших атомів, внаслідок чого їх енергетичні рівні в кристалі залишаються практично такими ж вузькими, як і в ізольованих атомах. На рис. 356наведена схематична картина утворення енергетичних зон в кристалі із дискретних атомних рівнів.
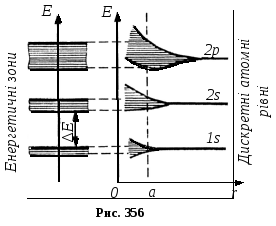
Отже, кожному енергетичному рівню ізольованого атома в кристалі відповідає зона дозволених рівнів: рівню 1s– зона1s,рівню2p– зона2pі т.д..
Зони дозволених енергій розділені областями заборонених енергій – забороненими зонами. Із збільшенням енергій електрона в атомі ширина дозволених зон збільшується, ширина заборонених – зменшується.
Дозволені енергетичні зони в твердому тілі можуть бути різним чином заповнені електронами. У граничних випадках вони можуть бути цілком заповнені або цілком вільні. Електрони в твердих тілах можуть переходити з однієї дозволеної зони в іншу. Для переходу електрона з нижньої зони в сусідню верхню зону необхідно затратити енергію, що дорівнює ширині забороненої зони, яка розміщена між ними.
Для внутрішніх
переходів електронів в межах зони
необхідна дуже мала
енергія, тому,
що відстані між сусідніми енергетичними
рівнями в зоні дорівнює приблизно
![]() .
Наприклад, для цього достатньо енергії
.
Наприклад, для цього достатньо енергії![]() ,
що отримує електрон в металі під дією
електричного поля на довжині вільного
пробігу при звичайних різницях
потенціалів. Під дією спеціального
збудження електронам може бути надана
енергія, достатня як для внутрішньозонних,
так і для міжзонних переходів.
,
що отримує електрон в металі під дією
електричного поля на довжині вільного
пробігу при звичайних різницях
потенціалів. Під дією спеціального
збудження електронам може бути надана
енергія, достатня як для внутрішньозонних,
так і для міжзонних переходів.
