
Zadachi2
.pdf
pH12 10
8
6
4
2
Vт.е. = 15 мл
0
5 |
10 |
15 |
20 |
|
|
|
V(HCl), мл |
Зкривої потенціометричного титрування визначаємо об’єм титранту (HCl)
вточці еквівалентності Vт.е. = 15 мл. Тоді за законом еквівалентів молярна
концентрація метиламіну становитиме Cос |
|
Скис Vкис |
|
0,223315 |
0,1675 М . |
|
|
||||
|
|
Vос |
20 |
|
|
Вміст в г/мл становить:
Сг/мл=(Смоль/л∙∙M(СН3NH3OH)):1000=(0,1675∙49):1000=0,00821 г/мл.
Задача 3. Наважку мідного сплаву 1,0545 г розчинили в HNO3 і після видалення нітрат-йонів випарюванням з H2SO4 розчинили у воді. Об’єм розчину довели до 100,0 мл. До 10,0 мл цього розчину додали надлишок KІ і виділений І2 відтитрували потенціометрично розчином натрій тіосульфату з титром за купрумом Т(Na2S2O3/Cu) = 0,01434 г/мл. Побудуйте криву титрування в координатах Е–V та розрахуйте масову частку (%) купруму у сплаві за результатами титрування:
V(Na2S2O3), мл |
1,00 |
1,20 |
1,30 |
1,40 |
1,45 |
1,48 |
1,50 |
1,52 |
1,55 |
1,60 |
|
|
|
|
|
|
|
|
|
|
|
Е, мВ |
475 |
445 |
424 |
405 |
382 |
305 |
232 |
186 |
162 |
153 |
|
|
|
|
|
|
|
|
|
|
|
Розв’язок. Розчинення купруму відбувається за реакціями:
Cu + 4 HNO3(к) →Cu(NO3)2 + 2 NO2↑+ 2 H2O;
Cu(NO3)2 + H2SO4 → CuSO4 + 2 HNO3 .
Додавання до розчину солі купруму надлишку KІ приводить до виділення
йоду:
2 Сu2+ + 4 I-(надл.) → 2 СuI↓+I2,
який титрують розчином натрій тіосульфату за реакцією:
I2 + 2 S2O32- → 2 I- + S4O62- .
21
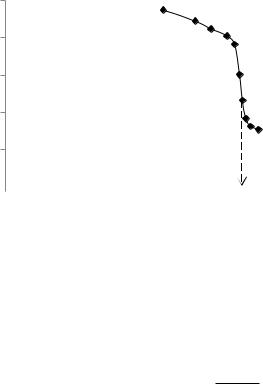
500
E, мВ
400
300
200
100
0 |
|
|
Vт.е. = 1,5 мл |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
0,5 |
1 |
1,5 |
2 |
|
|
|
|
V, мл |
З кривої потенціометричного титрування визначаємо об’єм титранту в точці еквівалентності (Vт.е.)=1,50 мл. Маса купруму в 10 мл досліджуваного розчину: m(Cu)10 = T∙Vт.е = 0,01434∙1,50= 0,02151 г.
В 100 мл цього розчину буде знаходитись: m(Cu)100=m(Cu)10∙(Vк/Vп) = =0,02151∙(100/10)=0,2151 г.
Масова частка купруму в зразку: 1,05450,2151 100% 20,40 % .
Задача 4. Аналізовану суміш NaOH і NH4OH помістили у мірну колбу об’ємом 250 мл і довели водою до риски. При кондуктометричному титруванні 50,0 мл цього розчину 0,0200 М розчином НСl отримали дані:
|
V(HCl), мл |
2,0 |
4,0 |
6,0 |
|
8,0 |
10,0 |
12,0 |
14,0 |
|
16,0 |
18,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
w, См |
|
3,26 |
2,77 |
2,31 |
|
2,12 |
2,18 |
2,23 |
2,29 |
|
2,63 |
3,37 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Побудуйте |
криву |
титрування, |
встановіть точки |
еквівалентності та |
||||||||||
обчисліть масу (г) NaOH i NH4OH у вихідній суміші.
Розв’язок. У суміші сильної та слабкої основи до початку титрування концентрація ОН- фактично дорівнює концентрації сильної основи, тому що дисоціація слабкої основи практично повністю пригнічена. Тому спочатку титрант буде реагувати з сильною основою, а кількість (моль) титранту в першій точці еквівалентності буде дорівнювати кількості моль сильної основи:
1 кислоти= сильної основи.
Продовження титрування після першої точки еквівалентності призведе до титрування слабкої основи, а кількість (моль) титранту, який витрачається між першою і другою точками еквівалентності, дорівнює кількості (моль) слабкої основи:
1 кислоти- 2 кислоти= слабкої основи.
22

|
æ, См 4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,5 |
|
|
|
|
|
NaOH |
|
|
|
|
|
NaOH + NH4OH |
|
|
||||||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
V1т.е. = 7 мл |
|
|
|
|
|
V2т.е. = 15 мл |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V(HCl), мл |
||
З кривої кондуктометричного титрування визначаємо об’єми титранту в |
|||||||||||||||||||||
точках еквівалентності (V1т.е.)=7,0 мл, (V2т.е.)=15,0 мл. Тоді маса натрій |
|||||||||||||||||||||
гідроксиду визначається за формулою: |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
m(NaOH) C(HCl) V1т.е. M(NaOH) Vк |
0,0200 7,0 40 250 |
0,028 г , |
|
|
|
||||||||||||||||
|
|
|
|
1000 Vп |
|
|
|
|
1000 50 |
|
|
|
|
|
|
|
|
||||
а маса амоній гідроксиду відповідно: |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
m(NH |
OH) C(HCl) (V2т.е. V1т.е. ) М (NH 4OH) Vк |
|
0,0200 (15,0 7,0) 35 250 0,028 г. |
||||||||||||||||||
4 |
|
|
|
1000 |
Vп |
|
|
|
|
|
|
|
|
1000 50 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Задача 5. Для визначення концентрації HCN використовують залежність |
|||||||||||||||||||||
питомої електричної провідності æх від вмісту кислоти в розчині: |
|
|
|
||||||||||||||||||
|
C(HCN), моль/л |
|
0,004 |
0,008 |
0,012 |
0,016 |
0,020 |
|
|
|
|||||||||||
|
æ ·104, Ом–1·см–1 |
1,0 |
|
3,0 |
|
5,4 |
|
|
8,3 |
13,2 |
|
|
|
||||||||
Побудуйте калібрувальний графік у координатах -lgæx–(-lgC(HCN)) і |
|||||||||||||||||||||
визначте концентрацію ціанідної кислоти, якщо питома електрична провідність |
|||||||||||||||||||||
її розчину cтановить 2,5∙10-4 Ом–1∙см–1. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Розв’язок. Для побудови калібрувального графіка необхідно провести ряд |
|||||||||||||||||||||
розрахунків: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C(HCN), моль/л |
0,004 |
0,008 |
0,012 |
0,016 |
0,020 |
|
|
|
|
|
|
-lg(C(HCN)) |
2,40 |
2,10 |
1,92 |
1,80 |
1,70 |
|
|
|
|
|
|
æ ·104, Ом–1·см–1 |
1,0 |
3,0 |
5,4 |
8,3 |
13,2 |
|
|
|
|
|
|
-lg æ |
4,00 |
3,52 |
3,27 |
3,08 |
2,88 |
|
|
|
|
|
|
23

4,2 |
|
|
|
|
|
-lg æ 4 |
|
|
|
|
|
3,8 |
-lg æx = 3,6 |
|
|
|
|
|
|
|
|
|
|
3,6 |
|
|
|
|
|
3,4 |
|
|
|
|
|
3,2 |
|
|
|
|
|
3 |
|
|
-lgC |
= 2,14 |
|
2,8 |
|
|
|
||
|
|
|
|
|
|
1,6 |
1,8 |
2 |
2,2 |
2,4 |
2,6 |
|
|
|
|
|
-lgC |
З калібрувального графіка визначаємо концентрацію ціанідної кислоти |
|||||
при -lgæх= -lg( 2,5·10-4)=3,6. |
|
|
|
|
|
Якщо lgCx= -2,14, то концентрація ціанідної кислоти в розчині становить |
|||||
С(HCN)=10-2,14=7,24·10-3 моль/л. |
|
|
|
|
|
Задача 6. Наважку сполуки 0,6200 г, яка містить церій (IV), розчинили у |
|||||
мірній колбі об'ємом 50,0 мл. З неї відібрали пробу об’ємом 10 мл і церій (IV) |
|||||
кулонометрично відтитрували до |
церію (IІІ) при силі струму 150 мА протягом |
||||
3 хв 45 с. Визначте масову частку (%) церію в досліджуваній сполуці. |
|||||
Розв’язок. Відновлення церію (IV) на катоді відбувається за схемою: |
|||||
|
Се4+ + 1 е → Се3+. |
|
|
||
Маса церію в 10 мл розчину визначається за законом Фарадея: |
|
||||
m |
I t M (Ce) |
|
150 10 |
3 225140 |
0,0490 г, |
де 225 с =3 хв 45 с. |
|
F n |
96500 1 |
||||||
|
|
|
|
||||
Тоді в 50 мл розчину знаходилося mCe 0,0490 1050 0,245 г , а масова частка церію у сполуці відповідно становила:
Ce |
mСе |
100% |
0,245 |
100% 39,52 % . |
|
mнав |
0,620 |
||||
|
|
|
Задача 7. При визначенні ізотопу урану наважку 0,0321 г солі U4+ кулонометрично відтитрували до U6+ при силі струму 100 мА протягом 4 хв 20 с. Визначте молярну масу еквіваленту ізотопу урану.
Розв’язок. Переводимо час в с: 4 хв 20 с = 260 с.
Титрування відбувається за схемою:
U4+-2 е → U6+.
Оскільки m |
I t M (U ) |
, то M (U ) |
m F n |
|
0,0321 96500 2 |
238 г/моль-екв. |
|
F n |
I t |
100 10 3 260 |
|||||
|
|
|
|
24
Задачі для самостійного розв’язування
1. Побудуйте криву потенціометричного титрування в координатах рН V та визначте концентрацію НСООН (моль/л) та (г/л), якщо при титруванні 20,0 мл розчину цієї кислоти 0,2000 М розчином NаОН отримали такі результати:
V (NaOH), мл |
10,0 |
18,0 |
19,0 |
19,5 |
19,9 |
20,0 |
20,1 |
20,5 |
|
|
|
|
|
|
|
|
|
рН |
4,76 |
5,71 |
6,04 |
6,35 |
7,06 |
8,79 |
10,52 |
11,22 |
|
|
|
|
|
|
|
|
|
Вкажіть електроди, з якими можна провести це титрування.
2. У стандартних розчинах солі маґнію з концентрацією С(Mg2+) виміряли електродні потенціали маґнійселективного електрода:
С (Mg2+), моль/л |
0,1 |
0,01 |
0,001 |
0,0001 |
Е, мВ |
60 |
85 |
107 |
131 |
|
|
|
|
|
Наважку зразка масою 0,4312 г, який містить маґній, розчинили у воді й об’єм довели до 150,0 мл. Потім виміряли потенціал маґнійселективного електроду в одержаному розчині Ех = 120 мВ. Побудуйте калібрувальний графік
укоординатах Е рС(Mg2+) та обчисліть масову частку (%) маґнію в зразку.
3.Наважку сплаву 0,7500 г розчинили в HNO3 і після видалення нітратйонів випарюванням з H2SO4 розчинили у воді. Об’єм розчину довели до 250,0 мл. До 20,0 мл цього розчину додали надлишок KІ і виділений І2 відтитрували потенціометрично розчином натрій тіосульфату з титром за купрумом
Т(Na2S2O3/Cu) = 0,01664 г/мл. Побудуйте криву титрування в координатах Е–V та розрахуйте масову частку (%) купруму у сплаві за даними:
V (Na2S2O3), мл |
1,50 |
1,90 |
2,00 |
2,05 |
2,08 |
2,10 |
2,12 |
2,15 |
2,20 |
|
|
|
|
|
|
|
|
|
|
Е, мВ |
475 |
445 |
424 |
405 |
382 |
305 |
232 |
186 |
162 |
|
|
|
|
|
|
|
|
|
|
Запишіть рівняння реакцій і вкажіть електроди для цього титрування.
4. При титруванні 40,0 мл розчину, що містить NaOH і NH4OH, 0,0500 М розчином НСl отримали дані:
V (HCl), мл |
0 |
1,0 |
2,0 |
4,0 |
5,0 |
6,0 |
7,0 |
|
8,0 |
9,0 |
10,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
w·103, Ом–1 |
5,68 |
4,46 |
3,20 |
3,00 |
3,84 |
4,68 |
5,50 |
7,00 |
10,80 |
14,55 |
|
|
Побудуйте |
криву титрування, |
встановіть |
точки |
еквівалентності та |
||||||||
обчисліть концентрації (г/л) NaOH i NH4OH в розчині.
5. Для визначення концентрації HF використали залежність питомої електропровідності æ від вмісту кислоти в розчині:
C (HF), моль/л |
0,004 |
0,007 |
0,015 |
0,030 |
0,060 |
0,121 |
|
|
|
|
|
|
|
æ ·104, Ом–1·см–1 |
2,5 |
3,8 |
5,0 |
8,0 |
12,3 |
21,0 |
Побудуйте калібрувальний графік в координатах –lgæ – (-lgC(HF)) і визначте концентрацію фторидної кислоти, якщо її питома електропровідність cтановить 9,2∙10-4 Ом–1∙см–1.
25
6. Аналізовану суміш HCl i CH3COOH помістили в мірну колбу місткістю 50,0 мл і довели водою до риски. При титруванні 10,0 мл цього розчину 0,1000 М розчином NaOH отримали такі результати:
V (NaOH), мл |
7,0 |
8,0 |
9,0 |
10,0 |
11,0 |
12,0 |
13,0 |
14,0 |
15,0 |
16,0 |
|
|
|
|
|
|
|
|
|
|
|
w, См |
2,66 |
2,39 |
2,12 |
2,02 |
2,04 |
2,08 |
2,11 |
2,25 |
2,60 |
2,96 |
|
|
|
|
|
|
|
|
|
|
|
Побудуйте криву титрування і визначте масу HCl i CH3COOH (г) у суміші. 7. Титрування 20,0 мл розчину, який містить уран (ІV), провели кулонометричним методом за допомогою йонів церію (IV), які електроґенеруються з церію (ІІІ) у сульфатнокислому середовищі при постійній силі струму 0,50 мА. Точку еквівалентності визначили кондуктометрично, час електролізу становив
180с. Визначте вміст урану в мг/л. Запишіть електродні та хімічну реакції.
8.Наважку алюмінію 3,0000 г розчинили і домішки йонів Fe3+ кулонометрично відтитрували йонами Sn2+, електроґенерованими з Sn4+ при постійній силі струму 3,0 мА. Точку еквівалентності зафіксували потенціометрично. Електроліз тривав 10 хв 30 с. Визначте масову частку феруму в алюмінії (%). Запишіть рівняння електродних і хімічної реакцій.
9.При потенціометричному титруванні 20,0 мл розчину NaCl 0,2000 M розчином AgNO3 отримали такі результати:
V (AgNO3), мл |
15,0 |
20,0 |
22,0 |
24,0 |
24,5 |
24,9 |
25,0 |
25,1 |
25,5 |
|
|
|
|
|
|
|
|
|
|
Е, мВ |
307 |
328 |
342 |
370 |
388 |
428 |
517 |
606 |
646 |
|
|
|
|
|
|
|
|
|
|
Побудуйте криву титрування і визначте концентрацію NaCl у розчині (г/л).
10.Для визначення H2C2O4 у розчині 20,0 мл досліджуваного розчину кулонометрично відтитрували йонами MnO4 , електроґенерованими з Mn2+ в сульфатнокислому середовищі. Процес тривав 15 хв при постійній силі струму
25,0 мА. Розрахуйте концентрацію H2C2O4 в мг/л. Запишіть електродні та хімічну реакції.
11.З наважки 0,0800 г руди уран перевели в U4+ і відтитрували розчином калій перманґанату з концентрацією С(1/5 KMnO4) = 0,0100 Н:
|
2MnO4 + 5U4+ |
+ 2H2O 2Mn2+ + 5UO22+ + 4H+ |
|
|
|||||
Розрахуйте масову частку урану в руді (%) за результатами |
|||||||||
потенціометричного титрування: |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
V (KMnO4), мл |
2,0 |
10,0 |
18,0 |
19,8 |
20,0 |
20,2 |
22,0 |
|
|
|
|
|
|
|
|
|
|
|
|
Е, мВ |
301 |
330 |
359 |
389 |
1173 |
1486 |
1498 |
|
|
|
|
|
|
|
|
|
|
|
12. Побудуйте криву титрування і визначте концентрацію KCN в розчині (г/л), якщо при потенціометричному титруванні 20,0 мл розчину KCN 0,1000 М розчином AgNO3 отримали такі результати:
V (AgNO3), мл |
5,0 |
7,0 |
9,0 |
9,5 |
9,9 |
10,0 |
10,1 |
10,5 |
11,0 |
|
|
|
|
|
|
|
|
|
|
Е, мВ |
-252 |
-216 |
-153 |
-116 |
24 |
376 |
340 |
340 |
340 |
|
|
|
|
|
|
|
|
|
|
26
ПОЛЯРОГРАФІЧНІ МЕТОДИ АНАЛІЗУ
Питання для самостійної підготовки
1.Суть полярографічних методів аналізу.
2.Принципова схему полярографа та призначення його основних частин.
3.Основні ділянки вольтамперної кривої та спосіб її запису.
4.Залишковий струм, його складові та зміна з ростом потенціалу електроду.
5.Потенціал виділення, потенціал півхвилі. Фактори, що впливають на значення потенціалу півхвилі.
6.Якісний полярографічного аналізу.
7.Стадії електродного процесу, що супроводжують відновлення (окиснення) електродноактивної речовини.
8.Рівняння полярографічної хвилі та його використання в проведенні якісного аналізу.
9.Граничний дифузійний струм та його зв’язок з концентрацією деполяризатора в розчині.
10.Причини виникнення міґраційного струму та способи його усунення.
11.Характеристики фонового розчину. Призначення та його вплив на вольтамперну криву.
12.Поляризація електроду. Види поляризації та причини її виникнення.
13.Причини виникнення максимумів на полярограмах та способи їх усунення.
14.Рівняння Ільковича, характеристика величин, що в нього входять. Практичне застосування цього рівняння.
15.Кількісний полярографічний аналіз методом одного стандартного розчину.
16.Кількісний полярографічний аналіз методом калібрувального графіку.
17. Кількісний полярографічний аналіз методом добавок.
18. Суть розрахункового методу визначення концентрації та його недоліки.
20.Приклади полярографічних визначень в неорганічній та органічній хімії.
21.Галузі застосування, переваги та недоліки полярографії.
22.Суть амперометричного титрування.
23.Схема пристрою для проведення амперометричного титрування.
24.Приклади хімічних реакцій амперометричного титрування.
25.Вигляд кривих амперометричного титрування. Чим пояснюється зміна сили струму на окремих ділянках?
26.Рівняння реакцій в розчині та на електродах при амперометричному титруванні плюмбуму та барію розчином калій дихромату.
27.Області застосування, переваги та недоліки методу амперометричного титрування.
27

28.Будова крапельного ртутного електроду його переваги та недоліки, можливості використання твердих електродів.
29.Процеси, які відбуваються на неполяризованих електродах. Які електроди не поляризуються?
30.Суть і переваги нових варіантів полярографії: а) зміннострумової; б) амальгамної з нагромадженням; в) осцилографічної?
Приклади розв’язування типових задач
Задача 1. Для визначення домішки цинку у стоматологічному сплаві його наважку 0,0785 г розчинили, перенесли у мірну колбу місткістю 500 мл і довели об'єм розчину фоновим електролітом до риски. З одержаного розчину відібрали 5 мл в колбу місткістю 250 мл, знову довели фоновим електролітом до риски і полярографували. Висота хвилі при цьому становила 41 мм. Полярографування стандартних розчинів солі цинку дало такі результати:
С (Zn) 106, г/см3 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
h, мм |
9 |
22 |
34 |
47 |
59 |
|
|
|
|
|
|
Визначте масову частку (%) цинку в аналізованому зразку. |
||||
Розв’язок. |
|
|
|
|
h, мм70 |
|
|
|
|
60 |
|
|
|
|
50 |
hx = 41мм |
|
|
|
40 |
|
|
|
|
|
|
|
|
|
30 |
|
|
|
|
20 |
|
|
|
|
10 |
|
Cx(Zn) = 2,25 10-6 г/см3 |
|
|
0 |
|
|
|
|
0 |
1 |
2 |
3 |
4 |
|
|
|
С (Zn) 106 г/см3 |
|
Зкалібрувального графіка в координатах h-C встановлюємо вміст цинку
врозчині – 2,25∙10-6 г/см3, і масу цинку у ньому:
m(Zn) |
C(Zn) V (колби2) |
|
V (колби1) |
= |
2,25 10 |
6 250 |
|
500 |
5,625 |
10 5 |
г . |
|
1000 |
V (піпетки) |
1000 |
5 |
|||||||||
|
|
|
|
|
|
|
||||||
Масова частка цинку у стоматологічному сплаві:
Zn m(Zn) 5,625 10 5 100% 0,072 %.
mсплаву 0,0785
Задача 2. Визначте вміст ніколу у 150 мл досліджуваного розчину в г, якщо при полярографуванні цього розчину висота хвилі становила 36 мм.
28

Висота хвилі для стандартного розчину, що містить 2,4 10-3 моль/л солі ніколу,
становила 59 мм. |
|
|
|
|
|
|
|
|
|||||||
Розв’язок. |
|
Згідно методу стандартів: |
|
||||||||||||
C |
|
(Ni) |
hx |
|
C |
|
|
36 |
2,4 10 3 |
1,46 10 3 моль / л. |
|
||||
x |
|
ст |
|
|
|||||||||||
|
|
hст |
|
|
|
59 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Тоді m(Ni) |
|
C(Ni) V (колби) M (Ni) |
|
1,46 10 3 150 58,7 |
0,01285 г. |
||||||||||
|
|
|
|
|
1000 |
|
1000 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Задача 3. Для визначення вмісту кадмію у фарбі її наважку 10,12940 г розчинили і об'єм розчину довели до 50 мл. При полярографуванні 15,0 мл цього розчину висота хвилі становила 21 мм. Після добавки 2 мл стандартного розчину Cd(NО3)2 з концентрацією 0,0430 М висота хвилі зросла до 33,5 мм. Визначте масову частку (%) кадмію у фарбі.
Розв’язок. За методом добавок з врахуванням розбавлення стандартного розчину розрахуємо концентрацію кадмію в досліджуваному розчині:
Cx |
|
CстVст hx |
|
|
0,0430 2 21 |
0,0071 M . |
|||
hх ст (Vx Vст ) hxVx |
|
2) 33,5 21 15 |
|||||||
|
(15 |
|
|
||||||
Тоді маса кадмію в 50 мл розчину становить: |
|||||||||
m(Cd ) |
C(Cd ) V (колби) M (Cd ) |
= |
0,0071 50 112 |
0,0398 г , |
|||||
|
|
||||||||
|
|
1000 |
|
|
1000 |
|
|
||
а його масова частка у фарбі відповідно становить:
Cd mCd 100% 0,0399 100% 0,39 % . mнав 10,1940
Задача 4. При дослідженні якісного складу розчину на фоні 1 М КС1 була записана вольтамперна крива, з якої знайшли величину дифузійного Ідиф = 46,5 мкА та залишкового Ізал= 7,0 мкА струмів. Частина кривої на ділянці потенціалів, близьких до Е1/2, описується значеннями:
-Е, В |
0,96 |
0,98 |
1,00 |
1,02 |
1,04 |
1,06 |
1,08 |
1,10 |
І, мкА |
4,1 |
6,2 |
7,3 |
30,5 |
53,3 |
58,3 |
59,8 |
60,2 |
Визначте якісні параметри йона та ідентифікуйте його за табличними значеннями півхвиль деяких елементів у присутності 1 М КС1:
Е1/2(Со(II))= -1,23 В; Е1/2 (Ni(II))= -1,10 В; Е1/2(Zn(II))= -1,02 В; Е1/2(Cd (II))= - 0,64 В.
Розв’язок. Якісним параметром йону є потенціал півхвилі Е1/2, значення якого можна встановити двома способами.
Перший спосіб - графічне встановлення потенціалу півхвилі Е1/2 із зображення полярографічної хвилі. Для цього за даними полярографування будуємо вольтамперну криву (І-(-E)):
29

І, мкА70 |
|
|
C |
|
D |
|
60 |
|
|
|
|
|
|
|
|
|
|
|
|
|
50 |
|
|
|
|
|
|
40 |
|
|
|
|
|
|
30 |
|
|
|
|
|
I диф. |
|
|
|
|
|
|
|
20 |
|
|
|
|
1/2 І диф. |
|
|
|
|
|
|
|
|
10 |
A |
B |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
I зал. |
|
|
|
|
|
|
|
0,95 |
|
1 |
E 1/2 |
1,05 |
1,1 |
1,15 |
|
|
|||||
|
|
|
|
|
|
-Е, В |
З полярограми шляхом проведення дотичних ліній через ділянки АВ, ВС та СD до взаємного перетину, як це показано на рисунку, можна знайти величину залишкового Ізал та дифузійного Ідиф. струмів. Поділивши значення дифузійного струму на половину (1/2 Ідиф.) проводимо пряму, паралельну осі Е, до перетину її з полярографічною хвилею. З місця перетину опускаємо перпендикуляр на вісь Е і знаходимо значення Е1/2 = - 1,02 В.
За другим способом використаємо залежність, основану на рівнянні
Гейровського-Ільковича: E E |
|
R T |
ln |
I |
E |
|
0,059 |
lg |
I |
, яка є |
||
|
|
|
|
|
|
|||||||
1/ 2 |
|
n F |
|
(Iд І) |
1/ 2 |
|
n |
(Iд І) |
|
|||
|
|
|
|
|
|
|||||||
прямою, що не проходить через початок координат за віссю Е.
Для цього заповнимо таблицю (для перших двох значень таблицю заповнювати не потрібно, оскільки значення сили струму для них є меншим, ніж Ідиф= 7 мкА і розрахунки втрачають сенс, аналогічно для останніх трьох, оскільки для них значення сили струму є більшим за суму (Ідиф+Ізал)):
|
|
|
|
|
|
I |
|
lg |
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-Е, В |
І0 |
І=І0-Ізал |
Ідиф-І |
|
І диф І |
|
І диф І |
|
|||
|
0,96 |
4,1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,98 |
6,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,00 |
7,2 |
0,2 |
46,3 |
|
0,004 |
|
|
-2,365 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,02 |
30,5 |
23,5 |
23,0 |
|
1,02 |
|
|
0,001 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,04 |
53,3 |
46,3 |
0,2 |
|
231,5 |
|
|
2,364 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,06 |
58,3 |
51 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,08 |
59,8 |
52 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,10 |
60,2 |
53 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
За розрахованими даними будуємо пряму в координатах |
|
lg(I/(Ідиф-І)/-Е, |
||||||||||
місце перетину якої з віссю –Е дає нам значення Е1/2:
30
