
- •Міністерство освіти україни
- •Лабораторна робота №1. Правила роботи в хімічній лабораторії. Знайомство з посудом. Зважування.
- •Лабораторна робота №2. Основні класи неорганічних сполук, генетичний зв’язок між ними
- •Лабораторна робота №3. Швидкість хімічних реакцій
- •Лабораторна робота №6. Приготування розчинів. Способи вираження концентрацій розчинів.
- •Приготування розчинів з заданою масовою часткою речовини в розчині (з твердої речовини та води).
- •Хід роботи
- •Запитання для самоконтролю
- •Завдання для самоконтролю
- •Лабораторна робота №7. Колоїдні розчини
- •Лабораторна робота №8 Теорія електролітичної дисоціації
- •5. Забарвлення індикаторів
- •Завдання для самоконтролю
- •Лабораторна робота №9. Реакції в розчинах електролітів.
- •Завдання для самоконтролю
- •Лабораторна робота №10. Кислотно-основне титрування
- •Хід роботи
- •Лабораторна робота №11. Водневий показник – рН
- •Завдання для самостійної роботи
- •Лабораторна робота №12. Гідроліз солей
- •Завдання для самостійної роботи
- •Лабораторна робота №13. Окисно-відновні реакції
- •Завдання для самоконтролю
- •Лабораторна робота №14. Електрохімічний потенціал. Визначення ерс гальванічного елемента.
- •1. Що таке гальванічний елемент?
- •2. Символічний запис гальванічних ланцюгів.
- •3. Виникнення стрибка потенціалу на межі розділу фаз
- •4. Стандартний водневий електрод. Електродний потенціал. Стандартний (нормальний) електродний потенціал
- •5.Вимірювання ерс гальванічних елементів Вимоги до вхідного опору вольтметра. Похибки вимірювання.
- •6. Електрична схема, що моделює вимірювання ерс гальванічного елемента.
- •6. Абсолютна похибка і відносна похибки
- •Значення ерс гальванічних ланцюгів
- •Лабораторна робота №15.Комплексні сполуки
- •Література Основна
- •Додаткова
Лабораторна робота №8 Теорія електролітичної дисоціації
Мета: Виконати досліди, що підтверджують основні положення теорії електролітичної дисоціації.
Реактиви: 1н HCl, 1н H2SO4, 1н та 2н CH3COOH, 1н та 2н NaOH, 1н KOH, 1н та 2н NH4OH, 1н KCl, 1н NaCl, 1н КNO3,. 1н Na2SO4, 1н КNO3, 1н CH3COONa, 2н CaCl2, NH4Cl(кр.) спиртовий розчин фенолфталеїну (індикатор), розчин метилового оранжевого (індикатор), розчин лакмусу (індикатор).
Обладнання: ВСА, амперметр, реостат, електроди, фільтрувальний папір, стакани на 100-200мл.
|
N п/п |
Хід виконання досліду |
Рівняння реакції |
Спостереження |
Висновки |
|
1. Вивчення електропровідності кислот, солей та гідроксидів | ||||
|
1а |
Зібрати схему згідно рис.1. Вивчення електропровідності кислот. В три склянки налити по 50мл 1н, розчинів соляної, сірчаної та оцтової кислот. Занурити в склянку з соляною кислотою електроди. Потім занурити електроди послідовно в склянки з сірчаною і оцтовою кислотами. Перед кожний із вимірів електроди промивають дистильованою водою та витирають фільтрувальним папером. |
Записати рівняння електролітичної дисоціації кислот. |
Записати покази амперметра.
|
Порівняти електропровідність кислот і сформулювати висновки, що до їх сили. |
|
1б |
Вивчення електропровідності гідроксидів. Вивчити електропровідність , 1н NaOH, 1н KOH, 1н NH4OH.
|
Записати рівняння електролітичної дисоціації кислот. |
Записати покази амперметра.
|
Порівняти електропровідність гідроксидів і сформулювати висновки, що до їх сили. |
|
1в |
Вивчення електропровідності солей. Вивчити електропровідність , 1н KCl, 1н NaCl, 1н КNO3,. 1н Na2SO4, 1н CH3COONa. |
Записати рівняння електролітичної дисоціації солей. |
Записати покази амперметра. |
Порівняти електропровідність солей і зробити висновки, що до сили електролітів утворених розчиненням гарно розчинних солей у воді. |
|
1г |
Вивчення електропровідності сумішей кислот та гідроксидів. В одну склянку налити 50мл 2н CH3COOН, в другу 50 мл 2н NH4OH. Вивчити електропровідність 2н CH3COOН та 2н NH4OH. Невиймаючи електродів із стакану до розчину NH4OH додати еквівалентну кількість розчину CH3COOН. |
Записати рівняння електролітичної дисоціації кислоти, гідроксиду, солі, та рівняння реакції в молекулярному і іонному вигляді. |
Записати покази амперметра. |
Зробити висновок, що до сили вихідних та утвореного в результаті реакції електролітів. |
|
2. Дисоціація солей та сольватація іонів | ||||
|
2а |
Взяти близько 200мг CuCl2, відмітити колір твердої солі. Розчинити сіль в декількох краплях води. Потім поступово додавати при перемішуванні воду в пробірку з розчином солі. |
Записати рівняння електролітичної дисоціації солі. |
Відмітити колір твердої солі. Відмітити колір розчину солі. Спостерігати зміну забарвлення. |
Пояснити явища. |
|
2б |
Розчинити 100мг CuCl2 в 5-10мл ацетону. Потім поступово додавати при перемішуванні воду в пробірку з розчином солі. |
|
Відмітити колір твердої солі та колір розчину солі в ацетоні. Спостерігати зміну забарвлення розчину при додаванні води. |
Пояснити явища. |
|
3. Порівняння хімічної активності сильних та слабких електролітів | ||||
|
3а |
В одну пробірку налити 5мл 1н HCl, в другу - стільки 1нCH3COOH, помістити в кожну із пробірок по однаковому шматочку цинку. |
Записати рівняння реакції в молекулярному і іонному вигляді. |
Відмітити різну швидкість виділення газу в пробірках. |
Порівняти хімічну активність сильного електроліту - соляної кислоти і слабкого електроліту - оцтової кислоти, Пояснити результати досліду користуючись даними про ступінь електролітичної дисоціації цих кислот, (Бабич Л.В, и др., Практикум по неорганической химии, -Н,: Просвещение, 1991. -С.311, -Табл,8) |
|
3б |
Налити в дві пробірки розчин CaCl2, В одну з пробірок добавити 2н NaOH, а в іншу такий же об'єм 2н NH4OH(розчини повинні бути без карбонатів !!!) |
Записати рівняння реакції в молекулярному і іонному вигляді. |
В якій із пробірок випадає осад, а в якій –ні. |
Пояснити причину різної дії гідроксидів на кальцій хлорид. |
|
4. Хімічна рівновага в розчинах електролітів | ||||
|
4 |
Налити в пробірку 10-15мл води і додати дві краплі фенолфталеїну та 3-4 краплі 2н NH4OH. Розлити розчин у дві пробірки і в одну з них додати близько 50мг кристалів NH4Cl. |
Записати рівняння електролітичної дисоціації гідроксиду та солі. |
Відмітити забарвлення індикатору.
Порівняти забарвлення індикатора в обох пробірках. |
На основі принципу Ле-Шательє пояснити зміщення рівноваги дисоціації слабкого електроліту після додавання NH4Cl. |
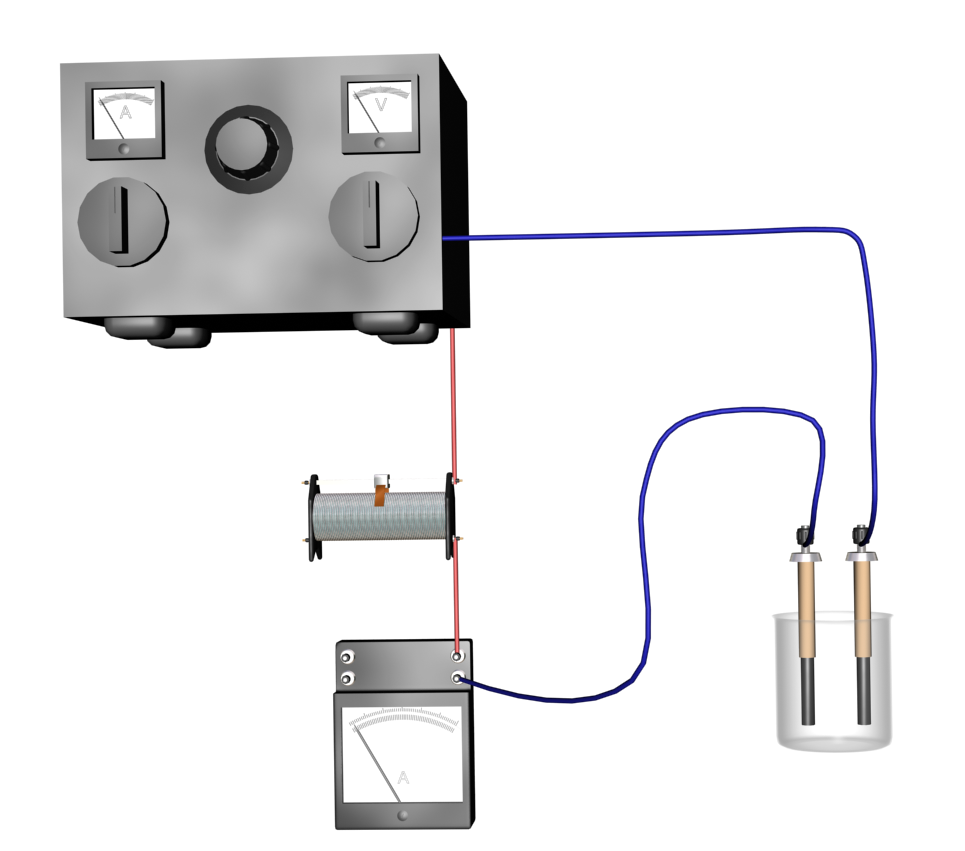
Р ис.1.
Установка для вимірювання електропровідності
електролітів:
ис.1.
Установка для вимірювання електропровідності
електролітів:
1- джерело постійного струму, 2- реостат, 3-амперметр, 4-вугільні електроди, 5 – ізолятори, 6 – стакан.
