
- •Міністерство освіти україни
- •Лабораторна робота №1. Правила роботи в хімічній лабораторії. Знайомство з посудом. Зважування.
- •Лабораторна робота №2. Основні класи неорганічних сполук, генетичний зв’язок між ними
- •Лабораторна робота №3. Швидкість хімічних реакцій
- •Лабораторна робота №6. Приготування розчинів. Способи вираження концентрацій розчинів.
- •Приготування розчинів з заданою масовою часткою речовини в розчині (з твердої речовини та води).
- •Хід роботи
- •Запитання для самоконтролю
- •Завдання для самоконтролю
- •Лабораторна робота №7. Колоїдні розчини
- •Лабораторна робота №8 Теорія електролітичної дисоціації
- •5. Забарвлення індикаторів
- •Завдання для самоконтролю
- •Лабораторна робота №9. Реакції в розчинах електролітів.
- •Завдання для самоконтролю
- •Лабораторна робота №10. Кислотно-основне титрування
- •Хід роботи
- •Лабораторна робота №11. Водневий показник – рН
- •Завдання для самостійної роботи
- •Лабораторна робота №12. Гідроліз солей
- •Завдання для самостійної роботи
- •Лабораторна робота №13. Окисно-відновні реакції
- •Завдання для самоконтролю
- •Лабораторна робота №14. Електрохімічний потенціал. Визначення ерс гальванічного елемента.
- •1. Що таке гальванічний елемент?
- •2. Символічний запис гальванічних ланцюгів.
- •3. Виникнення стрибка потенціалу на межі розділу фаз
- •4. Стандартний водневий електрод. Електродний потенціал. Стандартний (нормальний) електродний потенціал
- •5.Вимірювання ерс гальванічних елементів Вимоги до вхідного опору вольтметра. Похибки вимірювання.
- •6. Електрична схема, що моделює вимірювання ерс гальванічного елемента.
- •6. Абсолютна похибка і відносна похибки
- •Значення ерс гальванічних ланцюгів
- •Лабораторна робота №15.Комплексні сполуки
- •Література Основна
- •Додаткова
4. Стандартний водневий електрод. Електродний потенціал. Стандартний (нормальний) електродний потенціал

Рис.5. Будова водневого електрода
Спочатку розглянемо будову стандартного водневого електрода.
Електрод
складається із покритої електрохімічнo
високодисперсною платиною платинової
пластинки ( 5(1)) зануреної в розчин (2) в
якому активність катіонів водню 1моль/л
(на практиці Cм(H2SO4)=1),
і на платинову пластинку пропускають
при тиску 1атм. водень. При цьому
встановлюється рівновага H22H++2![]() (4).
(4).
Електродний потенціал такого електрода залежить від концентрації іонів водню і тиску водню на поверхні електроду та температури.
![]()
Електродним потенціалом називають ЕРС гальванічного елемента, одним із напівелементів якого є стандартний (нормальний) водневий електрод (н.в.е.).
Якщо
всі стрибки потенціалу, пов’язані з
наявністю н.в.е., взяти рівними нулю і
якщо елімінувати дифузійний стрибок
потенціалу, то можна умовно вважати, що
значення електродного потенціалу
зводиться до стрибка потенціалу, для
металевого електроду, на межі метал-розчин.
(Слід
підкреслити умовність такого визначення,
бо ЕРС з н.в.е. включатиме і контактну
різницю потенціалів на межі метал-платина
(Pt-Me), але оскільки ця величина незначна
нею можна знехтувати.).
Елімінувати ж дифузійний стрибок
потенціалу (стрибок потенціалу, що
виникає із-зі різної швидкості дифузії
(рухомості) катіонів і аніонів) можна
застосовуючи сольовий місток — розчин
в якому рухомості катіонів і аніонів
рівні (Uк=
Uа).
Для цього на практиці застосовують
розчин КСl де
![]() .
.
Нормальним (стандартним) електродним потенціалом даного металу називають потенціал електрода виміряний відносно стандартного водневого електрода при активності катіонів цього ж металу в розчині рівній одному молю. Нормальні (стандартні) електродні потенціали можна знайти у відповідних таблицях.
Зрозуміло, що при збільшенні концентрації іонів металу (який є електродом) в електроліті згідно принципу Ле-Шательє кількість катіонів металу які перейдуть на електрод стане більшою (рис.3) - електрод набуде більш позитивного потенціалу. При зменшенні концентрації іонів металу в електроліті навпаки - електрод набуде більш негативного потенціалу. Знаючи стандартний електродний потенціал металу Е0 - завжди можна розрахувати потенціал за рівнянням Нернста:
![]()
де
![]() - активність іонів металу
в розчині
- активність іонів металу
в розчині
Для досить розбавлених розчинів активність в рівнянні можна замінити на концентрацію.
![]()
Розраховувавши потенціали напівелементів Е1 та Е2 легко знайти ЕРС гальванічного елементу як різницю потенціалів: Егальв. елемент.= Е2-Е1.
5.Вимірювання ерс гальванічних елементів Вимоги до вхідного опору вольтметра. Похибки вимірювання.
Гальванічний елемент має певний внутрішній опір Re. Гальванічний елемент можна зобразити двома послідовно з’єднаними елементами електричної схеми — активним опором Re і джерелом напруги Е.р.с. (6).
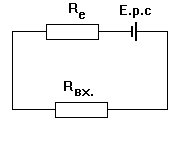
6. Електрична схема, що моделює вимірювання ерс гальванічного елемента.
Як прилад для вимірювання напруги застосовують вольтметр. Кожний вольтметр має якийсь певний внутрішній опір Rвх. Зараз для вимірювання ЕРС застосовують найчастіше електронні вольтметри, в яких вхідний опір складає декілька мОм або декілька ГОм.
Застосовуючи закон Ома для зображеного електричного ланцюгу маємо: Е.р.с.=I(Re+Rвх)=Ее+Ев (25) де Ее іЕв відповідно падіння наруги на гальванічному елементі і на вольтметрі. Вольтметр показує значення Ев, а не ЕРС. Перетворимо вираз (25) розв’язуючи його відносно I отримаємо:
![]() (27)
(27)
![]() (28)
(28)
ОскількиЕе=I Rе, Ев=I Rвх, велична сили струму на послідовно замкнених приладах однакова; опір гальванічного елемента складає від декількох Ом до сотень Ом, а вхідний опір вольтметра складає декілька мОм або декілька кОм то відповідно можна вважати I Rе0 тоді ЕвЕ.р.с.
Оскільки зараз для вимірювання ЕРС застосовують найчастіше електронні вольтметри, в яких вхідний опір складає декілька мОм або декілька ГОм, а опір гальванічного елемента найчастіше лише декілька Ом або декілька десятків Омів, тому велична похибки незначна і складає менше 1%.
